Behandlungskonzepte und aktuelle Entwicklungen
VNR: 2760602021259980006
Prof. Dr. med. Thomas W. Kraus, Dr. med. Stefan Berkhoff, Dr. med. Kerstin Grimm, Dr. med. Peter Heinz, Dr. med. Moustafa Elshafei, Dr. med. Thomas Huckle, PD. Dr. med. Uta Kraus-Tiefenbacher, Prof. Dr. med. Elke Jäger, Dr. med. Bettina Heise
Inzidenz
Das kolorektale Karzinom (KRK) ist mit jährlich über 50.000 Neudiagnosen eine der häufigsten Tumorentitäten in Deutschland. Die Erkrankungsrate ist in Altersgruppen ab 55 Jahre geschlechtsunabhängig rückläufig. Für den Rückgang ist vermutlich die regional konsequentere Umsetzung von Vorsorgekoloskopien verantwortlich. Nach dem Brustkrebs ist das KRK gegenwärtig der zweithäufigste maligne Tumor in Deutschland, gefolgt vom Prostatakarzinom. Jährlich versterben etwa 25.000 Patienten an dieser Erkrankung [1–3].
Risikofaktoren
Als Risikofaktoren für die Entwicklung des KRK gelten vor allem ein hohes Alter und der Nachweis von Adenomen bzw. anderen Dysplasien der Kolonschleimhaut. Als weitere Ursachen werden Rauchen, Adipositas, ballaststoffarme Nahrung, Vitamin D-Mangel und hohe Nitratbelastung diskutiert. Metaanalysen deuten auf eine inverse Assoziation zwischen körperlicher Aktivität und dem Auftreten von Darmkrebs hin. Chronisch entzündliche Darmerkrankungen sind häufiger mit KRK assoziiert, die Inzidenz ist jedoch eher rückläufig [1–3].
Anatomische Abgrenzung/ Tumorlokalisationen
Die Abgrenzung zwischen Rektum- und Kolonkarzinomen ist primär anatomisch, sekundär embryologisch begründet. Regional onkologisch gruppiert unterscheiden wir am Dickdarm das rechte und linke Kolon sowie das Rektum im engen knöchernen Becken. Die splenische Kolonflexur wird als Grenzzone zwischen linkem und rechtem Kolon definiert. Das rechtsseitige Kolon ist ein embryologisches Derivat des Mitteldarms. Das linke Hemikolon ist Derivat des Enddarms.
Das Rektum weist anatomische Besonderheiten auf, die chirurgisch sehr relevant sind. Es liegt sub- bzw. extraperitoneal. Eine enge Beziehung besteht ventral zum Urogenitaltrakt. Das Rektum hat keinen Serosaüberzug, ist aber von einem Fett- und Lymphgefäß-Mantel umhüllt, dem sog. Mesorektum. Das Mesorektum ist durch die zirkumferenzielle mesorektale Faszie zum knöchernen Becken abgegrenzt. Die längsverlaufende Muskulatur des Rektums setzt sich über die Linea dentata nach distal als M. sphincter ani internus bis zur palpatorisch erfassbaren Anokutanlinie am unteren Ende des Analkanals fort (Intersphincteric Groove). Hier beginnt die behaarte perianale Haut.
Prognosekriterien
Das Kolonkarzinom ist keine einheitliche Erkrankung, sondern umfasst heterogene Tumor-Subgruppen mit unterschiedlicher Lokalisation, Pathogenese, Morphologie und Prognose. Die exakte Lokalisation der Tumore erweist sich beim KRK zunehmend als ein relevanter, die individuelle Therapiewirksamkeit und Prognose beeinflussender Faktor. Anatomische und embryologische Unterschiede führen je nach Lokalisation zu einer diversen Expression von Genen oder Gengruppen in den Tumoren mit klinisch erkennbarer onkologischer Relevanz.
Klinisch fiel schon lange auf, dass Patienten mit Rektum- und Sigmakarzinom überwiegend männlich und vergleichsweise jünger sind. Patienten mit rechtsseitigen Kolontumoren sind demgegenüber häufiger weiblich und durchschnittlich älter. Etabliertes Prognosekriterium beim KRK ist das UICC-Stadium, definiert durch Tumorgröße und Tiefeninfiltration (T-Stadium), dem Nachweis regionaler Lymphknoten-Metastasierung (N-Stadium) sowie von Fernmetastasen (M-Stadium) [4].
Risikogruppierung und Tumor-Grading
Mittels histologischer Kriterien wird ein Tumor-Grading (G I-III) definiert. Kategorisierend wird bei frühen T1-Tumoren eine High-Risk-Gruppe (T1/L0/G1/2/Budding-Grad > 1) und eine Low-Risk-Gruppe (T1/L1 und/oder G3/Budding-Grad 1) unterschieden. Die Gruppierung hat für differenzierte Therapieentscheidungen bei frühen T1-Tumoren eine Bedeutung. Für das Stadium III wird eine moderate Risikogruppe (T1–3, N1) von einer Hochrisikogruppe (T4 oder N2) abgegrenzt. Diese Feingradierungen können helfen, das Aggressionsniveau der onkologischen Therapie im Einzelfall zu definieren. Posttherapeutisch sind die Qualität der chirurgischen Resektion (R-Status) und histologisch der Nachweis von Lymph-, Blutgefäß- und Nerveninfiltrationen von prognostischer Bedeutung [3–4].
Molekularbiologische Tumorcharakterisierung
Es ist Vision, die Wirksamkeit systemischer Therapie oder die Prognose mittels molekularer Charakterisierung von Tumorbiopsien vorhersagen zu können. Es gibt hierzu Studien und einige interessante Pfade, aber noch keine eindeutig prädiktiven Marker. Die Molekularbiologie hat bei der Therapieplanung bei fortgeschrittenen und metastasierten Tumoren schon heute eine große, bei Frühkarzinomen allerdings noch keine relevante Bedeutung. Die Tumorlokalisation im rechten Kolon ist prognostisch eher ungünstig zu bewerten (Right-Sidedness) [3–6], siehe Tab. 1.
Tab. 1: Ausgewählte onkologische Chakterisierungsoptionen beim KRK |
Mikrosatelliteninstabilität (MSI-H) |
Immunscore basierend auf Dichte tumorinfiltrierender Lymphozyten (CD3/CD8) |
Genomische Analyse der Consensus Molecular Subtypes (CMS) |
CDX2-Protein |
Phosphoinositid-3-Kinase |
Zirkulierende Tumor-DNA |
HER-2-Amplifikation |
POLE-Gen-Mutationen |
Onkogene RAS und BRAF mit Mutationen des EGFR-Signalweges |
Stellenwert einer lokalen Tumorexzision
Frühe KRK der Kategorie T1 ohne onkologische Risikofaktoren können durch lokale Therapie (Polypektomie oder Submukosaresektion) organerhaltend behandelt werden. Ergibt die Histologie eines entfernten Tumors/Polypen ein T1-Karzinom, kann auf eine chirurgische Nachresektion verzichtet werden, wenn es sich um eine Low-Risk-Situation bei histologisch tumorfreier Polypenbasis handelt. In der High-Risk-Situation sollte auch bei T1 eine chirurgische Nachresektion erfolgen, selbst wenn die Läsion komplett entfernt wurde (Inzidenz regionaler LK-Metastasen ca. 20 %). Bei inkompletter Tumorentfernung soll auch in der Low-Risk- Situation nachreseziert werden [3–7].
Chirurgisch-onkologische Grundprinzipien: Zentrale Lymphknotendissektion/Longitudinaler Sicherheitsabstand
Die Qualität der chirurgischen Therapie bei lokal fortgeschrittenem KRK ist ein entscheidender, die Langzeitergebnisse wesentlich mitbestimmender Faktor. Dies gilt herausgehoben für die Primärtherapie des regional begrenzten KRK unter kurativer Zielsetzung. Die chirurgische Therapie ist definiert und standardisiert. Sie zielt in allen Lokalisationen auf vollständige Entfernung des Primärtumors und der regionalen Lymphknoten. Umgesetzt wird dieses Ziel durch Segmentresektion des betroffenen Darmabschnittes mit einem hinreichenden longitudinalen Sicherheitsabstand zum Tumor. Die erfolgreiche Umsetzung ist am pathologischen Präparat später pathologisch transparent überprüfbar (R0 = Im Gesunden entfernt).
Die mesenteriale Ausdehnung der onkologischen Resektion erfolgt „radikulär“ an der Gefäßwurzel (Gekröse). Reseziert wird „zentral-radikal“ am aortalen Abgang der mesenterialen Blut- und parallel verlaufenden Lymphgefäße. Ziel ist die vollständige Entfernung der regionalen Lymphknoten (Turnbull-Prinzip). Die Lymphknotenkollektion eröffnet bei regional begrenzter lymphogener Metastasierung Heilungschancen (Konzept der sequenziellen Metastasierung) und erlaubt eine valide Definition des N-Status als Indikationsbasis für adjuvante Konzepte.
Das Ausmaß des segmentalen Darmverlustes ist am Kolon funktionell in der Regel für die Patienten gut tolerabel. Bei tiefen Rektumresektionen ist die Situation jedoch kritischer einzuschätzen. Hier sind alle chirurgischen Anstrengungen zu unternehmen, die Ampulla recti und die vegetativen Nervenfasern des Plexus hypogastricus inferior und superior zu erhalten, wenn dies onkologisch zu vertreten ist. Es drohen gravierende funktionelle Störungen des Kontinenzorgans, die unten beschrieben werden (LARS) [3–4, 8–9].
Totale Mesorektum Exzision (TME)/ Mesokolische Exzision (CME)
Onkologisch-chirurgisch wird eine schichtgerechte Präparation entlang der embryonalen Grenzzonen gefordert. Unvollständige Resektionen der regionalen Mesenterien oder Verletzungen der Grenzschichten (Mesorektum/Faszia gerota zum Retroperitoneum) begünstigen die intraoperative Tumorzelldissemination und reduzieren die regionale Lymphknotenausbeute. Dies ist prognostisch relevant.
Die onkologische Bedeutung der schichtgerechten Präparation wurde zuerst für das Rektumkarzinom nachgewiesen. Durch konsequente Einführung der TME (Ausräumung des perirektalen Mesofettkörpers entlang der Hüllfaszie) konnte die Lokalrezidivrate von zuvor 25 % auf unter 10 % gesenkt. Gleichzeitig wurde das Langzeitüberleben verbessert.
In Analogie zur TME beim Rektum hat sich für Kolonkarzinome die komplette mesokolische Exzision (CME) als onkologisches Konzept etabliert. Technisch wird auf die exakte chirurgische Präparation zwischen der mesokolischen und parietalen Faszie und auf die wirklich zentrale Durchtrennung der Tumorversorgende Arterien fokussiert. Hervorgehoben analysiert wurde dies für die sehr variable Gefäßanatomie am Kolon aszendens [3–4, 8–9].
Laparoskopische oder konventionelle Tumorresektion
Die Umsetzung der Darmresektionsstrategien ist unabhängig vom Zugangsweg in die Bauch- oder Beckenhöhle. Der operative Zugangsweg kann über abdominelle Schnittführungen (Konventionell) oder durch Trokar-Einstich-Hülsen (MIC – Minimal invasive Chirurgie), bzw. als Hybridvariationen realisiert werden. Die Inhalte der Eingriffe ändern sich strategisch nicht durch Änderung der Zugangswege. Realisierungsgrad, Sicherheit oder die Umsetzungseleganz werden jedoch beeinflusst.
MIC-Techniken zeichnen sich postoperativ durch schnellere Erholung der Patienten, schmerzärmere Verläufe und raschere Mobilisierungsgrade aus. Langfristig stehen eine bessere Ästhetik, geringere intraabdominelle Verwachsungen sowie eine geringere Narbenhernienquote in der positiven Bilanz.
Die Machbarkeit onkologisch konsequenter laparoskopischer Resektionen beim KRK aller Lokalisationen (Kolon und Rektum) wurde vielfach gezeigt, wenn auch kontrovers diskutiert. In prospektiv randomisierten Studien und Metaanalysen konnte hinreichend bewiesen werden, dass etablierte Sicherheitskriterien konventioneller Tumorchirurgie eingehalten werden können. MIC ist heute, unter der Grundannahme einer Durchführung durch auf diesem Feld erfahrene Operateure, als sicher und onkologisch gleichwertig anzusehen. Die Hypothese und auch Hoffnung, dass durch MIC eine weitere Verbesserung onkologischer Ergebnisse gegenüber der konventionellen Chirurgie erreicht werden kann, ist jedoch noch nicht bewiesen. Obwohl einzelne Studien eine niedrigere stadienabhängige tumorassoziierte Mortalität nach MIC feststellten, wurde in Metaanalysen bisher (noch) kein wirklich signifikanter onkologischer Vorteil belegt.
In Deutschland wird im europäischen Vergleich beim KRK noch immer weniger häufig laparoskopisch reseziert. Valide Zahlen sind nur begrenzt verfügbar. Gegenwärtig werden etwa 30–40 % der Eingriffe beim KRK durch MIC umgesetzt, bevorzugt bei Tumoren des Sigmas, Rektums und des rechten Hemikolons. Es ist davon auszugehen, dass sich der MIC-Anteil zukünftig weiter erhöhen wird. Im eigenen Zentrum am Krankenhaus Nordwest liegt die MIC-Quote der Primär-Resektionen aktuell bei ca. 60 %, selektiv für das Rektum-Karzinom schon bei 70 % [8, 9].
Transanale totale mesorektale Exzsion (TaTME)
Die TME ist bei tiefer Tumorlokalisation im engen männlichen Becken, bei Adipositas und fettreichem Mesorektum konventionell-chirurgisch oft mühsam und onkologisch traumatisch. Auch laparoskopisch ist die saubere Umsetzung nicht selten schwierig. Gerade das tiefe Becken ist durch die sich nach distal krümmende Zugangs- und Blickachse und die Sichtbehinderung durch den obstruktiven Tumor eine chirurgische Herausforderung. Um diese Situation zu erleichtern, wurde ein MIC-Verfahren entwickelt, bei dem sämtliche TME-Schritte (Rektummobilisation und Exzision des Mesorektums) simultan von abdominell als auch über einen transanalen Zugang umgesetzt werden. Beide OP-Teams treffen sich präparatorisch in der Mitte des Präparationsweges im kleinen Becken (wie beim Bergbau).
Der Vorteil des bilateral simultanen Vorgehens liegt in der Verkürzung der OP-Zeit und in einer potenziell besseren Übersicht im tiefen Becken. Der Aufwand ist allerdings erheblich (2 OP-Teams, 2 MIC-Türme, spezielle Saug- und Belüftungssysteme etc.). Der gegenüber klassischer MIC durch TaTME potenziell besseren Übersicht und der realisierten Problemvermeidung im schwierigen Becken (Mehrfachstaplereinsatz, Mesoverletzungen, Coning etc.) stehen nun neue Probleme entgegen (Sphinkterdehnung, Urethraverletzung, C02-Embolie). Die TaTME-Methode scheint bei sehr distal lokalisierten Rektumkarzinomen unter Studienbedingungen als Alternative zur transperitonealen MIC sinnvoll zu sein, wenn die Tumorlage ohnehin eine peranale supra- oder interspinktäre Anastomose erforderlich macht. Eine abschließende Bewertung der TaTME -Methode ist noch nicht möglich [10].
Roboterassistierte kolorektale Chirurgie
Roboterassistierte Chirurgie ist konzeptionell attraktiv und findet auch in der kolorektalen Chirurgie einen zunehmenden, hauptsächlich durch die finanziellen Aufwände gebremsten Einsatz. Zur Bewertung des klinischen Nutzens existieren Fallserien und retrospektive Untersuchungen. Roboterassistierte Chirurgie könnte besonders beim schwierig zu operierenden tiefen Rektumkarzinom im Vergleich zur konventionellen MIC Vorteile haben. Wahrscheinlich bestehen geringere Konversions- und Komplikationsraten.
Die Robotikchirurgie ist jedoch kein automatisierter oder gar autonomer Ablauf, wie die Terminologie erwarten lässt. Robotikchirurgie ist aktuell immer eine Telemanipulatorchirurgie. Die Robotik und die angebundene Plattform dienen dem Chirurgen bei der gezielten Bewegung der die Instrumente führenden Arme und damit der Umsetzung einer besonders feinen Präparation bzw. filigraner Nahtbewegungen. Bewegungen der Instrumente über eine Art von „Joystick“ sind extrem präzise. Die Präparation ist für den sitzenden Chirurgen zudem physisch komfortabel. Der Chirurg sieht zudem detaillierter. Das Bild ist exakt und ruhig, da ebenfalls robotisch assistiert.
Vielfache Unterstützungssysteme, zum Teil mit künstlicher Intelligenz, stehen in Erprobung. Diese Systeme (z. B. Indocyaningrün-Farbstoffinjektion zur Durchblutungsquantifizierung, Projektion von Röntgenbildern, Virtual-Reality/Anatomieerkennung, Fehlerwarnungen, Videoaufzeichnungen, Bildwiederholung, optischer Zoom, 3D-Bild, Telekommunikation) werden für zukünftige Ergebnisverbesserungen maßgeblich sein. Das jedenfalls ist Vision. OP-Konzepte und Strategien werden durch die Robotiktechnologie bislang nicht fundamental verändert. Marketing-Aspekte spielen bei der Anschaffung von OP-Robotiksystemen heute eine relevante Rolle. Die Kosten der Technologie sind hoch und noch nicht im DRG-System inkludiert [8–10].
Perioperative Therapie
In allen Tumorstadien ist die chirurgische Entfernung des Tumors bei einer auf Heilung abzielenden Behandlung unverzichtbar und Leitlinien-Goldstandard. Die Indikation zu einer additiv begleitenden perioperativen System- und/oder Radiotherapie (RT) zielt auf zusätzliche Ergebnisverbesserung. Die perioperative Behandlung wird in präoperativ „neoadjuvante“ und postoperativ „adjuvante“ Ansätze untergliedert.
Neoadjuvante Therapie
Kolonkarzinome aller Lokalisationen werden unter kurativer Intention in der Regel primär, das heißt ohne Vorbehandlung chirurgisch reseziert. Eine neoadjuvante Vorbehandlung ist aktuell unabhängig von T- und N-Stadium nicht indiziert. Dies gilt auch für alle Rektumkarzinome im oberen Drittel. Für lokal fortgeschrittene Kolonkarzinome wird in Studien der potenzielle Nutzen einer neoadjuvanten Chemotherapie offensiv analysiert. Jüngste Daten zeigen für Subgruppen (MSH-I – mikrosatelliteninstabile Tumore) einen kleinen Behandlungsvorteil nach neoadjuvanter Therapie. Die Vorhersage der Wirksamkeit einer neoadjuvanten Therapie ist noch eine Vision. Noch gibt es für die Vorhersage des Ansprechens keine validen Marker.
Für das lokal fortgeschrittenen Rektumkarzinom des unteren und mittleren Drittels im Stadium T3/4 und alle N1-Stadien ist eine neoadjuvante Therapie unstrittig indiziert. Tumore des mittleren und unteren Rektums sollen im Stadium UICC-II und UICC-III (jeder LK-Befall N1/2 und T-Stadien T3/T4 unabhängig von LK-Befall) neoadjuvant mittels Radiochemotherapie (RCT) behandelt werden. Ziel der Neoadjuvanz ist am Rektum die Tumorverkleinerung (Downsizing).
Gleichzeitig soll die chirurgische Resektion entlang der mesorektalen Faszie onkologisch noch sicherer gemacht werden (Downstaging). Die Induktion einer Tumorverkleinerung bei sehr distaler Lokalisation ist ein gesondertes Indikationskriterium zur Chancenverbesserung des Sphinktererhalts (unabhängig vom UICC-Stadium). Die Kombination aus chirurgischer TME und RCT bewirkt stadienabhängig eine signifikante Reduktion der Lokalrezidivrate [1–4, 11–14].
Adjuvante Therapie
Bei Kolonkarzinomen jeglicher Lokalisation ist eine adjuvante Therapie im UICC-Stadium II bei lokal fortgeschrittenen und nodal-negativen Tumoren nach der S3-Leitlinie nur bei Vorliegen besonderer onkologischer Risikofaktoren zu erwägen (T4-Tumor, geringe entfernte LK-Zahl < 12, stattgehabte Tumorperforation, Notfall-OP). Die Datenlage zum onkologischen Zusatznutzen ist ohne Begründung einer speziellen Risikosituation eher schwach. Bei Kolonkarzinomen im UICC Stadium III (Regionale Lympknotenmetastasierung) wird eine adjuvante Chemotherapie dagegen klar empfohlen. Standardtherapie ist hier seit Jahren die Kombination aus Oxaliplatin und 5-FU (MOSAIC-Studie). Problematisch ist die Neurotoxizität (ca.15 % nach vier Jahren). Bei Patienten über 70 Jahre sollte Oxaliplatin adjuvant eher nicht eingesetzt werden.
Das Stadium III ist prognostisch sehr heterogen. Die onkologische Heterogenität ist vor allem assoziiert mit dem Anteil der tumorbefallenen Lymphknoten in Bezug auf alle entfernten Lymphknoten (Lymph-Node-Ratio – LNR). Die LNR beeinflusst daher die Empfehlung zur Dauer der adjuvanten Therapie. Eine molekulare Charakterisierung ist für die Planung des adjuvanten therapeutischen Vorgehens noch nicht etabliert [1–4, 11–14].
Fernmetastasen und palliative Systemtherapie
Das UICC-Stadium IV ist durch Fernmetastasierung charakterisiert. Fernmetastasen werden beim KRK primär in Leber und Lunge, später oft auch in der Peritonealhöhle beobachtet. Bei 30 % betreffen die Metastasen zunächst nur ein Organ. Form und Ausmaß der Metastasierung bestimmen entscheidend die krankheitsspezifische Mortalität. Bei der Mehrzahl der Patienten liegt eine palliative Situation vor. Hier steht die Überlebenszeitverlängerung bei Erhalt der Lebensqualität im Vordergrund.
Die Therapie ist zunehmend individualisiert und präzise, das heißt molekular zielgerichtet (Targeted Therapy). Im Stadium IV erfolgt eine molekularbiologische Charakterisierung der Tumore zur Planung und Effizienzabschätzung der palliativen Therapie. Analysiert wird der RAS/RAF-Status, besonders für Tumore des linken Hemikolons und Rektums. Eine Mutation im KRAS-Gen (Kirsten rat sarcoma viral oncogene homolog) oder NRAS-Gen (Neuroblastoma ras viral oncogene homolog) ist häufig mit einem fehlenden Ansprechen auf eine den EGF-Rezeptor (Epidermal growth factor) gezielt blockierende Antikörpertherapie assoziiert. Gut etabliert ist auch die Analyse der HER2-Überexpression (Human Epidermal Growth Factor Receptor 2), sowie die MSI-H-Testung. In naher Zukunft wird eine deutlich erweiterte molekulare Untersuchung der Tumore möglich werden und hoffentlich noch bessere Behandlungschancen eröffnen.
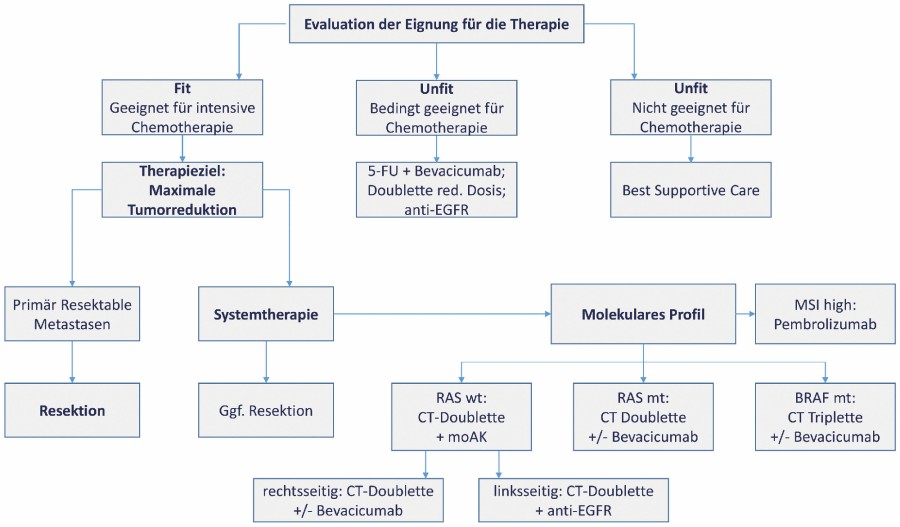
Die aktuelle S3-Leitlinie gibt klare Empfehlungen für die Erstlinientherapie, weitere Therapiesequenzen sind weniger exakt definiert. Die Basis für die Erstlinientherapie stellen die Regime FOLFOX (5-Fluoruracil, Folinsäure, Oxaliplatin) und FOLFIRI (5-Fluoruracil, Folinsäure, Irinotecan) dar. Dabei sollte die optimale Therapie für den Patienten immer in der ersten Therapielinie erfolgen. Bei der Wahl der Therapie müssen die Lage des Primärtumors, der Allgemeinzustand, der RAS-, BRAF- und MSI-Status berücksichtigt werden.
Bei ca. 50 % aller kolorektalen Karzinome findet sich eine Mutation in einem der RAS-Gene (KRAS, NRAS). Die gegen den EGFR-Rezeptor (epidermal growth factor receptor) gerichtete Therapie mit Cetuximab oder Panitumumab ist dann nicht mehr wirksam und soll daher in dieser Situation nicht mehr angewendet werden. Eine Mutation im BRAF-Gen kann bei ca. 8–10 % aller Karzinome nachgewiesen werden. Patienten mit BRAF-Mutation haben eine schlechte Prognose mit einem medianen Überleben von unter einem Jahr. Eine Mikrosatelliteninstabilität kann in ca. 5 % aller Fälle nachgewiesen werden. Bei MSI-high-Tumoren kann eine Therapie mit dem Checkpointinhibitor Pembrolizumab durchgeführt werden.
Bei RAS-Wildtyp und Lokalisation des Primärtumors im linken Hemikolon führt eine Chemotherapie mit einem EGFR-Antikörper zu einem deutlichen Überlebensvorteil, bei Lage im rechtsseitigen Kolon dagegen wird durch den Einsatz eines EGFR-Antikörpers bei RAS-Wildtyp das progressionsfreie und Gesamtüberleben nicht verbessert. Hier sollte der Antikörper gegen VEGF (Vascular Endothelial Growth Factor) Bevacicumab eingesetzt werden. Bei Nachweis einer RAS-Mutation sollte unabhängig von der Primärlokalisation Bevacicumab eingesetzt werden. [1, 15–19].
Bei Progress der Grunderkrankung wird die Erstlinientherapie in der Regel umgestellt (Second-Line-Therapie). Die Therapie wird von FOLFOX auf FOLFIRI oder von FOLFIRI auf FOLFOX gewechselt. Die Therapie mit Bevacicumab kann auch „Beyond Progression“ mit der neuen Kombination fortgesetzt werden. In der Second-Line-Therapie sind neben Bevacicumab weitere anti-VEGF Substanzen (Ramucirumab, Aflibercept) zugelassen, allerdings nur in Kombination mit FOLFIRI und nach Therapie mit FOLFOX. Eine Reinduktionstherapie der initial erfolgreichen Chemotherapie zum Beispiel nach Therapiepause ist ebenfalls möglich. Bei Nachweis einer BRAF-V600E-Mutation steht ebenfalls eine neue Therapie zur Verfügung. Hier kann die Kombinationstherapie mit dem BRAF-Inhibitor Encorafenib und dem EGFR-Antikörper Cetuximab zur Anwendung kommen.
Für eine „Third-Line-Therapie“ und spätere Therapielinien stehen verschiedene Wege zur Verfügung. TAS-102 ist ein Kombinationspräparat aus Trifluridin und Tipiracil sowie dem Tyrosin-Kinase-Inhibitor (TKI) Regorafenib, welcher in Deutschland nur über internationale Apotheken bezogen werden kann. Auch HER2 ist ein therapeutisches Ziel in der metastasierten Situation. Die Kombination aus Trastuzumab und Lapatinib ist bei therapierefraktären Patienten mit HER2-positivem metastasiertem kolorektalem Karzinom wirksam und gut verträglich, allerdings ist diese Therapie bisher noch nicht zugelassen [1, 15–19].
Patienten mit reduziertem Allgemeinzustand oder erheblichen Komorbiditäten können eine 5-Fluoruracil-Monotherapie oder eine Doublette in reduzierter Dosis erhalten, ggf. in Kombination mit einem Antikörper. Bei Nachweis von RAS-Wildtyp und linksseitiger Lage des Primarius kann außerdem eine Monotherapie mit einem EGFR-Antikörper erfolgen. Eignen sich die Patienten z. B. aufgrund ihres schlechten Allgemeinzustands nicht für eine Chemotherapie, wird „Best Supportive Care“ durchgeführt. Vgl. Abb. 1.
Abb. 1: Erstlinientherapie des metastasierten kolorektalen Karzinoms
„Potenziell kurative Situation“ – Oligometastasierung
Das Konzept der „Oligometastasierung“ definiert ein intermediäres Tumorstadium zwischen einer nur regionalen, das heißt auf den Primärtumor begrenzten Erkrankung und einer ausgedehnteren, onkologisch als Systemerkrankung aufgefassten Fernmetastasierung. Der Begriff beschreibt im Konzept einer sequenziellen Metastasierung letztlich nur die valide detektierte Limitation der Metastasierung auf wenige Organe (1–3) und die Limitation auf eine begrenzte Anzahl (1–5 Filiae). Lebermetastasen stehen beim KRK im primären Fokus dieses Konzeptes. In der Gruppe „Oligometastasierung“ werden Patienten konzeptionell zusammengefasst, die noch mit potenziell kurativer Zielsetzung und Restchance auf Heilung interdisziplinär therapiert werden können. Dies hat erhebliche Bedeutung auf die Therapieintensität und das Ausmaß der lokal-therapeutischen „Aggression“. Bei Oligometastasierung wird die Entfernbarkeit aller Tumoranteile als technisch möglich und onkologisch lohnend angesehen.
Wann ein metastasiertes KRK letztlich als palliativ, das heißt inkurabel einzuschätzen ist, hat sich in den vergangenen Jahren gewandelt. Die Einschätzung ist offensiver geworden. Primäre und sekundäre Resektabilität von Metastasen sind nicht grundsätzlich definierbar. Die Bewertung ist abhängig von der chirurgischen/radiologischen und damit auch der zentrumsabhängigen Expertise und Risikobereitschaft. Diverse Scores haben Eingang in die Resektabilitäts- und Prognoseeinschätzung gefunden. Hoffnung wird auf eine zukünftig bessere molekularbiologische Charakterisierung der Tumore gelegt. Auch die Verbesserung der radiologischen Feindiagnostik hat Auswirkungen auf die Qualität der therapeutischen Einordung. Unter Berücksichtigung dieser Indikationslinien liegen die fünf- und zehn-Jahres-Überlebensraten nach Resektion von Metastasen beim KRK bei 40 % bzw. 20 % [1, 20–24].
Lebermetastasen: Resektion oder Ablation
Die Entfernung von Metastasen kann durch eine umschriebene atypische Leberresektion oder eine anatomische Resektion bei Befall größerer Lebervolumina erfolgen, alternativ auch (an einer oder mehreren umschriebenen Regionen) radiologisch-interventionell, meist als Radiofrequenz-Ablation (RFA) oder Mikrowellen-Ablation (MWA) umgesetzt werden. Ablationsverfahren sind besonders interessant, wenn durch die Resektion ein unverhältnismäßig großer Verlust an gesundem Gewebe resultieren würde. Während in früheren Studien eher eine Unterlegenheit der Interventionen gegenüber den Resektionen in Bezug auf Langzeitüberleben und Lokalrezidivraten publiziert wurde, liegen inzwischen Daten vor, die zumindest bei Läsionen kleiner 3 cm eine vergleichbare Metastasendestruktion durch RFA/MWA nachweisen konnten. Ob die RFA/MWA im Hinblick auf das Gesamt- und krankheitsfreie Überleben der Resektion gleichwertig ist, wird weiterhin kontrovers diskutiert [1, 20–24, 25].
Neoadjuvante Systemtherapie bei Oligometastasierung
Die lokalen Verfahren können mit systemischer Chemo-, respektive Immuntherapie vor der Lokaltherapie (Pseudo-Adjuvant) und/oder später nach Ablation/Resektion (Adjuvant) begleitet werden. Neoadjuvante Therapie soll potenziell vorhandene Mikrometastasen abtöten und in kritischer anatomischer Lokalisation ein Downsizing nicht primär resektabler Läsionen bedingen (Konversions-Chemotherapie). Sie kann als Selektionskriterium bei Vorliegen von primär technisch resektablen Metastasen, jedoch biologisch ungünstig bewerteten individuellen Prognosekriterien eingesetzt werden (Responsebewertung).
Eine gute Response (Tumorregression) oder eine progressionsfreie Konstanz der Metastasen (Steady State – hinsichtlich Zahl und Größe) während einer von Chemotherapie begleiteten Beobachtungszeit unterstützen die Indikation für eine chirurgische Therapie (Test of Time-Konzept). Während die neoadjuvante Konversionschemotherapie im Konzept der Oligometastasierung unstrittig ist, wird der Stellenwert der Neoadjuvanz bei primär als resektabel eingeschätzten Filiae und günstigen Prognosekriterien kontrovers diskutiert.
Stand der Umsetzung potenziell kurativer Konzepte
In der aktuellen klinischen Versorgung in Deutschland gehen bekanntermaßen viele Patienten durch Unkenntnis oder nicht hinreichende Berücksichtigung dieser erweiterten interdisziplinären Behandlungsoptionen verloren, das heißt sie werden nur mit palliativer Perspektive behandelt. [2, 7]. Patienten mit Oligometastasierung bei KRK sollten deshalb in fokussierten Zentren mit hepatobiliärer chirurgisch/radiologischer Behandlungsexpertise vorgestellt werden. Alle drei Monate ist unter Systemtherapie eine Neubewertung vorzunehmen. Es liegen überzeugende Daten vor, wonach eine signifikante Prognoseverbesserung gegenüber alleiniger Systemtherapie erreicht werden kann, wenn lokaltherapeutische Maßnahmen in das Behandlungskonzept integriert werden. Etwa 30 % der Patienten können bei Oligometastasierung noch kuriert werden. Die therapeutischen Anstrengungen lohnen sich [1, 20–24].
Chirurgie in der palliativen Situation
Solange ein Primärtumor bei nicht resektabler Fernmetastasierung asymptomatisch ist (kein Ileus, keine Blutung), kann die Resektion des Primarius als Individual-entscheidung auch unterbleiben. Dass die Entfernung des Primarius („Muttertumor“) von weitergehender onkologischer Relevanz ist (onkologische Nische), stellt einen traditionellen Glauben dar. Die chirurgische Resektionsneigung ist im Sinne einer Komplikationsverhütung sicher gut gemeint, der effektive Nutzen aber nicht bewiesen. Prospektive Studien zur Thematik existieren, rekrutieren aber schlecht.
Pertitoneal-Karzinose – Chirurgische Optionen
Die peritoneale Zytoreduktion (CRS) mittels chirurgisch-peritonealem Debulking (Peritonektomie, Omentektomie und situativ angepasste Resektionen) und eine anschließende hypertherme intraperitoneale Perfusionschemotherapie (HIPEC) können bei geeigneten Patienten mit limitierten peritoneal begrenzten Metastasen das Gesamtüberleben beim KRK im Vergleich zur alleinigen systemischen Chemotherapie verlängern. Das Konzept wurde in die aktuelle S3-Leitlinie integriert. Zumeist kommen für die peritoneale Chemotherapie beim KRK Mitomycin C und Oxaliplatin zur Anwendung. Entscheidend für ein gutes Ergebnis ist die möglichst komplette peritoneale Zytoreduktion und eine frühe Initiierung der Peritonektomie. Es besteht eine lineare Regression zwischen der peritonealen Tumorlast und dem Gesamtüberleben [26].
Low anterior resection Syndrome – LARS
Segmentale Kolonresektionen werden funktionell unproblematisch vertragen. Der Erhalt des Schließmuskels ist verständlicherweise Wunsch aller Patienten bei distal lokalisiertem Rektumkarzinom. Die Rektumamputation (Exstirpation) wird, wo immer onkologisch vertretbar, vermieden und eine tiefe anteriore Rektumresektion mit Wiederherstellung der Darmkontinuität knapp suprasphinktär, ggf. sogar durch koloanale Anastomose durchgeführt.
Nach tiefen Rektumresektionen werden oft relevante Funktionseinschränkungen beobachtet. Gestört sind oft die differenzierten Kontinenzleistungen (Stuhlfrequenz, Vorwarnperiode, Vollständigkeit der Entleerung, Diskriminierungsvermögen). Die Problematik wird als „Low Anterior Resection Syndrome“ (LARS) zusammengefasst. Die Lebensqualität kann erheblich eingeschränkt sein. LARS ist meist multifaktoriell bedingt. Auch nach alleiniger Radiochemotherapie kann LARS in bis zu 30 % der Fälle auftreten. Wegen der Häufigkeit von LARS (in unterschiedlichen Ausprägungen) ist der Erhalt des Rektum-Kontinenzorgans, wo immer vertretbar, therapeutisch anzustreben. Es wird aktuell vermehrt nach onkologisch vertretbaren Alternativen zur Rektumresektion für geeignete Patienten gesucht („Watch-and-Wait“/Intensivierte Radiotherapie) [27].
Selektive „Watch and Wait- Konzepte“ beim tiefen Rektumkarzinom
Nach neoadjuvanter Standard-RCT (45 Gy) und einem Intervall von sechs bis acht Wochen wird bei 10–20 % der Patienten mit lokal fortgeschrittenem Rektum-CA (Stadium T3/4 /R-/ ) eine pathohistologische Komplettremission festgestellt. Diese Beobachtung führte zur Hypothese, dass bei selektionierten Patienten auf eine radikale Rektumresektion/Exstirpation zunächst verzichtet und damit ein LARS vermieden oder zumindest verzögert werden kann. Eine engmaschige Nachbeobachtung ist in diesem Szenario zwingend. Im Falle eines Lokalrezidivs ist eine rasche Rettungs-OP (Salvage-Rektum-Resektion) umzusetzen.
Die Datenlage zu solchen Watch-and Wait-Strategien (W&W) nach Erreichen einer kompletten Response ist ermutigend. Nach Standard-RCT wird ein Lokalrezidv in 20–30 % der Fälle innerhalb von zwei Jahren beschrieben. In 90 % dieser Fälle ist das während engmaschiger Verlaufskontrolle nachgewiesene Rezidiv noch durch ein ausschließlich intraluminales Wachstum charakterisiert, also auf die Darmwand begrenzt. Eine Salvage-OP war in Beobachtungskollektiven meist noch mit kurativer Zielsetzung möglich. Die beobachtete Häufigkeit von Fernmetastasen war bei therapieresponsiven Tumoren mit 5–8 % eher gering.
Chirurgische Ressentiments in Bezug auf W&W-Strategien sind nicht unbegründet. Sie basieren auf der Erfahrung, wonach klassische Lokalrezidive nach Rektumresektion und RCT typischerweise extramural lokalisiert sind und eher spät diagnostiziert werden. Sie werden prognostisch meist ungünstig bewertet. Lokalrezidive wurden stadienabhängig bislang bei bis zu 10 % der Patienten nach Rektumresektion/Exstirpation beobachtet. Diese Rezidive gehen erfahrungsgemäß meist mit erheblicher Morbidität und Mortalität einher. Prospektive Studien sind notwendig, um das Nutzen-Risiko-Verhältnis von W&W-Strategien zu beschreiben [11, 28–31].
Totale oder intensivierte neoadjuvante Therapie – TNT
Mit optimierter neoadjuvanter RCT wurden in jüngster Zeit beim lokal fortgeschrittenen Rektumkarzinom im Stadium T3–4 noch höhere Raten an Komplettremissionen erzielt. Diese Konzepte werden als „Intensivierte“ oder „Total Neoadjuvante Therapie“ (TNT) bezeichnet. Hierbei wird die Standard-RCT um eine zusätzliche präoperative (Induktions-Regime) oder postoperative (Konsolidierungs-Regime) Chemotherapie erweitert. Das Rektum soll so lange wie onkologisch vertretbar funktionell erhalten werden.
In der auf dem ASCO-Kongress 2020 vorgestellten PRODIGE-23 Studie erfolgte eine präoperative Chemotherapie (drei Monate/sechs Zyklen FOLFIRINOX) vor Standard-RCT. Gegenüber konventioneller RCT wurde hierdurch eine fast verdoppelte Rate an Komplettremissionen beschrieben (ca. 27 % vs. 12 %). Nach dreijähriger Beobachtung waren sowohl krankheitsfreies Überleben (75 % vs. 68 %) als auch metastasenfreies Überleben (78 % vs. 71 %) signifikant verbessert. In der RAPIDO-Studie erhielten Hochrisikopatienten mit Rektum-CA entweder eine präoperative Standard-RCT oder eine Kurzzeit-RT (5 x5 Gy), gefolgt von einer präoperativen Chemotherapie über fünf Monate. In der intensivierten Therapiegruppe erreichten 28 %, in der Kontrollgruppe 14 % eine Vollremission. Die TNT führte nach drei Jahren zu einem verbesserten tumorfreien Überleben (23 % vs. 30 %) [11, 28–31].
Die OPRA-Studie verglich randomisiert als Phase II-Studie zwei TNT-Sequenzen miteinander (Chemotherapie vor 5FU basierter Strahlenchemotherapie vs. Strahlenchemotherapie gefolgt von Konsolidierungschemotherapie) und verglich zudem diese Gruppen mit einer historischen Kontrolle (Konventionelle neoadjuvante RCT plus OP plus adjuvante Chemotherapie). Beide Sequenzen waren im Hinblick auf den drei-Jahres-Rektumerhalt gegenüber der historischen Kontrolle überlegen (59 % vs. 43 %) Die Konsolidierungstherapie erzielte einen Vorteil hinsichtlich des drei-Jahres-Rektum-Erhalts (Sekundärer Endpunkt „TME-freies drei-Jahres-Überleben“; 59 % vs. 43 %).
Der beste Zeitpunkt zur Beurteilung des klinischen Ansprechens nach TNT (W&W vs. OP bei Resttumornachweis) ist unklar. Nach ersten Studien erscheint ein Zeitkorridor von sechs Monaten bis zur Bewertung des Therapieansprechens hinreichend. Es könnte sein, dass eine optimale Tumorregression individuell jedoch erst deutlich später erreicht wird. Aktuelle Studien sollen klären, ob bei sehr guter, jedoch unvollständiger Response (Near-Response) ein weiteres Zuwarten zu vertreten ist [11, 28–31].
Heute erreichte Therapie- Ergebnisse und Ausblick
Das Outcome der Patienten mit KRK hat sich in den vergangenen Jahren deutlich verbessert. Dies ist auf viele simultan oder komplementär wirksame Faktoren zurückzuführen. Hierzu zählen die optimierte Diagnostik, verbesserte OP-Techniken, ein erhöhter Anteil an Metastasen-resektionen bzw. Ablationen bei Oligo-Metastasierung, verbesserte Immun- und Chemotherapie beim metastasierten KRK („Präzisionsonkologie“) sowie innovative und intensivierte Formen der Radiotherapie.
An der zentralen Bedeutung der resezierenden Chirurgie bei der auf Kuration zielenden Primärtherapie hat sich bislang nur wenig geändert. Der Chirurg ist für die Primärtherapie des KRK ein sehr bedeutsamer Qualitäts- bzw. Prognosefaktor. Die chirurgische Arbeit kann onkologisch erkennbar „gut“ oder auch „weniger gut“ gemacht werden. Aktuelle Zertifizierungssysteme erfassen in diesem Sinne die personalisierte Erfahrung der verantwortlichen Chirurgen, z. B. durch Ermittlung der individuell geleisteten Mindest-OP-Mengen und einer Komplikationsdokumentation. Die operativen Fächer stehen ganz hervorgehoben im Fokus der aktuellen Qualitätssicherung.
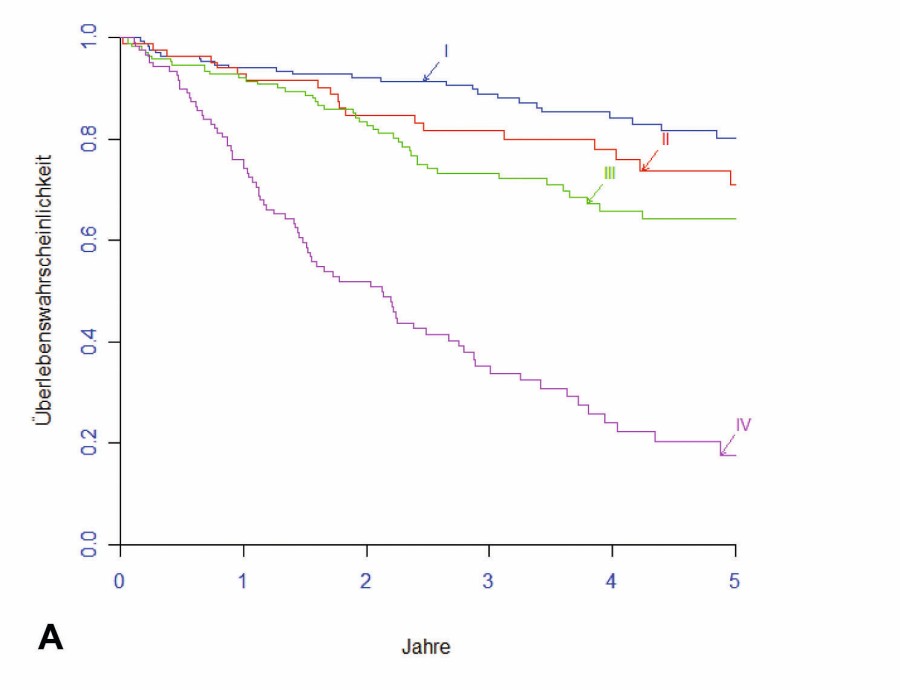
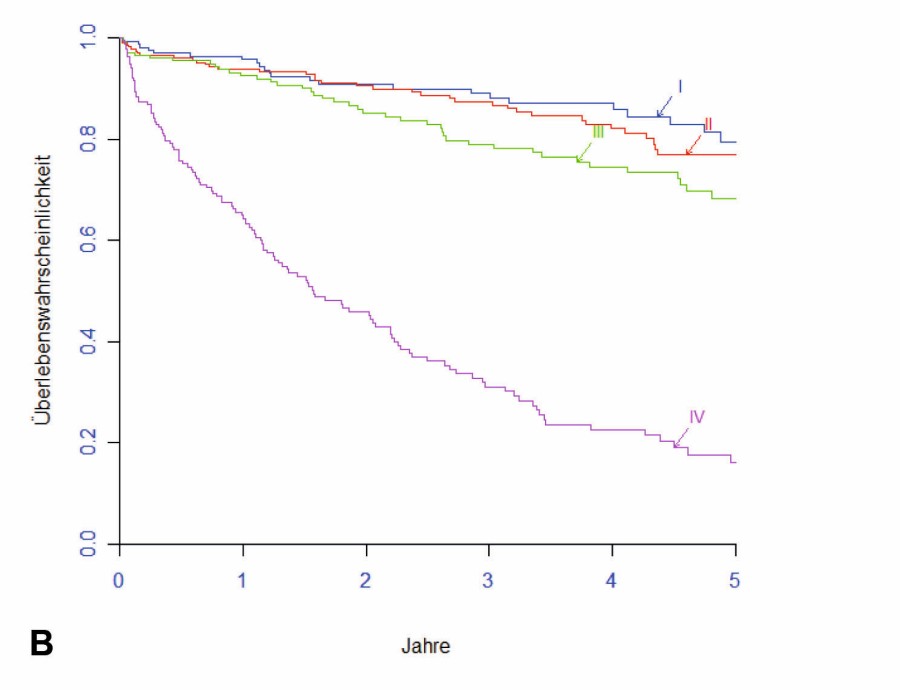
Der oft gleichzeitige Methodeneinsatz erschwert die Bewertung der durch die einzelnen, simultan oder sequenziell angesetzten Therapiemodalitäten erzielten Ergebnisverbesserungen. Besonders bei der Therapie des Rektumkarzinoms kommt es durch den risikoadaptierten Einsatz der verfügbaren Modalitäten zudem zu einer immer stärkeren Individualisierung. In der Summe ist heute ein höchst komplexes Management beim KRK zu konstatieren. Patienten mit KRK profitieren deshalb von der Behandlung in spezialisierten Zentren, also in einem interdisziplinär eng und kommunikativ zusammenwirkenden Expertenumfeld. Immerhin können über 60 % der Erkrankten heute geheilt werden. Vgl. dazu Abb. 2A und 2B.
Abb. 2A (Kolonkarzinom) und 2B (Rektumkarzinom): TNM-stadienabhängiges fünf-Jahres-Langzeit-Überleben (nach Kaplan-Meier) von 1.380 operativ mit kurativer Intention behandelten Primär-Patienten mit KRK am Darmzentrum Krankenhaus Nordwest (2007––2020; n=1.380).
Prof. Dr. med. Thomas W. Kraus, Ärztlicher Direktor der Klinik für Allgemein-, Viszeral- und Minimal Invasive Chirurgie am Krankenhaus Nordwest, Leiter des Darmzentrums, E-Mail: kraus.thomas@khnw.de
Dr. med. Stefan Berkhoff, Dr. med. Kerstin Grimm, Dr. med. Peter Heinz, Dr. med. Moustafa Elshafei, alle Klinik für Allgemein-, Viszeral-und Minimal Invasive Chirurgie
PD Dr. med. Uta Kraus-Tiefenbacher, Klinik für Radioonkologie
Dr. med. Thomas Huckle, Prof. Dr. med. Elke Jäger, beide: Klinik für Onkologie und Hämatologie
Dr. med. Bettina Heise, Ärztliche Koordinatorin des Darmzentrums
Interdisziplinäres Darmzentrum Krankenhaus Nordwest GmbH/Stiftung Hospital zum Heiligen Geist, Standort: Frankfurt/M.
Klinik für Allgemein-, Viszeral- und Minimal Invasive Chirurgie, Krankenhaus Nordwest, Steinbacher Hohl 2–21, Frankfurt/M.
Die Literaturhinweise finden Sie am Ende dieser Seite unter „Artikel herunterladen“ in der PDF-Version dieses Artikels.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Therapie des kolorektalen Karzinoms – Behandlungskonzepte und aktuelle Entwicklungen“ von Prof. Dr. med. Thomas W. Kraus et al. finden Sie im Mitglieder-Portal (https://portal.laekh.de) sowie im PDF am Ende dieser Seite unter „Artikel herunterladen“. Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Mitglieder-Portal vom 25. Oktober 2021 bis 24. April 2022 möglich. Die Fortbildung ist mit zwei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Dieser Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte.
Das Darmzentrum am Krankenhaus Nordwest
Das interdisziplinäre Darmzentrum am Krankenhaus Frankfurt-Nordwest (KHNW) unter Leitung von Prof. Dr. med. Thomas W. Kraus wurde im Jahr 2009 erstmals zertifiziert (Onkozert). Seit der Erstzertifizierung wurden über 1.300 Patienten mit KRK primär mit kurativer Intention behandelt. Dem klinischen Programm ist ein interdisziplinäres klinisches Studienzentrum zur Seite gestellt (IKF – Leitung Prof. Dr. med. Salah-Eddin Al-Batran). Das Darmzentrum ist Teil des interdisziplinären onkologischen Zentrums am KHNW (Leitung Prof. Dr. med. Eckhart Weidmann) und Teil des universitären Tumorzentrums der Universität Frankfurt (UCT).