Prof. Dr. med. Dr. med. h.c. mult. Hans-Rudolf Tinneberg, Prof. Dr. med. Dr. phil. Dr. med. h.c. mult. Andreas D. Ebert, Prof. Dr. med. Dr. med h.c. Karl-Werner Schweppe
Ein Abkürzungsverzeichnis finden Sie hier.
Zur Geschichte der Endometriose
Die Endometriose ist eine multifaktorielle, hormonabhängige, chronische Erkrankung der Frauen in ihrer reproduktiven Lebensphase, die durch das Vorkommen und das Wachstum von endometriumähnlichem Gewebe außerhalb der Gebärmutterhöhle charakterisiert wird [1–5]. Die Krankheit Endometriose (bzw. Adenomyosis genitalis interna, genitalis externa und extragenitalis) ist in erster Linie durch die Symptome Dysmenorrhoe, Dyspareunie, Dysurie, Dyschezie und ungewollte Kinderlosigkeit sowie durch einen perimenstruellen Blähbauch, perimenstruelle Diarrhoe oder Obstipation sowie perimenstruelle Rückenschmerzen charakterisiert [4, 5]. Man kann davon ausgehen, dass diese Symptome seit der Antike bekannt sind, ohne dass die eigentliche Erkrankung einen Namen erhielt [6].
Eine der ältesten bekannten morphologischen Beschreibung geht auf die Jenenser Doktorarbeit von Daniel Shroen (1690) zurück [7]. Danach folgten verschiedene Fallbeschreibungen [6]. 1860 beschrieb Carl Freiherr von Rokitansky (1804–1878, Abb. 1) die extraovarielle Endometriose aufgrund des kombinierten Auftretens von Endometriumgewebe und glatter Muskulatur als Adenomyoma [8].
Inspiriert von den Beobachtungen des Straßburger Gynäkologen Wilhelm Alexander Freund (1833–1917), lieferte Friedrich von Recklinghausen ab 1893 verschiedene Arbeiten über Adenomyome [6, 9]. Thomas Cullen (1868–1953) beschrieb 1896 eine Adenomyose des Ligamentum rotundum [10] und Johannes Pfannenstiel (1862–1909) 1897 die rektovaginale Endometriosis [6]. Eine Beschreibung der ovariellen Endometriosezyste stammte von Johann Crell aus Wittenberg aus dem Jahre 1793 [11]. Meyer belegte die Narbenendometriose (1903) sowie den Sigma- und Lymphknotenbefall (1909) [6]. Der theoretische Hintergrund der sich häufenden Einzelbeobachtungen blieb unklar. Die Annahme, dass es sich bei diesen Geweben um Reste der Wolff’schen oder der Müller’schen Gänge handelte, wurde lange kontrovers diskutiert. Iwanoff (1898) entwickelte ursprünglich die coelomische oder Serosa-Metaplasie-Theorie [6, 12], deren Hauptvertreter Meyer (1919, 1924) und später Novak (1926) wurden [5, 6, 13–15]. Einen weiteren Meilenstein lieferte Sampson (1921), der die retrograde Menstruation, die Struktur von Schokoladenzysten und die potenzielle Invasivität von Endometriosegewebe („misplaced epithelium of endometrial type“) akribisch darlegte [16, 17]. Hieraus entwickelte sich die Implantations-Theorie bzw. die Theorie der retrograden Menstruation.
Wegweisend waren weiterhin die Arbeiten von Philipp und Huber [5, 6]. Der aus dem Angelsächsischen kommende Begriff Endometriose bürgerte sich offensichtlich erst ab 1932 in der deutschen Fachliteratur ein [18]. Doch erst im 20. Jahrhundert wurde nach der Etablierung des Fachgebietes Pathologische Anatomie und der Einführung der Mikroskopie die Erkrankung wissenschaftlich genauer mit den Methoden der Zeit untersucht (Tab. 1). Seit dem Beginn des 20. Jahrhunderts führten die Fortschritte in der offenen Chirurgie und mikroskopischen Pathologie, später auch gynäkologischen Endokrinologie, der Laparoskopie, der Molekularpathologie sowie der Bildgebung (Ultraschall und MRT) zu einem besseren Verständnis der Pathophysiologie der Endometriose (siehe Tab. 1).
| Tabelle 1: Historische Meilensteine [6, 15, 18, 29, 30] | |
| Jahr | Ereignis |
| 1690 | Eine der ersten morphologischen Beschreibungen einer Endometriose stammt von Daniel Shroen aus Jena, der sie damals in seiner Doktorarbeit festhielt |
| 1739 | Erste makroskopische Beschreibung eines ovariellen Endometrioms durch Johann Crell in Wittenberg |
| 1860/61 | Beschreibung extraovarieller Endometriose als Adenomyoma durch Karl Freiherr von Rokitansky in Wien – Einführung der Mikroskopie |
| 1896 | Friedrich von Recklinghausen und Thomas Cullen beschreiben unabhängig Adenomyome und die Adenomyosis tubae |
| 1899 | Beschreibung der rektovaginalen Endometriose durch Johannes Pfannenstiel |
| 1912 | Oskar Frankl führt den Begriff „Adenomyosis“ ein. |
| 1921 | Entwicklung der Transplantationstheorie durch John A. Sampson |
| 1932 | Morphologische Charkterisierung (R. Meyer). Meyer spricht klar von Adenomyohyperplasia interna uteri (heute Adenomyosis uteri); zuvor Postulierung der Östrogenabhängigkeit durch Lauches |
| 1925–1932 | Endometriose als Bezeichnung der Erkrankung setzt sich durch. Besonders Seitz und Philipp befürworten den Begriff „Endometriose“ |
| 1937–1939 | Theorie von Philipp und Huber: Tiefenwucherung ist die Ursache für die Endometriosis interna (primäre Endometriose) und die Aussaat von Polypen der uterinen Schleimhaut im Tubenanfang ist die Genese für die Entstehung der sekundären Endometriose (Endometriosis externa) |
| 1950er-Jahre bis dato | Biochemische und endokrine Konzepte und Konzept der „Pseudoschwangerschaft“ |
| 1970er-Jahre bis dato | Entwicklung verschiedener immunologischer und molekularbiologischer Konzepte sowie Einführung der Laparoskopie |
| 1990er-Jahre bis dato | Tissue-Injury-And-Repair-Konzept (Gerhardt Leyendecker) |
| Ab 2000 bis dato | Tissue Arrays, Gene Expression Arrays, Entwicklung von Genomics, Proteonomics, mRNA-Studien. |
- Carl von Rokitansky (1860): Der österreichische Pathologe Rokitansky (Abb. 1) gilt als einer der ersten, der Endometriose als eigenständige Krankheit identifizierte. Er publizierte seine Beobachtungen über endometriumähnliches Gewebe außerhalb der Gebärmutter [19].
- Friedrich von Recklinghausen und Wilhelm Alexander Freund (1896) sowie Thomas Cullen (1896): Der Pathologe von Recklinghausen und die Gynäkologen Freund und Cullen trugen wesentlich zur klinischen Beschreibung der Endometriose und der Adenomyosis bei. [9, 10].
- Etwas später wurden von John A. Sampson (1873–1946) und Robert Meyer (1864–1947) zwei Theorien entwickelt, die jahrzehntelang bis in die Neuzeit die wissenschaftlichen Diskurs dominierten: Theorie der retrograden Menstruation (1927): John A. Sampson postulierte, dass Endometriumzellen durch den Rückfluss von Menstruationsblut in die Bauchhöhle gelangen und sich dort implantieren können. Diese Theorie legte den Grundstein für viele spätere Forschungsarbeiten zur Endometriose. [16, 17]. Metaplasie-Theorie (1932): Diese Theorie besagt, dass Peritonealzellen die Fähigkeit besitzen, sich unter dem Einfluss verschiedener Faktoren (z. B. Hormone, Entzündung) in heterotopes Gewebe umzuwandeln [6, 12, 13–15].
Ätiologie und Pathophysiologie
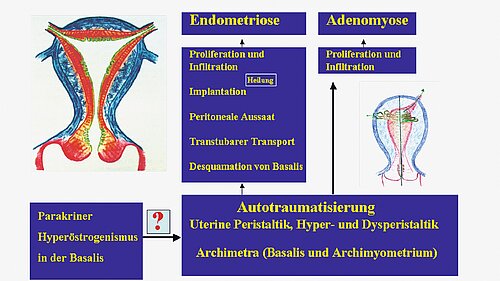
In jüngerer Zeit hat das Tissue Injury and Repair (TIAR) Model der Arbeitsgruppe um Gerhardt Leyendecker an Bedeutung gewonnen [20–25]. Das wissenschaftlich kontrovers diskutierte TIAR-Modell [25–27] basiert auf der Hypothese, dass repetitive Gewebeverletzungen zwischen den embryonalen Uterusbestandteilen Archimetra und Neometra, gefolgt von p450-Aromatase-gesteuerten Reparaturprozessen, eine zentrale Rolle bei der Entwicklung von Endometriose spielen [20–25] (Abb. 2).
Der Zyklus aus Verletzung und Reparatur führt über die Induktion p450-Aromatase, der COX-2- (Cyclooxygenase-2) und anderer Signaltransduktionswege im Rahmen eines Circulus vitiosus zu chronischer nichtbakterieller Inflammation, sukzessiven fibrotischen Veränderungen und einer weiteren fehlerhaften Gewebereparatur, die das invasive Wuchern der tiefsten Schicht des basalen Endometriums in die Uteruswand und die extrauterine Invasion sowie Wachstum von ektopen Endometriumzellen, z. B. auf dem Peritonneum oder den Ovarien, begünstigen. Die wichtigsten Schritte des TIAR-Modells umfassen:
- Gewebeverletzung: Mikro- oder Makrotraumata können durch einen basalen Hyperöstogenismus, ärztliche Eingriffe, aber auch Geburten oder molekulare Stressoren verursacht werden.
- Östrogener circulus vitiosus: Mikrotraumata oder mechanische Traumata des Endometrium führen zu Reparaturprozessen, die die Expression der p450-Aromatase verstärken. So kommt es zu einem Anstieg des Östradiol-17ß im Gewebe (basaler Hyperöstrogenismus), was zu einer Hyperperistalsis uteri führt, die die Mikrotraumatisierung verstärken kann. Die Hyperperistaltik führt a) primär zu Invasion der basalen Endometriumschichten über die stromalen Komponenten in das Myometrium, und b) zu einer Abschilferung von basalem Endometrium mit Stammzellen, die transtubar in das kleine Becken gelangen und dort implantieren, invadieren und proliferieren. Basale Endometriumstammzellen spielen eine essenzielle Rolle bei der Regeneration des Endometriums und können auch extrauterin aktiviert werden. Begleitet werden diese Prozesse von der östrogenbedingten Induktion der Cyclooxygenase-2, welche die Prostaglandinsynthese aktiviert. Prostaglandine sind Schmerzstoffe, die aber auch Zelleigenschaften, wie Migration und Invasion verstärken und zur Induktion der p450-Aromatase führen, was einen Circulus vitiosus bewirkt.
- Freisetzung von Faktoren der inflammatorischen Signaltransduktion: Flankierend setzt das verletzte Gewebe verschiedenste entzündungsfördernde Zytokine, Chemokine und Wachstumsfaktoren wie den Transforming Growth Factor-β (TGF-β) frei, die Immunzellen und Fibroblasten anziehen und in ihrer Funktion modifizieren.
- Immunantwort: Makrophagen, Neutrophile und andere Immunzellen werden aktiviert, um das verletzte Gewebe zu „reparieren“. Dabei kommt es u. a. zur Freisetzung von Matrix-Metalloproteinasen (MMP) und anderen Enzymen, welche die Gewebestruktur modulieren können.
- Fibrose, Neoangiogenese, Neolymphangiogenese, Neoneurogenese: Die angelaufenen Reparaturprozesse führen letztlich zur Bildung von fibrösem Gewebe, aber teilweise auch zu neuen Blut- und Lymphgefäßen und unreifen Nervenfasern, die das ektope Endometrium versorgen. Nerve Growth Factor (NGF) u. a. neuroactive Moleküle finden sich regelmäßig in frischen Endometrioseläsionen.
- Lokale Hypoxie, die durch Gefäßuntergänge, mangelhafte Gefäßbildung und Blutungen aus ektopen Herden verursacht wird, trägt zur Freisetzung von proangiogenen und proinflammatorischen Mediatoren wie VEGF (vascular endothelial growth factor), HiF-1 (Hypoxie-induzierter Faktor 1) und IL-6 (Interleukin 6) u. a. Mediatoren bei, die den Reparaturzyklus aufrechterhalten, stimulieren oder inhibieren.
- Zahlreiche zusätzliche Signaltransduktionswege spielen eine Rolle, die durchweg als Sekundärprozesse diskutiert werden können.
Relevanz des TIAR-Modells für die klinische Praxis
Das TIAR-Modell lässt einige wichtige Aussagen zur Therapie der Endometriose zu, da sowohl die p450-Aromatase, die COX-2 und die Prostaglandine, aber auch die Fibrosebildung aktuelle und potenzielle Ansatzpunkte für neue Behandlungsstrategien sind [3, 4, 28]. Beispiele sind:
- Hemmung der p450-Aromatase durch bekannte Aromataseinhibitoren
- Entzündungshemmende Medikamente: Selektive Hemmung von COX, der Prostaglandinsynthese sowie von Zytokinen wie TNF-α (Tumor Nekrose Faktor-α) oder IL-6.
- Anti-fibrotische Therapien: Substanzen, die die Aktivierung von Fibroblasten oder die Kollagenbildung reduzieren.
- Angiogenese-Inhibitoren: Hemmung von VEGF zur Reduktion der Blutversorgung der Endometrioseherde.
Während einige dieser Therapieansätze bereits sehr erfolgreich Eingang in die Therapie gynäkologisch-onkologischer Erkrankungen gefunden hat, stehen sie in der Behandlung der gutartigen Erkrankung Endometriose auch vor dem Hintergrund des aktuellen oder perspektivischen Kinderwunsches der betroffenen Frauen sowie der gegebenen Nebenwirkungen noch in den Anfängen klinischer Studien.
Diagnostik
Anamnese
Bei jeder Patientin, die sich mit regelabhängigen Schmerzen vorstellt, sollte dringend an das Vorliegen einer Endometriose gedacht werden. Es muss gezielt gefragt werden nach: Dysmenorrhoe (schmerzhafte Regelblutung), Dysurie (Schmerzen beim Wasserlassen), Dyspareunie (Schmerzen beim Geschlechtsverkehr) und Dyschezie (Schmerzen beim Stuhlgang). Bei der Dysmenorrhoe berichten die Frauen oftmals, dass der Schmerz bereits vor Beginn der Blutung einsetzt, was als Hinweis auf eine retrograde Menstruation angesehen werden kann. Hinsichtlich der Dysurie sollten auch perimenstruelle cystitische Beschwerden differenzialdiagnostisch unbedingt dem Krankheitsbild der Endometriose zugeordnet werden. Dies trifft auch auf regelabhängige (katameniale) Kopfschmerzen, Schmerzen beim Atmen, mit Ausstrahlung in Rücken und Beine zu.
Untersuchung
Körperliche Untersuchung
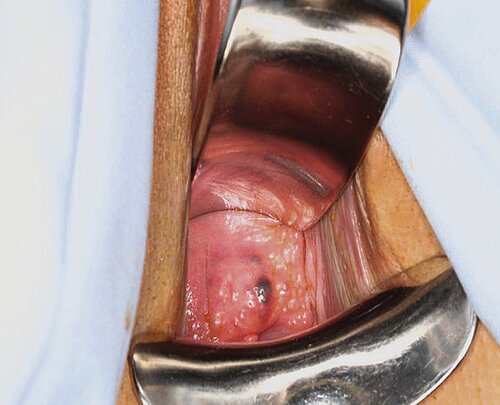
Im Vordergrund steht die Inspektion und rekto-vaginale Palpation: die Spekulumeinstellung (mit geteiltem Spekulum) lässt das Vorliegen einer vaginalen Infiltration, ggf. mit Beteiligung des Spatium rekto-vaginale oder des Rektums, beurteilen (Abb. 3). Bei der rektovaginalen Palpation können Schmerzen des Uterus und der Adnexe (auch im Sinne eines „pain mapping“), ein retrovertierter fixierter Uterus, knotige Strukturen im Douglas und/oder der Ligg. sacro-uterina sowie oft auch knotige Darminfiltrationen festgestellt werden.
Bildgebung
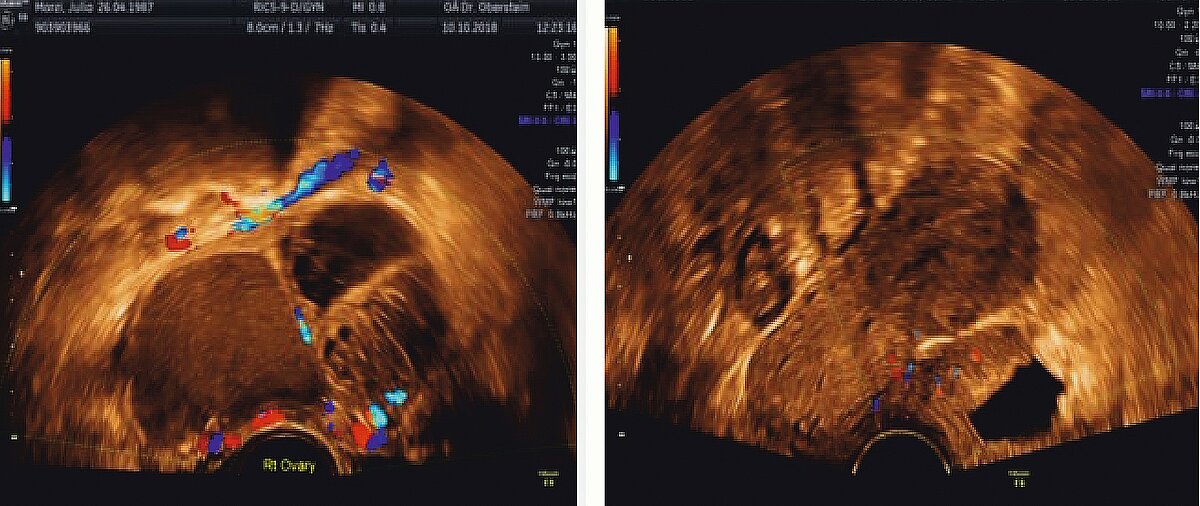
Die heute wohl wichtigste diagnostische Methode neben der akribischen Anamneseerhebung und der sachgerechten gynäkologischen Untersuchung ist die Transvaginalsonographie (TVS). Durch die systematische Befunddarstellung, wie in den IDEA- und MUSA-Konsensuspapieren [31, 32] aufgeführt, sollte es bei etwas Training in Klinik und Praxis möglich sein, insbesondere bei tief-infiltrierender Endometriose, eine zutreffende Diagnose zu stellen. Hierzu kann man heute sogar die Darstellung der sacralen Nervenwurzeln zählen. Beispiele für das ovarielle Endometriom sowie die Blasenendometriose sind in (Abb. 4) gegeben.
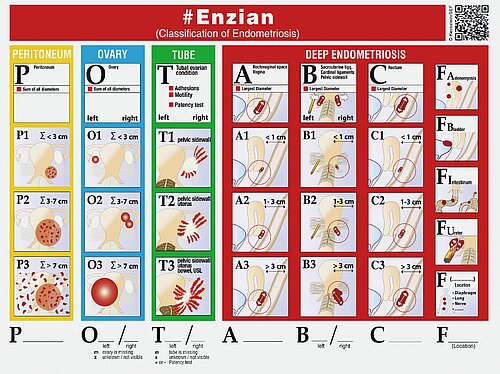
Bei Verdacht auf eine pelvine Endometriose sollte auch eine beidseitige Nierensonographie vorgenommen werden, da durch eine extrinsische oder intrinsische Ureterendometriose relativ häufig eine meist symptomarme Hydronephrose entstehen kann, die im schlimmsten Fall zu einer stummen Niere führt. Dieses Vorgehen ermöglicht bereits präoperativ eine Klassifizierung der Endometriose nach dem #Enzian-Schema (Abb. 5) [33], welches ein gutes Instrument für die einheitliche Beschreibung der Endometriose darstellt und außerdem abschätzen hilft, wie ausgedehnt eine operative Therapie sein könnte und mit welchen Komplikationen gerechnet werden sollte.
Bei der TVS kann durch das Einführen des Schallkopfes wiederum ein „pain mapping“ sowie bei gleichzeitiger abdominaler Palpation das Ausmaß von Verwachsungen und das damit oft verbundene Vorliegen eines „frozen pelvis“ ermittelt werden.
Kernspintomographie (MRT)
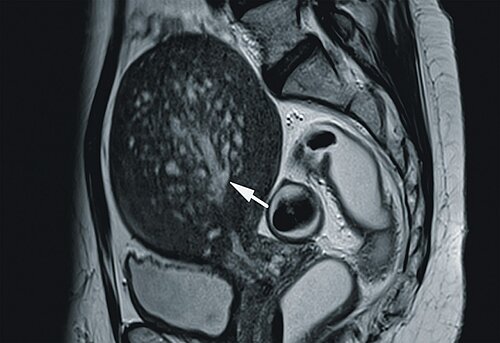
Bei komplexen Fragestellungen bzw. zum Ausschluss anderer Erkrankungen mit vergleichbarer Symptomatik stellt die MRT mit und ohne Distension von Vagina und Rektum ein weiteres zuverlässiges Instrument der Bildgebung dar, das Erfahrungen des Gynäkologen und des Radiologen voraussetzt [34], (Abb. 6).
Laboranalytik
Bedauerlicherweise verfügt keiner der üblichen Laborparameter über eine ausreichende Spezifität, um als Nachweismethode für Endometriose geeignet zu sein. Selbst CA12.5, welches auch jetzt noch oftmals als Marker für Endometriose angesehen wird, kann maximal zur Überwachung und Beurteilung eines Rezidivs eingesetzt werden, erlaubt jedoch keine Diskriminierung gegenüber anderen Erkrankungen. Seit kurzem wurde ein Test auf den Markt gebracht, der auf der Basis von miRNA aus dem Speichel bei Verdacht auf Endometriose mit hoher Trefferquote eingesetzt werden kann [35]. Dieser Speicheltest ist allerdings nicht als Screening-Methode einsetzbar und wäre dafür sicher auch zu kostenintensiv.
Medikamentöse Endometriose- behandlung
Die etablierten medikamentösen Behandlungen der Endometriose beruhen grundsätzlich auf zwei Prinzipien:
- Suppression der ovariellen Östrogenproduktion und/oder
- Reduktion der reaktiven Begleitentzündung.
Angewendet werden erstens Steroidhormone, die in den negativen Feedback des Regelkreises Hypothalamus-Hypophyse-Ovar eingreifen, wobei sie selbst oder ihre Metabolite möglichst keine östrogenen Eigenschaften entwickeln. Zweitens direkt auf hypophysärer Ebene die Gonadotropinfreisetzung blockierende Stoffe wie die GnRH-Analoga. Drittens lassen sich endometriosebedingte Schmerzen, die vor allem durch abakterielle Entzündungsmechanismen verursacht werden, durch nichtsteroidale Antirheumatika (NSAR) beeinflussen. Ob durch sie auch die Endometrioseherde selbst beeinflusst werden, ist Gegenstand aktueller Forschung.
Bei der Therapiestrategie ist zu beachten, dass die Endometriose eine chronisch rezidivierende und systemische Erkrankung ist. Deshalb schützen weder medikamentöse noch operative Therapien vor Rezidiven (Abb. 8). Wiederholte, intermittierende oder auch langdauernde medikamentöse Therapien sind in verschiedenen Lebensphasen der betroffenen Frauen oft notwendig, weshalb es nicht nur auf die Wirksamkeit einer Substanz hinsichtlich der Endometrioseregression ankommt, sondern Schmerzbeseitigung, Verträglichkeit und individuelle Nebenwirkungen für die Praxis relevante Entscheidungskriterien sind.
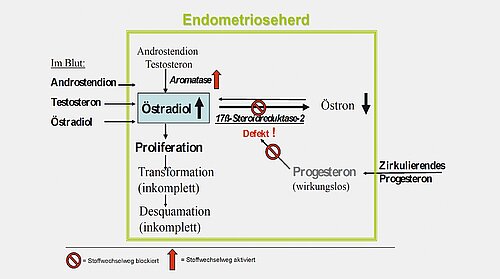
Gestagenbehandlung:
Niedrig dosierte Gestagene – allein oder in Kombination mit niedrig dosierten Östrogenen (orale Kontrazeptiva vom Kombinationstyp) – werden in der klinischen Routine seit Jahrzehnten angewendet. Gestagene sind auch heute Mittel der ersten Wahl bei endometrioseassoziierten Symptomen [37]. Sie wirken antientzündlich, wie in vitro und in vivo Studien zeigen; aber direkt an den Endometriosezellen scheint ein so genannter Progesteronblock [36] vorzuliegen – wie in Abb. 7 schematisch dargestellt.
Die Wahl der Substanz hängt von der subjektiven Verträglichkeit ab, die Dosierung richtet sich nach der biologischen Wirksamkeit am Endometrium, wobei die Applikationsform keinen Einfluss auf die Wirksamkeit zu haben scheint. Da eine kontinuierliche Gestagengabe zu niedrigen Östrogenspiegeln führt, resultieren häufig Schmier- und Zwischenblutungen, die durch Dosisänderung, Therapiepause, Östrogenzugabe (cave Thromboserisiko) oder auch Vorbehandlung mit GnRH- Agonisten [44] reduzierbar sind. Sicher ist, dass die endometrioseabhängigen Symptome in bis zu dreiviertel der Fälle unterdrückt werden können, wobei aber die Rezidivrate nach Absetzen der Medikation hoch ist.
Da in Deutschland nahezu alle für Endometriosebehandlung angewendeten Gestagene vom Markt genommen wurden und der Einsatz von Östrogen-Gestagen-Kombinationen (OK = orale Kontrazeptiva) eine zwar leitlinienkonforme, aber „off label“ Verordnung ist, spielt bei uns Dienogest in der Dosierung von 2 mg/d eine zentrale Rolle. Bei Kinderwunschpatientinnen mit endometriosebedingter Schmerzsymptomatik bietet sich Dydrogesteron 10 mg–205mg von Zyklustag 5–25 an [51], da es die Ovulation nicht hemmt, die Transformation des Endometriums nicht beeinflusst und in Deutschland zur Behandlung von Zyklusunregelmäßigkeiten, die oft bei Endometriosepatientinnen auftreten, zugelassen ist.
Weitere, in der Praxis häufig verwendete Gestagene sind Drospirenon und Desogestrel. Seltener findet noch Medroxyprogesteronacetat (MPA) Anwendung. Die intravaginale kontinuierliche Gestagenapplikation oder die kontinuierliche Gabe des Gestagens über zwei Jahre als subkutanes Implantat sind theoretisch ebenfalls zur symptomatischen Therapie geeignet und auch erfolgreich angewendet worden. Systematische prospektive Untersuchungen fehlen jedoch.
Ferner ist die lokale Applikation von Gestagenen durch das intrauterine System, welches täglich 20 µg Levonorgestrel freisetzt, möglich [57] und eignet sich besonders bei Adenomyosis oder bei rektovaginaler Endometriose durch Verminderung von Dysmenorrhoe und Dyspareunie. Vorteilhaft ist die fünfjährige Liegedauer, wobei jedoch die Wirksamkeit auf die Endometriosebeschwerden nach 12–18 Monaten nachzulassen scheint; nachteilig sind die Schmier- und Zwischenblutungen in den ersten sechs Monaten, bis die Wirksamkeit sich voll entfaltet hat. Für Deutschland gilt der Hinweis, dass all diese Applikationsformen „off label“ Anwendungen sind und nicht zu Lasten der Krankenkassen zur Endometriosetherapie verordnet werden können.
GnRH-Analoga Behandlung
Unter GnRH-Analoga verstehen wir Agonisten und Antagonisten des natürlichen LH-RH. Sie wirken direkt auf das Hypophysen-Hypothalamus-System. In der Endometriosebehandlung waren die Agonisten trotz ihres anfänglichen, unerwünschten Stimulationseffektes (sog. Flare-up) Standard. Sie unterscheiden sich in der Wirksamkeit auf die Symptome einer Endometriose nicht von den Gestagenen, wohl aber im Nebenwirkungsspektrum. Depotpräparate sind wegen besserer Compliance und sicherer Suppression im praktischen Alltag sinnvoll. Um die relevanten hypoöstrogenen Nebenwirkungen zu reduzieren ohne den Therapieeffekt zu minimieren, wurde vor vielen Jahren eine so genannte „add-back“-Therapie [61] mit niedrig dosierten Östrogenen oder Gestagenen eingeführt, die heutzutage Standard sein sollte.
Die GnRH-Antagonisten führen zu einer sofortigen Blockade der Rezeptoren und haben keinen Flare-up-Effekt am Therapiebeginn. Orales Elagolix wurde in den USA in der Behandlung von Patientinnen mit mäßiger bis schwerer endometrioseassoziierter Symptomatik zugelassen [56]. Linzagolix 75 mg verbessert ebenfalls Dysmenorrhoe und chronische Unterbauchschmerzen signifikant.
Wirksamkeit und Nebenwirkungen des Antagonisten Relugolix (40 mg) sind im Vergleich zum etablierten GnRH-Agonisten Leuprorelin gleich. Deshalb wurde in zwei Studien die Wirksamkeit von 40 mg Relugolix in Kombination mit einer Add-Back-Therapie (1 mg Estradiol und 0,5 mg Norethisteronacetat) geprüft [41]. Im Vergleich zu Placebo zeigten beide Relugolix-Gruppen eine signifikante Besserung der Dysmenorrhö und der Unterbauchschmerzen. Der Verlust der Knochendichte war größer unter der Relugolix-Monotherapie, unter Relugolix + Add-back jedoch ähnlich wie bei Placebo. Das orale Kombinationspräparat aus Relugolix 40 mg mit 1 mg Estradiol und 0,5 mg Norethisteronacetat, das auch in Deutschland schon länger zur Therapie der Uterusmyome eingesetzt wird, ist seit 2. November 2023 auch für die symptomatische Behandlung der Endometriose zugelassen und wird in den aktuellen deutschen Leitlinien konsensusbasiert als Zweitlinientherapie empfohlen [38].
Experimentelle Subtanzen
1. Aromatasehemmer
Aromatasehemmer stimulieren bei prämenopausalen Frauen die Ovarien, so-dass sie zur Endometriosebehandlung immer kombiniert mit KOK (kombinierte orale Kontrazeptiva), Gestagenpräparaten oder GnRH-Analoga in Pilotstudien untersucht wurden [43]. Sie sind ähnlich effektiv wie die anderen Substanzgruppen in alleiniger Gabe, aber die Nebenwirkungen und Kosten addieren sich, so dass sie höchstens individuell in Ausnahmefällen angewendet werden.
2. Selektive Progesteronrezeptoren
Ulipristalacetat (UPA) wurde in der symptomatischen konservativen Myomtherapie eingesetzt [60]. Jedoch wurde die Verwendung wegen der Hepatotoxizität zunächst gestoppt und dann nur für Patientinnen mit symptomatischem Uterus myomatosus, bei denen eine operative Sanierung kontraindiziert ist oder ineffektiv war, eingeschränkt zugelassen.
In vivo zeigte sich durch die Behandlung von UPA eine Hemmung der Proliferation von Endometriosezellen sowie eine Verkleinerung der Herde. Es wird kein hypoöstrogener Zustand erreicht und so kommt es zur Proliferation des eutopen Endometriums (progesterone receptor modulator-associated endometrial changes [PAEC]). Bisher sind keine Daten einer klinischen Studie zur Wirksamkeit bei Endometriosepatientinnen publiziert worden [45].
3. Metformin
Tierexperimentell konnte gezeigt werden, dass Metformin sowohl in Endometriomen als auch in peritonealer Endometriose Apoptose induziert und antientzündliche Effekte hat. [50]. Klinisch wurde es bei Sterilitätspatientinnen, die laparoskopisch gesichert eine Endometriose im Stadium rAFS (revised American Fertility Society) I oder II hatten, prospektiv, randomisiert eingesetzt. Die postoperative Metformingabe führte zu einer signifikanten Verringerung der Beschwerden (P < 0,01) und zur Reduktion der Serumspiegel von IL-6, IL-8 und VEGF [42]. Weitere Untersuchungen wurden bisher nicht veröffentlicht.
Prophylaxe nach operativer und/oder medikamentöser Behandlung
Da sowohl die Operation als auch die medikamentöse Behandlung nicht kausal sind, stellt sich in vielen Fällen nach Abschluss der Primärtherapie (Operation mit/ohne medikamentöse Nachbehandlung) die Frage einer sinnvollen (Rezidiv)-Prophylaxe.
Orale Kontrazeptiva (OK) vom Kombinationstyp – besonders wenn sie kontinuierlich gegeben werden [62] – senken signifikant das Risiko von Menstruationsbeschwerden und das Risiko wiederholter Endometrioseoperationen [58] sowohl bei Peritonealendometriose [59] als auch bei Endometriomen [55].
Allerdings gibt es auch Hinweise, dass möglicherweise trotz Besserung der Symptomatik durch OK die Progression der Endometriose – speziell einer tief infiltrierende Form – begünstigt wird [47, 40]. Zurzeit muss die Frage unbeantwortet bleiben, ob die OK zur Prophylaxe geeignet sind oder nur die Progression verlangsamen oder sogar durch Unterdrückung der Symptomatik die Progression maskieren [52].
Empfehlungen für die Praxis
1. Schmerzpatientinnen
In Abhängigkeit von Stadium, Lokalisation und Typ der Erkrankung wurden Rezidivraten nach endoskopischer Chirurgie zwischen 25 und 70 % innerhalb von fünf Jahren berichtet. Die Qualität der Operateure und das Timing des Eingriffs innerhalb
des Menstruationszyklus tragen zu diesem Problem bei [53]. Durch eine postoperative medikamentöse Therapie (Gestagene oder GnRH-Agonisten) werden das Rezidivrisiko vermindert und das rezidivfreie Intervall verlängert.
Am umfangreichsten untersucht ist die Nachbehandlung mit GnRH-Agonisten für sechs Monate. Die Rezidivraten werden signifikant reduziert [39]. Der klinische Nutzen einer zusätzlichen medikamentösen Therapie ist grundsätzlich bei Schmerz-Patientinnen relevant, da ca. 20 % der Frauen auch noch postoperativ Beschwerden haben und die Rezidivraten hoch sind. Im Gegensatz zur weit verbreiteten Anwendung oraler Kontrazeptiva in der Behandlung von Endometriosebeschwerden, zeigte eine prospektiv randomisierte Studie [46], dass ihr postoperativer Einsatz nicht so effektiv ist wie die Gabe von GnRH-Agonisten. Vielmehr scheinen orale Kontrazeptiva nach einer medikamentösen Behandlung durch Gestagene oder GnRH-Agonisten als Dauerprophylaxe über lange Zeit eine sinnvolle Option [48].
2. Möglichkeiten der Langzeitbehandlung
Bei ausgedehnten und/oder progredienten Endometriose-Erkrankungen ist zwar die operative Therapie die primäre Option, aber bei schweren Verwachsungen (Adhaesionssitus) oder tief infiltrierenden Formen ist sowohl der primäre Eingriff als auch besonders die Rezidivoperation technisch schwierig und stellen den Operateur vor mannigfache Probleme, wie z. B. unvollständigen Entfernung sowie das Risiko von intra- und postoperativen Komplikationen. Eine differenzierte Indikationsstellung und eine umfassende Aufklärung der Patientin sowohl über die Komplikationen als auch über alternative Behandlungsoptionen sind zwingend [49]. Da auch hier eine Besserung der Beschwerden durch verschiedene Medikamente, wie orale Kontrazeptiva und Gestagengabe, GnRH-Analoga in Depotform oder auch physikalische Maßnahmen oder Homöopathie sowie durch intrauterine Gestagenfreisetzung zu erreichen ist, stehen unter Berücksichtigung der Chronizität der Erkrankung neben der chirurgischen Sanierung auch dauerhafte oder intermittierende Applikation dieser Substanzen zur Diskussion.
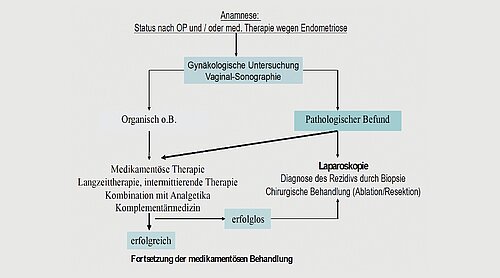
Bei Rezidivbeschwerden und/oder Rezidivbefunden kann man erneut eine operative Behandlung oder wiederholte medikamentöse Therapiephasen bzw. eine Kombination aus beidem anbieten (Abb. 2). Da Endometriose eine chronische Erkrankung ist, muss in dieser Situation ein therapeutisches Vorgehen abgesprochen werden, welches für die Frau akzeptabel ist, möglichst wenig Nebenwirkungen hat, kosteneffektiv ist und vor allem von der Patientin selbst nach entsprechender Information und Aufklärung gewünscht und mitgetragen wird.
3. Empfehlung bei endometriosebedingter Sterilität
Das Management der Sterilitätspatientin, die unter einer chronisch rezidivierenden Endometriose leidet, wird weiter kontrovers diskutiert. Bei geringer und mäßiggradiger Endometriose jedoch kann die Erkrankung mit einer funktionellen Sterilität assoziiert sein oder aber die Endometriose kann nur einen bedeutungslosen Nebenbefund darstellen. Gesichert ist: eine medikamentöse Therapie allein verbessert die Fruchtbarkeit nicht.
In fortgeschrittenen Stadien kann durch endoskopische Chirurgie eine Resektion der Implantate und Zysten erfolgen, wobei die Reproduktionsorgane mikrochirurgisch möglichst funktionsfähig wieder hergestellt werden müssen. Eine intraoperative Chromopertubation bei Endometrioseverdacht und Kinderwunsch erscheint sinnvoll.
Gelingt dies nicht oder kommt es zu einem Rezidiv der Erkrankung, liefert die assistierte Reproduktion die besten Chancen eine Schwangerschaft zu erzielen. Eine erneute Operation ist oft wenig sinnvoll und im Falle einer Ovarialendometriose schädlich [54], da bei ohnehin reduzierter Ovarialfunktion selbst der geschulteste Operateur einen Verlust von gesunden Ovargewebe nicht vermeiden kann.
Operative Therapie
Ziel der operativen Therapie ist die komplette Entfernung aller Endometrioseimplantate, um auf diese Weise Schmerzen zu beseitigen, die Fertilität zu verbessern und chronische Entzündung zu reduzieren. Da es sich meist um junge Patientinnen handelt, ist ein organerhaltendes Verfahren geboten. Als unterschiedliche Entitäten sind die a) peritoneale, b) ovarielle c) tief-infiltrierende (TIE) d) distante Endometriose und e) die Adenomyose zu berücksichtigen.
Trotz guter medikamentöser Therapieoptionen hat die operative Therapie einen hohen Stellenwert, da Organdestruktionen behoben werden können und eine effektive Schmerzreduktion ermöglicht wird und unter medikamentöser Therapie eine Schwangerschaft meist ausgeschlossen ist.
Peritoneale Endometriose
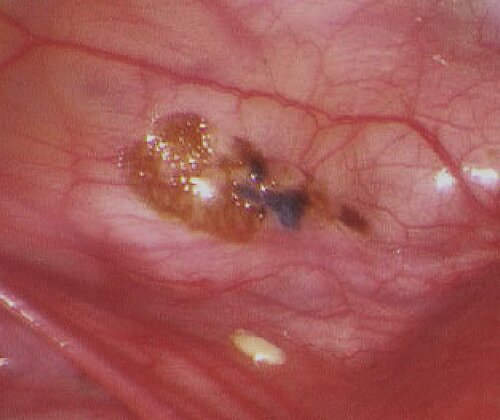
Diese häufigste Form der Endometriose tritt im gesamten Bauchraum und in unterschiedlicher Ausprägung und Form auf, oft auch in Kombination mit der ovariellen und der TIE (Abb. 9). In aller Regel lassen sich die Herde gut mit der Schere abtragen oder durch Koagulation zerstören. Dabei können mikroskopisch kleine Herde dem Operateur verborgen bleiben und somit ein Rezidiv vorprogrammieren.
Ovarielle Endometriose
Insbesondere bei Patientinnen mit Kinderwunsch ist große Vorsicht bei der operativen Therapie der Endometriome geboten, da mit jedem operativen Eingriff eine Verringerung der ovariellen Reserve verbunden ist. Dies trifft insbesondere auf die Entfernung des Zystenbalges zu, da hierbei gleichzeitig gesundes Ovargewebe mitentfernt wird; Entscheidungskriterien sind in Tab. 2 aufgeführt. Deutlich schonender verlaufen die Punktion der Zyste mit anschließender Alkoholinstillation bzw. die Eröffnung der Zyste mit anschließender Plasmakoagulation des Zystenbalges. Eine präoperative Aufklärung der Patientinnen über die Möglichkeiten und Kosten des Medical (Social) Freezings ist hilfreich.
| Tab. 2: Auflistung der Kriterien pro und contra Ovarialchirurgie bei Patientinnen mit Kinderwunsch | |
| Ja | Nein |
| Alter unter 35 Jahren | Alter über 35 Jahren |
| Keine Vor-OP am Ovar | Vor-OP am Ovar |
| Gute Ovarreserve (AMH >1,0) | Schlechte Ovarreserve |
| Sekundäre Infertilität | Primäre Infertilität |
| Endometriom einseitig | Bilaterale Endometriome |
Tief-infiltrierende Endometriose (TIE)
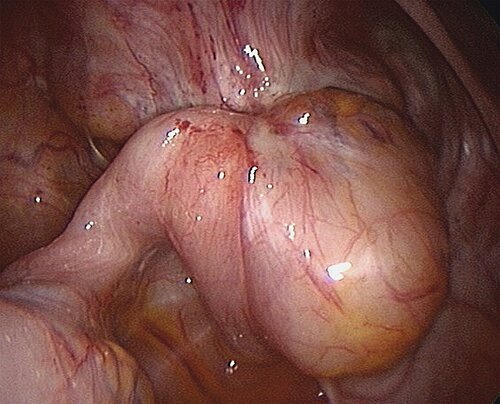
Je nach Organbefall handelt es sich bei der TIE oft um fachübergreifende Eingriffe, wie bei der Einbeziehung von Blase und Harnleiter oder Darm. Bei der Blasenendometriose ist eine Infiltration des trigonum vesicae dringend zu berücksichtigen, um späteren Innervationsproblemen vorzubeugen (Abb. 10). Bei der Versorgung von ureteraler Endometriose handelt es sich meist um eine extrinsische Endometriose, welche die Ureterwand nur indirekt involviert. Oft lässt sich die Endometriose vom Ureter abpräparieren; in schweren Fällen und bei intrinsischer Ureterendometriose ist allerdings eine Teilresektion des Harnleiters erforderlich, in speziellen Fällen mit Neuimplantation des Ureters in die Blase. Letzteres erfolgt mittlerweile oftmals auch per Laparoskopie.
Darmendometriose
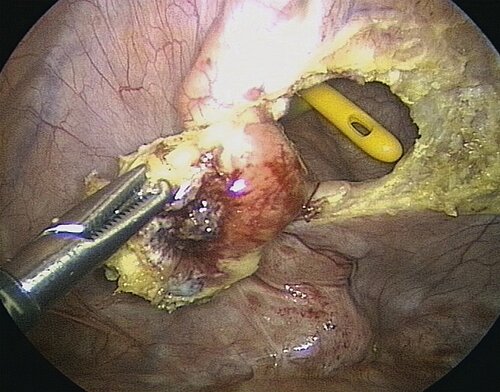
Am häufigsten ist das untere Rektum befallen, meist unter Einbeziehung des Spatium rekto-vaginale und der Ligg. sacro-uterina (Abb. 11). Bei der operativen Therapie können im Wesentlichen drei Vorgehensweisen unterschieden werden (Tab. 3).
| Tab.3: Auflistung der gängigen Operationsverfahren bei der Endometriose des Rekto-Sigmoids | |
| Befall des Rekto-Sigmoids | |
| Shaving (oberflächliches Abtragen) | Mitnahme der Serosa, Mitnahme der Muskularis |
| Disc Excision (mit Hilfe des circular staplers) | Einmalige Excision, Mehrfache Excision |
| Segmentresektion* mit Anastomose | End-zu-End Anastomose, End-zu-Seit Anastomose |
| *NOSE Technik der Segmentresektion | Entfernung des erkrankten Gewebes durch z. B. Rektum oder Vagina |
| (Abk.: NOSE = Natural Orifice Specimen Extraction) | |
Distante Endometriose
Weitaus seltener finden sich Endometrioseherde in Körperregionen außerhalb des kleinen Beckens. Darunter fallen Herde im Bauchraum wie Appendix, Dünndarm, Diaphragma und andere sowie Herde in der Lunge, Beingefäßen, Auge, Ohr und sogar im Hirn. Sollte bei der Endometriose des Appendix das gesamte Coecum befallen sein, kann ebenfalls laparoskopisch eine Resektion des Coecums mit anschließender Seit-zu-Seit-Anastomose des Colon ascendens mit dem terminalen Ileum erfolgen. Bei alleinigem Dünndarmbefall ist nach Exzision des Befundes ebenfalls eine Seit-zu-Seit-Anastomose angezeigt. Bei der diaphragmatischen Endometriose sollte vor der OP ausgeschlossen werden, dass ein gleichzeitiger Lungenbefall vorliegt. Andernfalls kann die Resektion des Herdes aus dem Diaphragma auch durch den operativ erfahrenen Gynäkologen vorgenommen werden. Sollte wider Erwarten der Pleuraspalt eröffnet werden, muss ggf. eine Drainage gelegt werden.
Adenomyose
Patienten mit ausgedehnter Adenomyose wird meist eine Hysterektomie als beste Therapiemöglichkeit geraten. Bei bestehendem Kinderwunsch verbietet sich jedoch dieses Vorgehen. Bei einer fokalen Adenomyose ist das operative Vorgehen analog der Myomtherapie vorzunehmen. Das heißt auch, dass Verfahren wie zum Beispiel die hoch-fokussierte Ultraschalltherapie in Betracht gezogen werden können.
Bei der diffusen, oft in Vorder- und Hinterwand vorkommenden Adenomyose, bietet sich gegenwärtig ein Verfahren der möglichst vollständigen Resektion adenomatösen Gewebes an mit anschließender Uterusrekonstruktion nach Osada [63]. Hierbei handelt es sich de facto um eine ausgedehnte Cytoreduktion, eine komplette Resektion des erkrankten Gewebes ist nicht möglich. Nachfolgend ist für den Fall einer Schwangerschaft die intensive Überwachung in der Schwangerschaft zu besprechen; außerdem sollte eine Sektio-Entbindung erwogen werden.
Fazit
Diese Übersichtsdarstellung der Endometriose zeigt ein weiterhin ungenügend erforschtes Krankheitsbild, welches aufgrund interdisziplinärer Symptomatik oftmals spät und unzureichend diagnostiziert wird. Die Handlungsempfehlungen zur medikamentösen und operativen Therapie orientieren sich an der wissenschaftlichen Literatur und den deutschen Leitlinien [Ref]. Geschulte und erfahrene Operateure erzielen (oftmals interdisziplinär) endoskopisch beeindruckende Resultate bei den häufigsten Lokalisationen. Die Rezidivproblematik erfordert insbesondere bei Kinderwunschpatientinnen nach einer inkompletten Operation eine geeignete Medikation, oft im Sinne einer Langzeitmedikation. Deshalb sind exakte Kenntnisse über die unterschiedlichen Wirkungsmechanismen und Nebenwirkungen der zur Verfügung stehenden Medikamente nötig, um diese gezielt oder auch in Kombination oder konsekutiv einsetzen zu können.
Die Autoren erhoffen sich von dem Beitrag eine verbesserte interdisziplinäre Diagnostik und dadurch auch eine frühere Therapie zum Wohle der vielen betroffenen meist jungen Patientinnen.
Prof. Dr. med. Dr. med. h.c. mult. Hans-Rudolf Tinneberg, Prof. Dr. med. Dr. phil. Dr. med. h.c. mult. Andreas D. Ebert, Prof. Dr. med. Dr. med h.c. Karl-Werner Schweppe
Kontakt per E-Mail via: haebl@laekh.de
Die Literaturhinweise finden Sie hier.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Endometriose“ von Prof. Dr. med. Dr. med. h. c. mult. Hans-Rudolf Tinneberg, Prof. Dr. med. Dr. phil. Dr. med. h. c. mult. Andreas D. Ebert und Prof. Dr. med. Dr. med h. c. Karl-Werner Schweppe finden Sie in der PDF-Version dieses Artikels und im Portal.
Die Teilnahme zur Erlangung von Fortbildungspunkten ist nur online über das Portal vom 25.10.2025 bis 24.04.2026 möglich. Die Fortbildung ist mit drei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Der Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es gibt kein Sponsoring und es bestehen keine Interessenkonflikte. (red)