Prof. Dr. med. Dr. oec. troph. Jürgen Stein, Prof. Dr. med. Thomas Frieling
Einleitung
Das Reizdarmsyndrom (RDS) ist die häufigste und wichtigste funktionelle Darmerkrankung mit einer Prävalenz (je nach Diagnosekriterien) zwischen 4 % und 17 % in Deutschland. Frauen sind allgemein doppelt so häufig betroffen. Betroffene leiden unter variablen gastrointestinalen Beschwerden, die länger als drei Monate anhalten und auf den Darm bezogen werden. Es ist charakterisiert durch chronische Bauchbeschwerden, für die sich in der Routinediagnostik kein ursächliches „organisches“ Korrelat finden lässt – insbesondere Bauchschmerzen, Blähungen/aufgetriebener Leib und Stuhlgangveränderungen (Diarrhoe/Obstipation).
Charakteristisch ist dabei eine stark beeinträchtigte Lebensqualität der Patientinnen und Patienten, deren hoher Leidensdruck häufige ärztliche Konsultationen nach sich zieht. Organische Ursachen lassen sich dabei nicht feststellen. Die Folge sind (unnötig) wiederholte diagnostische und therapeutische Maßnahmen. Damit kommt dem RDS auch eine nicht zu unterschätzende sozioökonomische Bedeutung zu.
War das Reizdarmsyndrom in der Vergangenheit nicht selten mit dem Stigma einer harmlosen psychosomatischen Befindlichkeitsstörung behaftet, wird es heute mit wachsendem Verständnis der Pathophysiologie als „organische Erkrankung“ angesehen. Auch werden zunehmend moderne, gezieltere Therapien für das RDS entwickelt.
Häufigkeit und sozialmedizinische Relevanz des Beschwerdekomplexes, Leidensdruck und Einschränkungen der Lebensqualität vieler Betroffener sowie Unsicherheit und Frustration von Betroffenen und Ärzten bezüglich Diagnostik und Therapie machen eine leitlinienorientierte Diagnostik und Therapie sinnvoll. In Anlehnung an die aktualisierte Leitlinien fasst dieser Beitrag das aktuelle Wissen zu Pathophysiologie, Diagnostik und Therapie dieser häufigsten Darmerkrankung zusammen.
Definition
Seit mehr als vier Jahrzehnten wird versucht, eine praktisch brauchbare und dabei wissenschaftlich präzise Definition für das RDS zu finden. An erster Stelle ist die Klassifikation im Rom-Prozess (aktuell: Rom-IV-Version [1]) zu nennen, in der die Charakterisierung des Syndroms dem jeweils aktuellen wissenschaftlichen Erkenntnisstand angepasst wurde. In der klinischen Praxis hat sich die Definition der deutschen aktuell gültigen S3-Leitlinie bewährt [2]:
- Es bestehen chronische, mindestens seit drei Monaten anhaltende Beschwerden, die auf den Darm bezogen werden und in der Regel (allerdings nicht obligat) mit Stuhlgangveränderungen einhergehen.
- Das Ausmaß der Beschwerden begründet, dass der Betroffene deswegen Hilfe sucht und hierdurch auch in seiner Lebensqualität nachvollziehbar beeinträchtigt ist.
- Es dürfen im Rahmen der Routinediagnostik keine anderen pathologischen Befunde erhoben werden, welche diese Symptome wahrscheinlich verursachen.
Klinik
Die klinische Manifestation des RDS (Symptomatik, Anamnese, körperlicher Untersuchungsbefund) kann suggestiv sein. Sie erlaubt jedoch in der Regel keine sichere Abgrenzung zu einer differenzialdiagnostisch in Betracht zu ziehenden „organischen“ Erkrankung. In aller Regel besteht ein Symptomkomplex mit den Komponenten
- Bauchschmerzen und/oder Darmkrämpfe,
- Stuhlgangveränderungen (Obstipation, Diarrhoe oder beides im Wechsel) sowie
- meist auch Blähungen/abdominelle Distension und/oder Flatulenz.
Die Symptome können in unterschiedlichen Kombinationen auftreten, wechseln sich in ihrer relativen Schwere oft ab und können sich zwischenzeitlich (weitgehend) zurückbilden. Insgesamt bleibt das Syndrom aber in sich in etwa stabil; eine sich immer weiter steigernde Progredienz ist nicht typisch.
In Abhängigkeit von den dominierenden Einzelsymptomen kann das RDS in Subtypen unterteilt werden. Üblich ist hierbei die Einteilung in [2, 3]:
- einen Obstipationstyp (RDS-O): Stuhlgang hart/klumpig in ≥ 25 % der Stuhlgänge und breiig/wässrig in < 25 % der Stuhlgänge
- einen Diarrhoetyp (RDS-D): Stuhlgang breiig/wässrig in ≥ 25 % der Stuhlgänge und hart/klumpig in < 25 % der Stuhlgänge
- einen Schmerz- (und/oder Bläh-) Typ (meist: RDS-U): ohne ausreichende Stuhlgangsveränderungen für einen anderen Subtyp
- einen Mischtyp (RDS-M): wechselndes Stuhlverhalten innerhalb von Stunden/Tagen mit Stuhlgang breiig/wässrig in ≥ 25 % der Stuhlgänge und hart/klumpig in ≥ 25 % der Stuhlgänge
- einen alternierenden Typ (RDS-A): wechselndes Stuhlverhalten innerhalb von Stunden/Tagen
Merke: Die Zuordnung der Patientinnen und Patienten zu einem der Subtypen ist für das diagnostische und therapeutische Management essenziell.
Ätiologie und Pathogenese
Das Reizdarmsyndrom hat eine komplexe und noch nicht vollständig geklärte Ursache, bei der biologische, psychische und soziale Faktoren gemäß dem biopsychosozialen Modell eine Rolle spielen. Genetische Veranlagungen, Infektionen, psychische Belastungen wie Angst und Stress sowie soziale Einflüsse von Angehörigen und Ärzten wirken zusammen, um die Prädisposition, den Ausbruch und den Verlauf der Krankheit zu beeinflussen [4, 5].
Auch Störungen in der zentralen Verarbeitung viszeraler Reize und psychosoziale Faktoren spielen eine entscheidende Rolle für das Krankheitserleben und den Verlauf des RDS. Verschiedene molekulare und zelluläre Mechanismen, einschließlich einer gestörten Barrierefunktion des Darms und der Aktivierung entzündlicher, immunologischer und neuronaler Prozesse, führen zu einer Überempfindlichkeit und Funktionsstörung des Darms. Etwa 30 % der RDS-Patienten scheinen Motilitätsstörungen im Kolon zu haben, da 25 % der RDS-O- einen verlangsamten und bis zu 45 % der RDS-D-Patienten einen beschleunigten Kolontransit zeigen (Übersicht bei [6]).
Virale Gastroenteritiden erhöhen das Risiko für ein Reizdarmsyndrom nach Metaanalysen etwa um den Faktor 2, bakterielle Enteritiden um den Faktor 4. Nach parasitären Infektionen wurde sogar eine Prävalenz des Reizdarmsyndroms von über 40 % gefunden [7, 8]. Im Rahmen solcher Infektionen scheint es zu einer persistierenden mukosalen Barrierestörung und einer veränderten Immunfunktion zu kommen, die mit subklinischen entzündlichen Veränderungen einhergehen. Die dabei freigesetzten Entzündungsmediatoren können Motilität, Sekretion und Sensibilität beeinflussen und zu den typischen Symptomen führen (Tab. 1, nur online).
| Tab. 1: Funktionsstörungen und deren pathophysiologische Hintergründe bei Reizdarm [6] | |
| Funktionsstörung | Pathophysiologisch relevante Faktoren |
| Motilitätsstörungen | Kolontransit 48 h (↓ beim RDS-D) Kolontransit 48 h (↑ beim RDS-O) Gallensäuren im Stuhl (↑ beim RDS-D) Nav1.5-Fehlfunktion (relevant bei etwa 2 % der RDS-Patienten) |
| Sensomotorische Störungen | ↑ Proteasen im Schleimhautmediatorcocktail (Biopsieüberstände) ↑ Proteasen im Stuhl (RDS-D) Akute Aktivierung enterischer Nerven durch Schleimhautmediatorcocktail Reduzierte nervale Antworten in Patientenbiopsien auf Mediatorcocktail (proteaseinduzierte Desensibilisierung) Aktivierung extrinsischer Sensoren (Nozizeptoren und Mechanosensoren) durch Schleimhautmediatorcocktail und PBMC-Mediatorcocktail ↑ BDNF- und NGF-Spiegel in der Darmwand ↓ PYY- und ↑ Somatostatinzellen in der Rektumschleimhaut ↓ CgA-Zelldichte in der Duodenalschleimhaut |
| Viszerale Hypersensitivität | ↑ Sensibilität nach Rektumdehnung ↑ Sensibilisierung auf Rektumdehnung (nach vorheriger Sigmadehnung) |
| Erhöhte mukosale Permeabilität | ↑ Epitheliale Permeabilität ↓ Zonula-occludens-Expression |
| Post-infektiöse Plastizität | ↑ Erhöhung intraepithelialer Immunzellen ↑ IL-1β und IL-6 in der Darmwand T-Zell-abhängige EC-Zell-Hyperplasie infolge einer Gastroenteritis |
| Immunaktivierung | ↑ TNFα- und IL-1β-Freisetzung ↑ Expression der Rezeptoren TLR2 und TLR4 ↑ TH2-Zytokinin-Spiegel im Blut ↑ Dichte und Reaktivität epithelialer Immunzellen ↑ Defensin (antimokrobielles Peptids β) Flagellinantikörper Antikörper gegen enterische Nervenzellen |
| Genetische Prädisposition (Polymorphismen) | TNFSF15 (proinflammatorisch, aktiviert NF-KB und Zelltod) PARM1 (Muzin?) KDELR2 (Proteinsortierung im ER) GRID2IP (Aktivierung von Glutamatrezeptor) |
| Gestörte 5HT-Signalwege | 5-HT3– und 5HT-Transporter-Polymorphismen (RDS-D) ↑ 5HT-Plasmaspiegel (RDS-D) ↓ 5HT-Plasmaspiegel (RDS-O) |
| Verändertes Mikrobiota | ↓ Diversität ↑ Enterobacteriaceae, Veillonella, Streptococcus (RDS-D), Dorea, Blautia, Roseburia, Ruminococcus, Methanobrevibacter (RDS-O) ↓ Bifidobakterium, Collinsella, Streptococcus (RDS-O), Faecalibacterium, Christensenellaceae, Clostridiales, Methanobrevibacter (RDS-M) |
| BDNF „brain derived neurotrophic factor“, CCK Cholecystokinin, CgA Chromagranin A (Marker für enteroendokrine Zellen), ER endoplasmatisches Retikulum, GDNF „glial cell line-derived neurotrophic factor“, GNβ3 „G-protein β polypeptide-3“, 5-HT Serotonin, IL Interleukin, Nav1.5 tetrodotoxininsensitiver Natriumkanal, NGF „nerve growth factor“, PBMC „peripheral blood mononuclear cells“ (primär Lymphozyten und Monozyten), PΥΥ Peptid ΥΥ, RDS-D Reizdarmsyndrom vom Durchfalltyp, RDS-M Reizdarmsyndrom mit Durchfall und Obstipation alternierend, RDS-O Reizdarmsyndrom vom Obstipationstyp, TH2 Typ-2- T-Helferzellen, TLR Toll-like-Rezeptoren, TNFα Tumornekrosefaktor α | |
Diagnostik
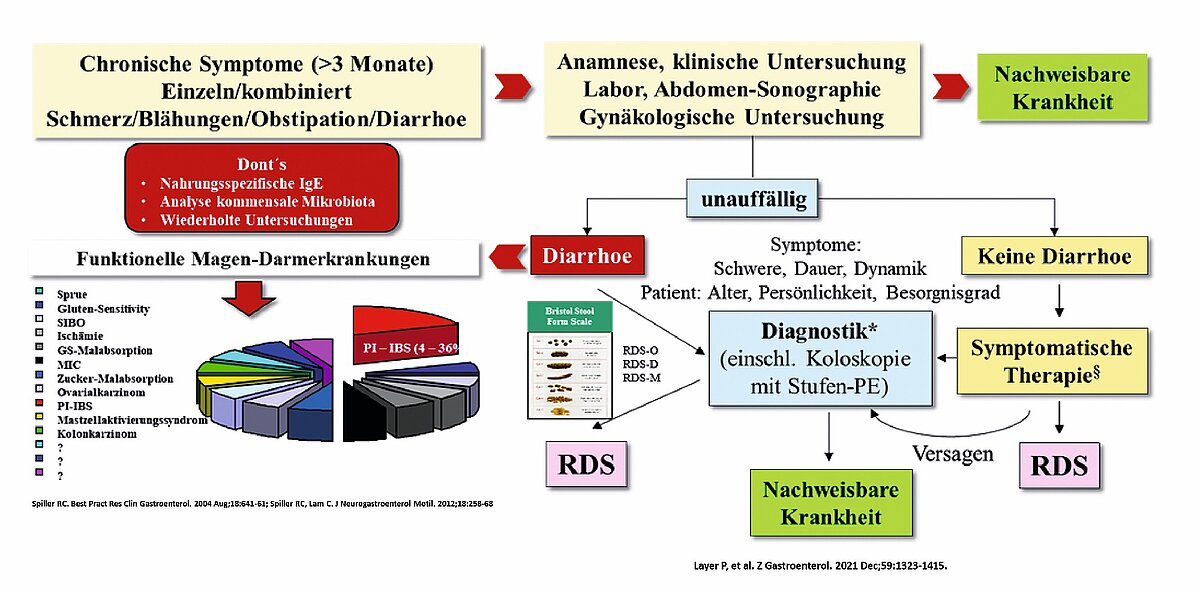
Das RDS ist durch das Fehlen wegweisender organischer Befunde geradezu definiert. Nach wie vor fehlt ein klinisch brauchbarer Biomarker zur verlässlichen positiven Diagnose des Syndroms, weshalb der Anamnese eine zentrale Bedeutung zukommt. Bei passendem Beschwerdemuster und typischen anamnestischen Merkmalen kann eine Verdachtsdiagnose gestellt werden. Da die Symptome jedoch unspezifisch sind, sind gezielte diagnostische Verfahren notwendig, um relevante Differenzialdiagnosen auszuschließen (Abb. 1, nur online).
Dabei ist es essenziell, etwaige Symptome aktiv zu erfragen, weil diese auf eine organische, möglicherweise auch schwerwiegende Erkrankung hinweisen können. Hierzu zählen vor allem (nach [2, 5]):
- Blut im Stuhl, Teerstuhl, Fettstühle
- Fieber
- erst kurz zurückliegender Beschwerdebeginn
- kontinuierliches, progredientes Beschwerdebild
- Gewichtsabnahme bei unveränderter Kalorienzufuhr
- wiederholtes Erbrechen, Bluterbrechen
- Störung des Nachtschlafs durch gastrointestinale Beschwerden
- Erstmanifestation nach dem 50. Lebensjahr
- familiäre Belastung, insbesondere Malignome
Die Diagnose eines Reizdarmsyndroms gilt als gesichert, wenn alle relevanten und plausiblen Differenzialdiagnosen im Einzelfall verlässlich ausgeschlossen wurden (siehe Tab. 2). Das diagnostische Vorgehen sollte sich primär am Leitsymptom orientieren. Gegebenenfalls kann dies auch bedeuten, auf weitergehende, aber im Einzelfall weniger relevante Differenzialdiagnosen zu verzichten. Eine gründliche Anfangsdiagnostik, die von vielen Patientinnen und Patienten gewünscht wird, hat den Vorteil, dass sie therapeutisch wirkt, da die Angst vor einer ernsten Erkrankung bei Patienten und Ärzten genommen wird („Reassurance“). Danach kann vollständig auf weitere Diagnostik verzichtet und der Fokus auf die Symptombehandlung gelegt werden, sofern sich das Beschwerdebild nicht grundlegend ändert. Wiederholungsuntersuchungen sind daher grundsätzlich nicht angezeigt.
| Tab. 2 Auswahl wichtiger Differenzialdiagnosen bei Reizdarmbeschwerden [40] | ||
| RDS-Typ | Typische Klinik | Mögliche Differenzialdiagnosen |
| RDS-D: Diarrhoetyp |
|
|
| RDS-O: Obstipationstyp |
|
|
| Blähtyp |
|
|
| Schmerztyp |
| |
| CED: chronisch-entzündliche Darmerkrankungen, RDS: Reizdarmsyndrom | ||
Ergibt sich der konkrete Anhalt auf spezifische Unverträglichkeiten von z. B. Milchprodukten, fruchtzuckerhaltigen, getreidehaltigen oder histaminhaltigen Lebensmitteln, sollten als Differenzialdiagnosen zugrunde liegende Kohlenhydrat-Malabsorptionen, Nicht-Zöliakie-Nicht-Weizenallergie-Weizensensitivität (NZNW-WS) oder auch eine Intoleranz gegenüber Histamin und/oder anderen biogenen Aminen bedacht und abgeklärt werden; auch Hinweise auf eine IgE- oder nicht-IgE-vermittelte Nahrungsmittelallergie (z. B. bei begleitenden Allergiesymptomen wie Hautausschlägen, Schleimhautschwellungen im Mundbereich o. Ä.) sollten abgeklärt werden [2].
Grundsätzlich sollten die seltenen, immunologisch vermittelten Nahrungsmittelallergien (IgE- und nicht-IgE-basiert) klar von häufigeren Nahrungsmittelintoleranzen (z. B. Laktose-, Fruktose-, FODMAP-Intoleranz) abgegrenzt werden. Streng postprandial auftretende Beschwerden mit extraintestinalen Symptomen (wie Hautreaktionen, Atembeschwerden, Kreislaufreaktionen) oder isolierte gastrointestinale Beschwerden können auf Nahrungsmittelallergien hindeuten. Bei Verdacht ist eine interdisziplinäre Abklärung mit allergologischer Unterstützung erforderlich, um durch Methoden wie Ernährungssymptomtagebuch, verblindete orale Provokation, Prick-Hauttests und spezifische IgE-Bestimmung Hinweise auf Nahrungsmittelsensibilisierungen zu erhalten. Methylhistaminbestimmung im Urin kann zudem eine erhöhte Histaminproduktion nachweisen. Zur Bestätigung dienen abschließend eine orale Provokation oder ein ärztlich überwachter Eliminations- und Expositionstest.
Cave: Eine Diagnostik auf nahrungsspezifisches IgG sollte nicht erfolgen [2].
Eine subjektive Histaminunverträglichkeit wird von Patientinnen und Patienten häufig berichtet. Die Existenz einer Unverträglichkeit gegenüber Histamin und anderen biogenen Aminen ist allerdings selten. Eine geeignete Labordiagnostik fehlt bislang; Enzymbestimmungen wie die der Diaminooxidase (DAO) sind zur Diagnose oder zum Ausschluss von Histaminintoleranz nicht geeignet [42]. Bei klinischem Verdacht wird neben einer allergologischen Abklärung eine orale Provokationstestung mit beispielsweise 75 mg Histamin unter ärztlicher Überwachung und Dokumentation eines Beschwerdescores empfohlen.
Bei Beschwerden, die durch Getreideprodukte ausgelöst oder verstärkt werden, sollte differenzialdiagnostisch an eine Nicht-Zöliakie-nicht-Weizenallergie-Weizensensitivität (NZNW-WS) gedacht werden. Obwohl es keine einheitliche internationale Definition für dieses Krankheitsbild gibt, sind auch die Begriffe Glutensensitivität oder Weizensensitivität (engl. NCGS/NCWS) gebräuchlich. Die Studienlage zur Abgrenzung der NZNW-WS vom Reizdarmsyndrom ist begrenzt und oft von der Annahme geprägt, dass Gluten der primäre Auslöser sei. Neuere Erkenntnisse weisen jedoch darauf hin, dass neben Gluten auch FODMAPs, Ballaststoffe, Fruktane und Amylase-Trypsin-Inhibitoren (ATI) als wahrscheinlichere Auslöser eine Rolle spielen [9].
Therapeutisches Management
Das Reizdarmsyndrom kann derzeit nicht ursächlich behandelt werden, sodass die Linderung der Symptome das primäre Therapieziel darstellt. Dazu gehören eine gesicherte Diagnose, die umfassende Aufklärung der Patient*innen über ihre Erkrankung sowie die Förderung von Selbstmanagementstrategien in Bezug auf individuelle Trigger- und Linderungsfaktoren wie Ernährung, Lifestyle und physische Aktivität. Ergänzend kann, falls erforderlich, die Behandlung psychischer Komorbiditäten erfolgen, die häufig bei einer Untergruppe der Betroffenen auftreten.
Eine aktive Einbindung der Patienten in das Management sowie die Erklärung der pathophysiologischen Grundlagen können die Wirksamkeit der Therapie verbessern und die Lebensqualität steigern. Aufgrund der variablen Symptomatik und der unterschiedlichen Wirksamkeit der Therapieansätze hat jede Behandlung zunächst einen probatorischen Charakter. Das breite Spektrum an medikamentösen und nichtmedikamentösen Therapiemöglichkeiten erlaubt keine garantierte Vorhersagbarkeit der individuellen Wirksamkeit.
Das vorrangige Ziel aller Therapieansätze – ob ernährungsmedizinisch (z. B. „low FODMAP“), psychoedukativ, phytotherapeutisch oder pharmakologisch – ist die Kontrolle der Symptome und die Verbesserung der Lebensqualität. Die medikamentöse Therapie wird an den vorherrschenden Symptomkomplex angepasst, wobei das Ansprechen auf alle Therapieoptionen individuell unterschiedlich ausfällt. Häufig müssen daher mehrere Ansätze ausprobiert werden, um eine spürbare Linderung der Beschwerden zu erreichen.
Ernährungsmedizinische Maßnahmen
Ernährungsfaktoren können beim Reizdarmsyndrom Symptome triggern und/oder modulieren, d. h. sowohl exazerbieren als auch lindern. Daher sind ernährungsmedizinische/ernährungstherapeutische Maßnahmen essenzieller Bestandteil eines Therapiekonzepts für Patienten mit einem RDS. Die Vielzahl von Ernährungsoptionen, die entweder einer nachvollziehbaren pathophysiologischen Vorstellung oder einer individuellen Unverträglichkeit folgen, setzt eine ärztliche Indikationsstellung und Aufklärung zu den entsprechenden Diäten zwingend voraus. Dabei ist auch zu berücksichtigen, dass Placeboeffekt und Suggestion eine relevante Rolle in der Behandlung des RDS spielen können. Dies sollte auch in der Ernährungsberatung von Bedeutung sein und bei der Bewertung der Studienergebnisse bedacht werden [10].
Es können keine einheitlichen Ernährungsempfehlungen für alle Patientinnen und Patienten mit einem Reizdarmsyndrom gegeben werden. Es gibt aber zahlreiche individuelle Ernährungsempfehlungen, die sich an den jeweiligen Symptomen/Subtypen orientieren. Längerfristige Eliminationsdiäten sollten nur bei gesichertem Nachweis individueller Nahrungsmittelunverträglichkeiten und unter ernährungsmedizinischer/ernährungstherapeutischer Beratung und Kontrolle versucht werden [2].
Bei Erwachsenen mit Reizdarmsyndrom und vorwiegend obstipativen Beschwerden sollten Ballaststoffe zur Behandlung eingesetzt werden. Dabei sind lösliche Ballaststoffe vom Typ Psyllium (syn. Flohsamen, Ispaghula) zu bevorzugen. Cave: Sie können vor allem initial auch Nebenwirkungen wie verstärkte Blähungen hervorrufen. Es ist wichtig, mit niedrigen Dosen zu beginnen und diese je nach Verträglichkeit langsam und vorsichtig zu steigern. Nicht lösliche Ballaststoffe zeigten keine Wirkung.
Um die positiven Effekte von Ballaststoffen beim Reizdarmsyndrom vom Obstipationstyp zu verstärken, sollte auf eine ausreichende tägliche Trinkmenge hingewiesen werden. Aufgrund möglicher synergistischer Effekte kann eine Kombination von Ballaststoffen und ausgewählten Probiotika zur Behandlung des Reizdarmsyndroms versucht werden, siehe unten.
Eine Karenz histaminreicher Lebensmittel und solcher, die als Histaminliberatoren gelten, sollte nur bei gesicherter Diagnose (siehe oben) erfolgen. Liegt kein eindeutiger Nachweis vor, kann jedoch bei starkem klinischen Verdacht ein zeitlich begrenzter Eliminationsversuch (vier bis sechs Wochen) mit einer von Fachgesellschaften validierten Lebensmittelliste durchgeführt werden [43]. Eine langfristige Karenz ist nur dann empfohlen, wenn eine deutliche symptomatische Besserung erzielt wird.
Eine glutenfreie Diät wird zur generellen Therapie des Reizdarmsyndroms nicht empfohlen. Bei Verdacht auf Unverträglichkeit gegenüber Getreideprodukten sollten zunächst Zöliakie und Weizenallergie ausgeschlossen werden. Wenn diese Diagnosen nicht vorliegen und Patient*innen dennoch positiv auf eine glutenfreie/-arme Ernährung reagieren, spricht dies für eine Nicht-Zöliakie-nicht-Weizenallergie-Weizensensitivität (ausführlicher Darstellung bei [9]).
Bei Schmerzen, Blähungen und Diarrhoe als dominantes Symptom sollte eine Low-FODMAP-Diät (in drei Phasen: Elimination, Toleranzfindung, Langzeiternährung) empfohlen werden. Bei Obstipation als prädominantes Symptom kann sie angeboten werden [2]. Aufgrund der überzeugenden Datenlage [11–13] ist sie als ernährungsmedizisches Behandlungskonzept für das Reizdarmsyndrom Bestandteil sowohl internationaler als auch in den deutschen Leitlinien [2, 13, 14].
FODMAPs (fermentierbare Oligo-, Di- und Monosaccharide und Polyole) sind kurzkettige Kohlenhydrate, die im Dünndarm schlecht aufgenommen werden und spätestens im Dickdarm osmotisch aktiv werden. Dort fermentieren sie rasch, was zu Bauchschmerzen, Blähungen und weichem, voluminösem Stuhl führen kann. Eine FODMAP-arme Ernährung schließt daher viele Lebensmittel aus, die in einer Diät zur Reduktion gasbildender Nahrungsmittel oft noch enthalten sind. Die Low-FODMAP-Diät sollte Patienten von einem medizinischen Ernährungsberater/in präsentiert werden, um unnötige, zu starke Einschränkungen und eine Mangelernährung zu vermeiden und um orthorektische oder anorektische Patientinnen zu identifizieren.
Merke: Die besten Daten bezüglich einer interventionellen Ernährungstherapie existieren für die Low-FODMAP-Diät im Behandlungskonzept für das Reizdarmsyndrom.
Präbiotika, Probiotika, fäkaler Mikrobiomtransfer
Präbiotika sind unverdauliche Nahrungsbestandteile, die den Wirtsorganismus günstig beeinflussen, indem sie gezielt das Wachstum oder die Aktivität bereits im Kolon vorhandener nützlicher Bakterien stimulieren. Zwar haben (fermentierbare) Ballaststoffe (Quellstoffe) ebenfalls präbiotische Eigenschaften, aber nicht nur, sondern es treten zusätzlich physikalische Effekte auf (u. a. Erhöhung des Stuhlvolumens), so dass das Wirkprinzip unklar ist (siehe oben).
Aufgrund der geringen Evidenzlage gibt die S3-Leitlinie zu präbiotischen Substanzen keine spezifische Empfehlung. Genauso wenig empfiehlt die S3-Leitlinie einen fäkalen Mikrobiomtransfer als Teil des Behandlungskonzepts bei Reizdarmsyndrom.
Die aktuelle Literatur zeigt, dass Probiotika in der Therapie des RDS nicht generell als wirksam oder unwirksam eingestuft werden können. Für eine Reihe von probiotischen Bakterienstämmen liegen randomisierte kontrollierte Studien bei RDS vor. In den meisten Studien und Metaanalysen konnte gezeigt werden, dass die Hauptsymptome des RDS und die Lebensqualität verbessert wurden. Daher werden ausgewählte probiotische Bakterienstämme mit positiver Studienevidenz zum Einsatz beim RDS empfohlen. Die Auswahl des Bakterienstammes sollte symptomorientiert erfolgen, auch wenn die Studienlage hierzu heterogen ist [15, 16].
Unter Berücksichtigung der aktuellen Studienlage sowie der praktischen Verfügbarkeit in Deutschland können für die tägliche Praxis folgende Probiotika zusätzlich zu der üblichen symptomatischen Therapie empfohlen werden (Tab. 3).
| Tab. 3: Probiotika, die den aktuellen S3-Leitlinien nach bei der Behandlung des Reizdarmsyndroms sinnvoll sind [25] | ||
| diarrhödominater Subtyp | obstipationsdo minater Subtyp | gemischter Subtyp |
| Bifidobacterium longum NCC3001 Lactobacillus plantarum 299v Lactobacillus brevis KB 290 Lactobacillus gasseri CP2305 Bacillus coagulans MTCC 5856 Bifidobacterium infantis 35624 Bifidobacterium bifidum MIMBb75 Lactobacillus acidophilus NCFM | Bifidobacterium animalis DN173010 Lactobacillus gasseri CP2305 Lactobacillus reuteri (DSM 17938) Bifidobacterium bifidum MIMBb75 Lactobacillus acidophilus NCFM Lactobacillus plantarum 299v | Lactobacillus plantarum 299v Bifidobacterium longum NCC3001 Bifidobacterium infantis 35624 Bifidobacterium bifidum MIMBb75 Lactobacillus acidophilus NCFM |
| Merke: Die Auswahl unterschiedlicher Probiotika sollte nach der vorherrschenden klinischen Symptomatik erfolgen. | ||
Komplementäre naturheilkundliche Strategien
Es gibt keine einheitliche Definition für komplementäre und alternative Therapieverfahren. International wird der Begriff „Complementary and Alternative Medicine“ (CAM) häufig verwendet. Komplementärmedizin ergänzt konventionelle Standardtherapien, während alternative Verfahren diese ausschließen. In Deutschland werden komplementärmedizinische und naturheilkundliche Ansätze meist nicht als Alternative, sondern als Ergänzung zur konventionellen Medizin betrachtet.
Die kombinierte Anwendung von konventionellen und komplementären Methoden wird als integrative Medizin bezeichnet. Diese verfolgt einen multimodalen Ansatz, der konventionelle Therapien mit naturheilkundlichen Methoden, Selbsthilfestrategien und Lebensstilmodifikationen kombiniert, um ein individuell angepasstes Therapiekonzept zu schaffen.
Pfefferminzöl hat sich als wirksam bei der Behandlung von Schmerzen und Blähungen, den Hauptsymptomen des Reizdarmsyndroms, erwiesen und wird vor allem für die kurzfristige Anwendung empfohlen. Studien und Metaanalysen zeigen signifikante Verbesserungen der Symptome im Vergleich zu Placebo, insbesondere durch die Einnahme magensaftresistenter Kapseln, die gut verträglich sind und sowohl Bauchschmerzen als auch allgemeine Beschwerden lindern [17]. Daten zur Langzeitanwendung fehlen jedoch.
Berberin-basierte Präparate haben sich als wirksames Mittel bei der Behandlung von Patienten mit Diarrhoe dominantem Reizdarmsyndrom (IBS-D) erwiesen. Es zeigen sich positive Effekte bei Symptomen wie Schmerzen, Blähungen und Diarrhoe. Die Wirkung von Berberin basiert auf der Aktivierung von mu- und delta-Opioid-Rezeptoren, was zu einer Reduktion viszeraler Schmerzen und einer Regulierung der Darmmotilität führt. Studien belegen signifikante antidiarrhöische Effekte sowie eine Verminderung der Stuhlfrequenz und eine Verbesserung der Stuhlkonsistenz bei funktionellen Darmerkrankungen [20, 21].
STW-5 und STW-5-II, Mischungen aus pflanzlichen Extrakten wie Iberis Amara, Kamillenblüten und Pfefferminzblättern, zeigten signifikante Verbesserungen bei allgemeinen RDS-Symptomen (IBS-SS) sowie spezifisch bei abdominellen Schmerzen [22].
Padma Lax, ein tibetisches Phytopharmakon aus 15 Pflanzenextrakten und Mineralien, erwies sich nach dreimonatiger Behandlung bei obstipationsdominantem RDS (IBS-C) als wirksam gegen Schmerzen, Obstipation, Blähungen, Spannungsgefühl und unvollständige Entleerung [23].
Zu Homöopathie sowie für Präparate wie Aloe Vera und Gwakhyangjeonggisan (GJS) finden sich entweder keine oder kontroverse Daten zur Wirksamkeit.
Neben der Phytotherapie können auch komplementäre Ansätze wie Yoga, Akupunktur und Moxibustion eingesetzt werden, um die Lebensqualität von RDS- Patienten zu steigern.
Die individuelle Anpassung der Behandlung ermöglicht eine optimale Integration dieser Therapien in das Gesamtkonzept zur Linderung der Beschwerden und Verbesserung der Lebensqualität.
Heilfasten
Qualitativ hochwertige Studien zum Heilfasten fehlen bisher, jedoch deuten die vorliegenden Daten auf mögliche Verbesserungen bei RDS-spezifischen Symptomen, Depression, Ängstlichkeit und Lebensqualität hin. Dabei könnte das Heilfasten über Mechanismen wie die Beeinflussung der Darmflora und die Reduktion von Entzündungsprozessen wirken. So zeigte beispielsweise eine Studie, dass Fasten ähnliche anti-entzündliche Effekte wie bestimmte diätetische Interventionen aufweisen kann und möglicherweise die Regeneration der Darmschleimhaut unterstützt [24]. Allerdings bleiben die Auswirkungen auf die Darmflora und die langfristige Nachhaltigkeit eines positiven Effekts weitgehend ungeklärt.
Um mögliche Komplikationen wie Mangelerscheinungen, die Entwicklung von Essstörungen (z. B. Orthorexie) oder Ängste vor erneuter Nahrungsaufnahme zu verhindern, ist die strikte Einhaltung von Ausschlusskriterien essenziell. Heilfasten sollte beispielsweise nicht bei Kindern und Jugendlichen durchgeführt werden. Die Unterstützung durch ärztliche Aufsicht ist notwendig, um gesundheitliche Risiken zu minimieren. Heilfasten sollte daher nur in ausgewählten Fällen und unter streng kontrollierten Bedingungen erwogen werden. Studien zur Rolle des Fastens bei chronischen Darmerkrankungen und dessen Auswirkungen auf die psychische Gesundheit könnten weitere Einblicke liefern [2].
Viszerale Osteopathie und Darmmassage können als unterstützende Maßnahmen bei RDS angeboten werden, da Studien kurzfristige signifikante Verbesserungen in Symptomen wie Bauchschmerzen und Darmfunktion im Vergleich zu Sham- oder Standardbehandlungen zeigen. Eine Empfehlung für Darmlavage (Irrigation) besteht nicht, da wesentliche Evidenz fehlt, obwohl kleine Studien und Fallberichte vereinzelte positive Effekte bei funktionellen Enddarmstörungen andeuten [2].
Psychoedukative Behandlungsansätze/Psychotherapie
In Abhängigkeit von Verfügbarkeit, Patientenwünschen und ärztlicher Expertise sollten psychotherapeutische Verfahren als Teil des Behandlungskonzepts in folgenden Situationen erwogen werden bzw. angeboten werden (nach Hauser):
- mittelschwere bis schwerwiegende gastrointestinale Beschwerden mit deutlicher Beeinträchtigung der Lebensqualität (Einschränkung der Lebensführung und Alltagsaktivitäten)
- fortgesetzte gastrointestinale Beschwerden unter adäquater medizinischer Behandlung (nach drei bis sechs Monaten) mit signifikanter Einschränkung der Lebensqualität;
- psychische Komorbiditäten: depressive Stimmung, Antriebsverminderung, erhöhte Ermüdbarkeit, Interessenverlust, Freudlosigkeit;
- sozialer Rückzug, ausgeprägte Ängste und/oder Vermeidungsverhalten;
- auffällige Inanspruchnahme des Gesundheitssystems;
Als geeignete psychotherapeutische Verfahren bei RDS erweisen sich kognitive Verhaltenstherapie (Cognitive-behavioral therapy, CBT), psychodynamische Psychotherapie, bauchgerichtete Hypnose (gut-directed hypnosis) sowie Verfahrensmischformen (multi-component psychotherapy) [4, 5].
Sowohl zur CBT als auch psychodynamischer Psychotherapie ist anzumerken, dass die berichteten Outcome-Variablen meist allgemeiner Natur und nur manche spezifisch gastroenterologisch sind
Als einziges organspezifisches Verfahren gilt die bauchgerichtete Hypnose (gut-directed hypnosis, GDH), die in Deutschland allerdings meist nur an spezialisierten Zentren verfügbar ist. Bei ihr zeigen sich in mehreren Metaanalysen mittlere Effektstärken für Symptombesserung und RDS global am Ende der Therapie.
Als wirksam haben sich auch multimodale Therapieprogramme und Verfahrensmischformen erwiesen („multi-component psychological therapy“). Die untersuchten Programme enthielten hauptsächlich Elemente der Entspannungstherapie, Biofeedback, Patientenedukation und CBT.
Medikamentös-symptom-orientierte Ansätze
Beim Reizdarmsyndrom gibt es keine gesicherte kausal wirksame medikamentöse Behandlung und keine standardisierte symptomatische Therapie. Die ärztliche Begleitung und umfassende Aufklärung der Patientinnen über Beschwerden, Ursachen und die Prognose sind daher essenziell. Aufgrund der unterschiedlichen Symptome und individuellen Therapieansprechen wird jede Behandlung zunächst probeweise durchgeführt. Die Unterteilung in Subtypen (Obstipations-, Diarrhoe-, Misch- und Schmerz-/Blähtyp) erleichtert die Diagnostik und Therapieplanung. Da die Ursache und Symptome von RDS stark variieren, existiert ein breites Spektrum an medikamentösen und nichtmedikamentösen Therapieoptionen, deren Wirksamkeit jedoch individuell unterschiedlich und nicht vorhersagbar ist. Häufig sind Kombinationen und Off-Label-Anwendungen erforderlich, über deren Besonderheiten Patientinnen stets informiert werden müssen (Tab. 3).
RDS mit prädominanten Schmerzen/Krämpfen
Bei Schmerzen ist eine gute Wirksamkeit für den Einsatz von Spasmolytika wie Butylscopolamin, Mebeverin oder Pfefferminzöl nachgewiesen [25]. In schweren Fällen mit deutlicher Beeinträchtigung der der Lebensqualität und insbesondere bei begleitenden psychischen Komorbiditäten kann eine Medikation mit niedrig dosierten Antidepressiva erfolgversprechend sein. Hier wird Amitriptylin empfohlen [26], sofern keine Obstipation vorliegt, da diese durch die anticholinerge Wirkkomponente dieses Medikaments verstärkt würde.
Grundsätzlich sollten die substanzspezifischen Wirkungen auf die Defäkation berücksichtigt werden: Bei Patienten mit begleitender Obstipation werden daher eher Serotonin-Wiederaufnahmehemmer SSRI empfohlen, auch wenn hier die Wirkung schlechter ist, bei Diarrhoe sollten trizyklische Antidepressiva (TCA) bevorzugt werden.
Schmerzen beim RDS können zumindest auch durch die Behandlung der anderen Symptome günstig beeinflusst werden: So kann in Einzelfällen bei Patient*innen mit Diarrhoe und Schmerzen der 5-Hydroxytryptamin(HT)-3-Antagonist Ondansetron eingesetzt werden [27, 28]. Bei begleitender Obstipation ist ein Therapieversuch mit dem Guanylatzyklasehemmer Linaclotid besonders sinnvoll, da dieses Medikament auch eine eigene schmerzlindernde Wirkung hat [29, 30].
Periphere Schmerzmittel sollten zur Behandlung der Schmerzen beim Reizdarmsyndrom nicht eingesetzt werden. Vor dem Einsatz von Opiaten wird ausdrücklich gewarnt, da bei gleichzeitig hohem Nebenwirkungs- vor allem ein Abhängigkeitsrisiko besteht. Auch Pregabalin wird in der Leitlinie nicht empfohlen, obwohl es nach neueren Daten eine therapeutische Option darstellen kann [31].
Obstipation
Bei unzureichender Wirksamkeit der o. g. allgemeinen Maßnahmen einschließlich der Optimierung der Ballaststoffzufuhr von Flohsamenschalen sollen Patient*innen mit obstipationsdominantem Reizdarmsyndrom mit Laxanzien behandelt werden, vorzugsweise mit polyethylenglykolhaltigen Trinklösungen [2, 32].
Bei unzureichendem Ansprechen steht mit Prucaloprid ein prokinetisch wirksamer 5 Hydroxytryptamin-Typ 4-Rezeptor-Agonist (5-HT4-Agonist) zur Verfügung, der zur Behandlung der laxanzienrefraktären Obstipation zugelassen ist [33, 34]. Eine dezidierte Trennung zum obstipationsdominanten Reizdarmsyndrom ist aber vielfach nicht möglich.
Linaclotid, Guanylatcyclase-C-Aktivator, wirkt nicht nur stark prosekretorisch, sondern hat darüber hinaus auch positive Wirkungen auf Schmerzen und Blähungen. Linaclotid ist in Deutschland zugelassen und verschreibungspflichtig. Die Kosten werden jedoch aktuell nicht automatisch von der GKV übernommen, sondern müssen bei den Kassen beantragt oder (meistens) von den Patientinnen und Patienten getragen werden [30, 35].
Diarrhoe
Cave: Bei Patienten mit Diarrhoe ist die intensive Differenzialdiagnostik von besonderer Bedeutung, weil bei dieser Subgruppe in deutlich mehr als der Hälfte der Fälle verursachende und teils kausal behandelbare Erkrankungen detektiert werden können.
Bei Diarrhoe kann bedarfsadaptiert Loperamid zum Einsatz kommen, wobei es dazu nur wenig unterstützende Daten für das RDS gibt. Für das antisekretorisch wirkende Racecadotril gibt es noch weniger Evidenz, aber hier kann bei gutem Nebenwirkungsprofil gelegentlich ein Therapieversuch gerechtfertigt sein [2]. Insbesondere bei wässrigen Diarrhöen ist der Einsatz von Colestyramin oder Colesevelam empfehlenswert [2, 36].
Zur modernen kombinierten Behandlung der Symptomvielfalt des RDS-D gibt es sehr überzeugende Belege für eine gute Wirksamkeit von 5-HT3-Antagonisten, wie Alosetron, Ramosetron, Cilansetron oder Ondansetron [3, 37]. Von diesen Substanzen ist einzig Ondansetron in Deutschland zugelassen, allerdings nicht für die Indikation RDS.
Cave: Vor dem Hintergrund der zwar sehr seltenen, aber potenziell schwerwiegenden Nebenwirkung einer ischämischen Kolitis ist dies nur eine Therapieoption in schweren, anderweitig therapierefraktären Fällen.
Als neue Therapieoption gilt der kombinierte μ-, δ-, Κ-Opioid-Rezeptor-Modulator Eluxadolin. Eluxadolin wirkt an μ- und Κ-Opioidrezeptoren als Agonist, an δ-Opioidrezeptoren als Antagonist. Als häufigste Nebenwirkung traten Verstopfung, Übelkeit und Bauchschmerzen auf. Schwerwiegendere Nebenwirkungen wie Pankreatitis und Krämpfe des Sphincter Oddi, des Schließmuskels des Gallengangs und des Pankreasgangs zum Zwölffingerdarm, waren deutlich seltener [3, 37].
Blähungen und abdominelle Distensionen
Abdominelle Blähungen und Distensionen sind in der klinischen Realität zum Teil schwer therapeutisch zu adressieren und belasten die Patient*innen oftmals sehr. Sie können als prädominantes Hauptsymptom auftreten oder begleitend bei vielen Patienten mit einem Reizdarmsyndrom anderen Subtyps.
Körperliche Bewegung, Ernährungstherapie und Phytotherapie haben bei starken Blähungen eine besondere Bedeutung (siehe oben). Mikrobiommodulierende Therapien sind ebenfalls bei einem Teil der Patienten erfolgreich, dies gilt nicht nur für Probiotika (siehe oben), sondern auch für das topische Antibiotikum Rifaximin. Für Rifaximin existiert eine gute Studienlage beim RDS, jedoch besteht keine Zulassung in dieser Indikation [38, 39]. Der Einsatz erfolgt ggf. „off label“.
Bei begleitender Obstipation kann die Einnahme von Linaclotid erwogen werden, da es sich es sich auch auf Blähungen günstig auswirkt (siehe oben).
Bei Blähungen können oberflächenaktive Substanzen (z. B. Dimethylpolysiloxan) versucht werden, die allerdings meist nur in höherer Dosierung effektiv sind. In therapierefraktären Fällen kann das topisch wirkende Antibiotikum Rifaximin eingesetzt werden.
| Tab. 4: Therapieoptionen beim RDS, modifiziert nach [41] | |||
| Allgemeine Verfahren im Rahmen einer multimodalen Therapie | |||
| |||
| Symptomorientierte Verfahren | |||
| Obstipation | Diarrhoe | Blähungen | Schmerzen |
|
|
|
|
Fazit
- Das RDS ist klinisch charakterisiert durch chronische, subjektiv relevante Darmbeschwerden (wie Schmerzen, Blähungen, Stuhlunregelmäßigkeiten), für die in der Routinediagnostik keine Ursache gefunden werden kann.
- Das RDS ist eine organische Erkrankung: In der Pathogenese spielen wahrscheinlich Störungen der Darmwandfunktion, der Darm-Hirn-Achse und der zerebralen Reizverarbeitung zusammen. Typischerweise liegen Veränderungen des intraluminalen Mikrobioms vor, oft auch zugrunde. Pathophysiologisch liegen zahlreiche Subtypen vor.
- Die Diagnosestellung beruht auf der charakteristischen Anamnese, dem Fehlen von Alarmzeichen und dem gezielten Ausschluss relevanter Differenzialdiagnosen. Diagnostischer „Overkill“ und insbesondere nicht indizierte Doppeldiagnostik sind zu vermeiden.
- Ziel des Behandlungskonzepts ist die Linderung der Symptome und Verbesserung der Lebensqualität. Eine Behebung der Ursache und Heilung der Erkrankung ist bislang nicht möglich.
- Vorrangiges Ziel aller Therapieoptionen ist die Symptomkontrolle und Verbesserung der Lebensqualität, wobei ernährungsmedizinische, psychoedukative, phytotherapeutische und pharmakologische Ansätze gleichermaßen wichtig sind.
- Die medikamentöse Therapie orientiert sich am vorherrschenden Symptomkomplex, wobei das individuelle Ansprechen variiert und oft mehrere Ansätze ausprobiert werden müssen, um Beschwerden zu lindern
Prof. Dr. med. Dr. oec. troph. Jürgen Stein, Klinik Innere Medizin mit Schwerpunkt Gastroenterologie, Ernährungsmedizin, Krankenhaus Sachsenhausen, Schulstraße 31, 60594 Frankfurt, E-Mail: j.stein@em.uni-frankfurt.de
Prof. Dr. med. Thomas Frieling, Medizinische Klinik II, Innere Medizin mit Gastroenterologie, Hepatologie, Neurogastroenterologie, Infektiologie, Hämatologie, Onkologie und Palliativmedizin, Helios Klinikum Krefeld, Lutherplatz 40, 47805 Krefeld, E-Mail: thomas.frieling@helios-gesundheit.de
Die Literaturangaben finden Sie hier.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Reizdarmsyndrom – eine Krankheit“ von Prof. Dr. med. Dr. oec. troph. Jürgen Stein und Prof. Dr. med. Thomas Frieling finden Sie in der PDF-Version dieses Artikels und im Mitgliederportal unter https://portal.laekh.de.
Die Teilnahme zur Erlangung von Fortbildungspunkten ist nur online über das Portal vom 25.05.2025 bis 24.11.2025 möglich. Die Fortbildung ist mit 3 CME zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Der Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autorin sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es gibt kein Sponsoring und es bestehen keine Interessenkonflikte. (red)