Prof. Dr. med. Bernd Krüger
Einleitung
Eine Nierentransplantation (NTx) gilt als „Goldstandard“ für Patienten mit einer chronischen (dialysepflichtigen) Nierenerkrankung im Stadium G5/G5D (D = Dialyse). Diese bietet neben einer signifikant verbesserten Lebensqualität auch eine deutlich verbesserte Lebenserwartung. Dennoch ist zur Aufrechterhaltung der Organfunktion eine lebenslange Immunsuppression notwendig, die eine der großen Herausforderungen in der Langzeitversorgung darstellt. Aufgrund der steigenden Gesamtzahl der durchgeführten Transplantationen, aktuell haben bereits weit mehr als 100.000 Patientinnen und Patienten in Deutschland eine Nierentransplantation erhalten bei immer besseren (Transplantat-) Überlebensraten. Derzeit liegen diese je nach Grunderkrankung und immunologischen Status teils > 93–95 % nach einem Jahr, sodass sich immer mehr Ärztinnen und Ärzte in ihrem Alltag mit transplantierten Patientinnen und Patienten konfrontiert sehen (www.DSO.de).
Das Ziel einer jeden Transplantation sowie einer anschließenden Rehabilitation ist neben der gesundheitlichen Wiederherstellung ebenfalls die Wiederherstellung einer möglichst vollständigen sozialen wie auch beruflichen Teilhabe. Die interdisziplinäre Nachsorge stellt hierbei einen Schlüsselbeitrag für den Langzeiterfolg nach Organtransplantation dar.
Ziel dieses Artikels ist, die wesentlichen Aspekte der (Langzeit-)Immunsuppression in Bezug auf das kardiovaskuläre Risiko darzulegen und potenzielle individualisierte Therapieansätze und Strategien zur Optimierung des Risikos in der Nachsorge zu erläutern.
Immunsuppressive Regime
In der Frühphase nach einer (Nieren-) Transplantation steht neben den operativen Risiken insbesondere das Risiko einer akuten Rejektion im Vordergrund der Behandlung. Daher erfolgt in den meisten Fällen intraoperativ sowie in den ersten Tagen nach Transplantation zusätzlich zur Basisimmunsuppression eine sogenannte Induktionstherapie. Dabei kommen in Abhängigkeit des immunologischen Risikos wie auch nach zentrumsabhängigen Präferenzen mono- oder polyklonale Antikörper zum Einsatz. Die Protokolle der sogenannten Basisimmunsuppression, die im Allgemeinen lebenslang eingenommen werden muss, um immunologische Abstoßungsreaktionen zu vermeiden, basieren in den allermeisten Fällen auf einer Kombination aus einem Calcineurininhibitor (Cyclosporin A bzw. in den meisten Fällen in jüngerer Zeit Tacrolimus), einem Proliferationshemmer (im Allgemeinen Mycophenolatmofetil [MMF] oder Mycophenolsäure [MFA]) sowie in den allermeisten Fällen einem Kortikosteroid. In besonderen Fällen werden auch Kombinationen mit einem mTOR-Inhibitor („mammalian target of Rapamycin“) wie Sirolimus oder Everolimus mit einem Steroid und/oder Proliferationshemmer eingesetzt. In bestimmten Situationen findet auch an Stelle der Calcineurininhibitoren ein sogenannter Co-Stimulationblocker (Belatacept) Anwendung, der als einziges derzeit regelhaft eingesetztes Immunsuppressivum intravenös verabreicht werden muss; im Langzeitverlauf muss dies alle vier Wochen erfolgen.
Insbesondere bei den Calcineurininhibitoren sowie den mTOR-Inhibitoren sollte unbedingt auf eine Interaktion mit anderen, teils auch freiverkäuflichen, Medikamenten geachtet werden [1]. Diese Interaktionen können zu einer relevanten Beeinflussung des Medikamentenspiegels führen und einerseits deutliche Spiegelanstiege mit der Entwicklung einer Toxizität, z. B. bei gleichzeitiger Gabe eines Makrolids wie Clarithromycin, und andererseits auch zu Wirkspiegelabfällen mit erhöhtem Risiko einer Transplantatabstoßung, wie beispielsweise bei gleichzeitigem Einsatz von Rifampicin oder dem freiverkäuflichen Johanneskraut, führen [1, 2].
Daher ist eine regelmäßige Spiegelkontrolle der Calcineurininhibitoren wie auch der mTOR-Inhibitoren essenziell. Hierbei hängt der angestrebte therapeutische Spiegel von verschieden Faktoren ab, wie dem transplantierten Organ, der Zeit nach erfolgter Transplantation, von der Wahl des verwendeten immunsuppressiven Protokolls, vom persönlichen immunologischen Risiko sowie von der Transplantationsvorgeschichte, d. h. gab es bereits eine oder mehrere Abstoßungsreaktionen. Daher ist es unabdingbar, einerseits den Patienten über die Ziele zu informieren, aber andererseits auch, entsprechende Informationen zeitnah an die mitbehandelnden Kolleginnen und Kollegen zu kommunizieren. Die zukünftige umfängliche Verwendung der elektronischen Patientenakte bietet hier eine gute Möglichkeit der interdisziplinären Kommunikation.
Eine Änderung der therapeutischen Ziele (Umstellung der Medikation, Änderung Zielwerte der Immunsuppression) sollte immer durch die in der Transplantationsmedizin erfahrenen Kolleginnen und Kollegen erfolgen. Im Weiteren sollte, insbesondere bei Auftreten von potenziellen Medikamentennebenwirkungen, regelhaft niederschwellig Kontakt mit dem Transplantationszentrum aufgenommen werden, um eine entsprechende Umstellung bzw. Senkung der Immunsuppression zu ermöglichen. In Tab. 3 finden sich die gebräuchlichsten Immunsuppressiva mit deren häufigsten Nebenwirkungen aufgeführt.
| Tab. 3: Einfluss der verschiedenen Immunsuppressiva auf „traditionelle“ Risikofaktoren (adaptiert aus [10]). | ||||||
| Adverse effect | Steroide | CsA Cyclosporin A | Tac Tacrolimus | mTORi mTOR- Inhibitoren | MMF Mycophenolat mofetil | Belatacept |
| Post-transplant DM | ↑ | ↑ | ↑↑ | ↑ | ||
| Hypercholesterienämie | ↑ | ↑ | (↑) | ↑↑ | ||
| Hypertonie | ↑↑ | ↑↑ | ↑ | ↑ | ||
| Osteoporose | ↑↑ | ↑ | (↑) | |||
| Anämie und Leukopenie | ↑ | ↑ | ↑ | |||
| Wundheilungsstörung | ↑ | |||||
| Diarrhoe, Übelkeit/Erbrechen | ↑ | ↑↑ | ||||
| Proteinurie | ↑↑ | |||||
| GFR-Verschlechterung | ↑ | ↑ | ||||
Die Kunst in der Langzeitimmunsuppression besteht darin, die potenziellen Langzeitkomplikationen im Zuge einer individualisierten Langzeittherapie zu minimieren.
Typische Nebenwirkungen beinhalten die Nephrotoxizität, die Neurotoxizität sowie diabetogene Nebenwirkungen, insbesondere bei der Verwendung der Calcineurininhibitoren Cyclosporin und Tacrolimus. Proliferationshemmer wie Mycophenolatmofetil oder Mycophenolsäure zeigen häufiger Diarrhoen und/oder eine klinisch relevante Knochenmarksdepression mit Leukopenie und teilweise eine Thrombopenie. Zu Beginn des Verlaufs nach Transplantation zeigen sich insbesondere Infektionen viraler, bakterieller oder opportunistischer Natur als häufigste Folge der Immunsuppression. Nach Reduktion der Immunsuppression im Verlauf treten zunehmend metabolische und/oder kardiovaskuläre Risiken in den Vordergrund. Im Weiteren kommen im Langzeitverlauf zusätzlich Malignome, hier sind vor allem nicht-melanozytäre Hauttumore von Bedeutung, als Folge einer (intensiven) Immunsuppression hinzu. Führt man sich vor Augen, das mindestens 50 % der Organverluste aufgrund eines kardiovaskulären Ereignisses eintreten, sollte hier ein besonderes Augenmerk in der Langzeitversorgung dieser Patientinnen und Patienten liegen.
Kardiovaskuläres Risiko unter Immunsuppression nach Nierentransplantation
Nach einer Nierentransplantation unterscheidet man verschiedene Risikofaktoren, die im Allgemeinen in traditionelle oder nicht-traditionelle eingeteilt werden (Tab. 1 und 2) [3–5]. Neben den traditionellen (klassischen) Risikofaktoren, die in gleicher Weise für die Allgemeinbevölkerung gelten, finden sich insbesondere in der Population der (nieren-)transplantierten Patienten sogenannte nicht-traditionelle Risikofaktoren. Zunehmend findet auch die chronische Nierenkrankheit (CKD) zusammen mit der Albuminurie, gemessen als Urin-Albumin-Kreatinin-Ratio (UACR), Eingang als nicht-klassischer Risikofaktor [6, 7]. Daher sollte bei (nieren-)transplantierten Patienten immer ein ganzheitlicher Ansatz Vorrang haben, wobei in der spezifischen Therapie der einzelnen Risikofaktoren nur wenig Unterschied zur Allgemeinbevölkerung besteht.
| Tab. 1: Traditionelle kardiovaskuläre Risikofaktoren |
• Arterielle Hypertonie • Hypercholesterienämie • Diabetes mellitus • linksventrikuläre Hypertrophie • Adipositas • Nikotinabusus • positive Familienanamnese |
| Tab. 2: Nicht-traditionelle kardiovaskuläre Risikofaktoren |
• „eingeschränkte“ Nierenfunktion per se • Störungen des Kalzium/Phosphatstoffwechsels ○ Hyperkalzämie ○ Hyperphosphatämie • Proteinurie • Immunsuppression • Adipositas (BMI > 30) • akute Rejektionen • geringe körperliche Aktivität • Dialysedauer vor NTx • „Mikroinflammation“ |
Risikomanagement
Der erste Schritt bzw. die erste Herausforderung des Risikomanagements nierentransplantierter Patienten beginnt schon vor Eintritt einer chronischen dialysepflichtigen Nierenkrankheit. Basierend auf Daten des United States Renal Data System (USRDS) wurde gezeigt, dass das kardiovaskuläre Überleben nach zehn Jahren bereits dadurch signifikant vermindert war, wenn ein Patient oder Patientin erst nach einer sechsmonatigen Dialysepflichtigkeit transplantiert wurde, im Gegensatz zu Patientinnen oder Patienten, die eine präemptive, das heißt vor Eintritt einer Dialysepflicht, Transplantation erhalten haben. Daher sollte die Minimierung des kardiovaskulären Risikos bereits vor Eintritt einer Dialysetherapie beginnen und eine präemptive Transplantation thematisiert werden [4]. Eine Transplantation kann das kardiovaskuläre Risiko im Vergleich zur Dialysetherapie auf unterschiedliche Weise senken, so dass diesbezüglich eine Transplantation nach Möglichkeit immer zu favorisieren ist [8].
Die chronische Nierenkrankheit, d. h. eine eingeschränkte Nierenfunktion mit einer eGFR < 60 ml/min/1.73 m2 und/oder einer Albuminurie (UACR ≥ 30 mg/g), ist nicht nur in der Allgemeinbevölkerung, sondern insbesondere bei Patienten und Patientinnen mit einer Nierentransplantation ein besonderer kardiovaskulärer Risikofaktor [9]. Daher ist ein besonderes Augenmerk nicht nur zur Senkung des kardiovaskulären Risikos, sondern verständlicherweise auch zum Erhalt der Organfunktion auf die Nierenfunktion inklusive der UACR zu legen [4, 5]. Daher kann die Auswahl bzw. die Intensität der eingesetzten Immunsuppression neben dem Erhalt der Organfunktion einen wichtigen Beitrag bzgl. positiver oder negativer Effekte auf die kardiovaskuläre Morbidität und Mortalität haben (Tab. 3). Obwohl es häufig im Sinne einer Reduktion des kardiovaskulären Risikos oder aufgrund medikamentenassoziierter Nebenwirkungen günstig wäre, die Medikation zu verändern, sollte dies nur in Zusammenschau der gesamten Krankheitsgeschichte in enger Zusammenarbeit mit dem Transplantationszentrum erfolgen.
Ziel, aber auch gleichzeitig eine der größten Herausforderungen, ist die nachhaltige Beeinflussung der veränderbaren Risikofaktoren.
Eine bestehende bzw. eine sich nach Transplantation entwickelnde arterielle Hypertonie findet sich je nach Publikation mit einer Prävalenz von 50–90 %, und ist damit einer, wenn nicht sogar der wichtigste, beeinflussbare Risikofaktor nach einer Nierentransplantation, der trotz Medikation meist nicht adäquat eingestellt ist [5, 11]. Nicht nur die kardiovaskuläre Morbidität und Mortalität ist mit einem erhöhten Blutdruck wie auch dem daraus resultierende Pulsdruck assoziiert, sondern es geht auch ein verkürztes Organüberleben damit einher [11].
Leider existieren keine Studien, die prospektiv einen idealen Zielblutdruck untersucht haben, aber vielfältige Untersuchungen konnten eine entsprechende Assoziation vergleichbar mit der Normalbevölkerung zeigen [12].
Aktuelle Leitlinien wie die KDIGO 2021 [12] oder die ESH 2023 [13] empfehlen einen Zielblutdruck nach Nierentransplantation von < 130/80 mmHg, klinische Endpunktstudien liegen hierzu jedoch nicht vor [12, 13]. Wichtig hierbei ist zu beachten, dass der Blutdruck unter den üblichen Standardbedingungen gemessen werden sollte.
Welche Blutdruckmedikation sollte in dieser Situation verwendet werden?
Hier stellt sich insbesondere die Frage, ob eine RAAS-Inhibition (Renin-Angiotensin-Aldosteron-System) mit einem ACE-Inhibitor oder einem AT1-Antagonisten ähnliche Vorteile wie in einem nicht transplantierten Kollektiv zeigen. Es wurden vergleichende Studien bzgl. einer favorisierten Substanz begonnen, diese wurden aber allesamt frühzeitig, ohne dass ein belastbares Ergebnis gefunden wurde, abgebrochen. Letztlich werden Dihydropyridin-Kalzium-Kanal-Blocker oder AT1-Rezeptorenblocker für die Erstlinientherapie vorgeschlagen (Empfehlungsgrad 1C) [12, 14].
Aufgrund ihrer kardialen Vorteile sollte aber eine RAAS-Inhibition bei den meisten nierentransplantierten Patientinnen und Patienten zum Einsatz kommen. Der genaue Zeitpunkt, wann eine solche Therapie gestartet werden sollte, ist regelmäßig Gegenstand kontroverser Diskussionen. Festzuhalten gilt, dass spätestens nach Erreichen einer stabilen Nierenfunktion eine entsprechende Therapie ohne weiteres begonnen werden kann [15]. Wie in der Allgemeinbevölkerung gilt bei (nieren-) transplantierten Patientinnen und Patienten, dass eine Bewertung der bestehenden Risikofaktoren vor der Wahl der Medikation erfolgen sollte.
In älteren Untersuchungen wurde der Einfluss der immunsuppressiven Therapie auf die Entwicklung bzw. den Unterhalt einer arteriellen Hypertonie adressiert. Obwohl in älteren Arbeiten aus den 1990er-Jahren ein Einfluss der Steroide auf den Blutdruck gesehen wurde, konnte dieser in späteren Studien nicht bestätigt werden. Daher zählt heutzutage eine (niedrige) Steroidtherapie nicht zu den „Haupt“-Risikofaktoren bzgl. der Entwicklung eines Bluthochdrucks [16–19].
Seit langem ist auch bekannt, dass Calcineurin-Inhibitoren (CNI), Cylcosporin A etwas mehr als Tacrolimus, eine Hypertonie begünstigen können. Immer wieder wurde auch in diesem Zusammenhang eine Minimierungsstrategie oder eine Umstellung zu einem mTOR-Inhibitor diskutiert. In einer Cochrane-Analyse aus dem Jahre 2017 konnte in diesem Zusammenhang kein Benefit einer solchen Umstellung gefunden werden [20]. Im Weiteren kann auch eine komplett CNI-freie Therapie im Einzelfall diskutiert werden. Diese zeigt durchaus positive Effekte bzgl. des Blutdruckes, ist bzw. kann aber wiederum mit einem erhöhten Risiko einer akuten Rejektion vergesellschaftet sein.
Eine weitere Option, auf eine CNI-haltige Therapie zu verzichten, stellt Belatacept dar, ein Co-Stimulationsblocker, der alle vier Wochen intravenös gegeben werden muss, und mit einer geringeren Hypertonieneigung vergesellschaftet ist [21]. Protokolle existieren neben der de novo Therapie ebenfalls für eine Umstellung bei stabiler Transplantatfunktion [22].
Neben der arteriellen Hypertonie als wichtigem „traditionellen“ Risikofaktor findet sich eine Hypercholesterinämie bei nahezu jeder Patientin oder Patienten, insbesondere wenn ein LDL-Cholesterin-Ziel < 100 mg/dl (2.6 mmol/l) angesetzt wird. Wichtig zu beachten ist, dass bei den meisten transplantierten Patientinnen und Patienten ein LDL-Cholesterin-Zielwert < 70 mg/dl (1.8 mmol/l) oder < 55 mg/dl (1.4 mmol/l) anzustreben ist [23, 24].
Die tägliche Praxis zeigt jedoch, dass nur ein sehr geringer Anteil der (nieren-) transplantierten Patientin und Patienten diese Therapieziele ohne eine lipidsenkende Therapie wird erreichen können. Die ALERT-Studie konnte bereits Anfang der 2000er-Jahre zeigen, dass eine LDL-Senkung eine einfache und effektive Maßnahme darstellt, um bei dieser Patientengruppe das kardiovaskuläre Risiko zu senken [25]. Die Therapie mit Fluvastatin führte zu einer Risikoreduktion bzgl. Auftreten eines Myokardinfarktes oder kardialen Todes nach fünf Jahren von 35 % [25]. Hieraus resultierte folgerichtig die Empfehlung zur Statinbehandlung nach Transplantation [23].
Welches LDL-Ziel bei diesem Patienten anzustreben ist, ist weniger gut untersucht. Folgt man den aktuellen ESC-Leitlinien, fallen die meisten Patientinnen und Patienten aufgrund der im Allgemeinen eingeschränkten eGFR in die Gruppe mit hohem (LDL-Zielwert < 70 mg/dl (1.8 mmol/l) oder sehr hohem Risiko mit einem LDL-Zielwert < 55 mg/dl (1.4 mmol/l) [6, 24].
Kommen nun noch die transplantatspezifischen Risikofaktoren hinzu, müssen die Patienten auch ohne Hinzunahme der eGFR in eine dieser beiden Gruppen kategorisiert werden. Bekanntermaßen lässt sich über diätetische Maßnahmen lediglich eine LDL-Senkung maximal um etwa 10–15 % erreichen, so dass primär am wichtigsten erscheint, dass alle transplantierten Patientinnen und Patienten zumindest ein Statin erhalten. Hilfreich ist auch die Hinzunahme von Risikoscores, wie beispielsweise der SCORE2+CKD, um ein individuelles Risiko zu bestimmen [7].
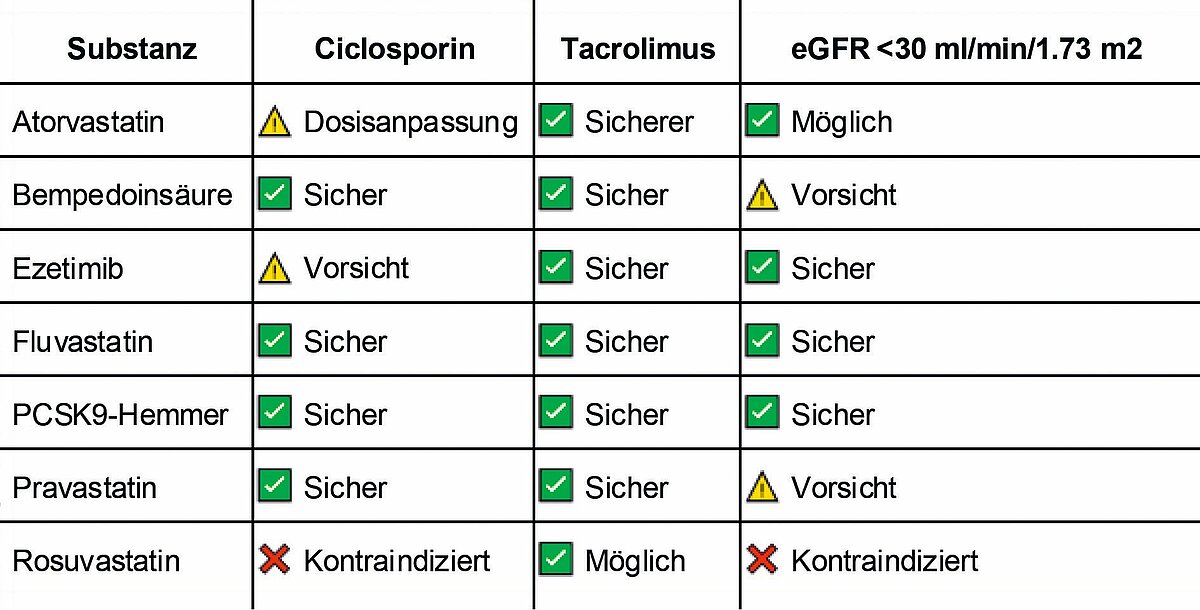
Wurden traditionell in den Transplantationszentren das Pravastatin sowie das Fluvastatin aufgrund ihres CYP P450 3A/4 unabhängigen Eliminationsweg fast ausschließlich eingesetzt, die Calcineurininhibitoren werden durch dieses Enzymsystems metabolisiert, finden das deutlich potentere Rosuvastatin (ca. 55–60 % LDL-Reduktion) sowie das Atorvastatin (ca. 50–55 % LDL-Reduktion) zunehmend Verbreitung, da beide Substanzen entweder über einen unterschiedlichen Abbauweg (Rosuvastatin) metabolisiert werden oder andererseits nur eine geringe Interaktion (Atorvastatin) aufweist. Es muss aber beachtet werden, dass unter einer cyclosporinbasierten Therapie deutlich erhöhte Rosuvastatinspiegel zu verzeichnen sind, daher ist eine entsprechende Gabe nicht empfohlen. Weiterhin muss beachtet werden, dass in Deutschland formal die Anwendung von Rosuvastatin bei einer eGFR < 30 ml/min/1.73 m2 nicht empfohlen wird bzw. kontraindiziert ist. Hier bietet sich dann, insbesondere bei einer Tacrolimus-basierten Therapie, das Atorvastatin als Alternative an, das vor allem durch Cyclosporin in seinem Abbau gehemmt wird. Häufig wird aber eine Kombinationstherapie verschiedener lipidsenkender Medikamente notwendig sein. Hier steht das Ezetimib an erster Stelle, das aber in seinem Abbau durch Cyclosporin gehemmt wird, und daher in dieser Kombination ebenfalls nicht empfohlen wird. Die weiteren gängigen Lipidsenker wie PCSK9-Hemmer bzw. die PCSK9-Translationshemmer sowie die Bempedoinsäure können im Rahmen der Transplantation eingesetzt werden, da keine Interaktionen mit den gängigen Immunsuppressiva vorhanden sind. Jedoch ist auch hier zu beachten, dass die Bempedoinsäure formal bei einer eGFR < 30 ml/min/1.73 m2 nicht empfohlen wird sowie die PCSK9 Inhibitoren/Translationshemmer einer Verordnungseinschränkung unterliegen. Fibrate sollten, wie auch in der Allgemeinbevölkerung, nur Ausnahmefällen vorbehalten bleiben. (vgl. Tab. 4)
Ein weiterer wichtiger und auch beeinflussbarer Risikofaktor nach Transplantation ist der Diabetes mellitus, vor allem der, der erst nach einer stattgehabten Transplantation auftritt oder apparent wird. Die Benennung eines solchen variierte in den vergangenen Jahren und wird heute, da ein Diabetes mellitus bei vielen Patienten an der Dialyse inapparent bleibt, als Posttransplantation Diabetes Mellitus (PTDM) bezeichnet. Pathophysiologisch liegt eine Betazelldysfunktion +/- eine periphere Insulinresistenz vor [10]. Die Häufigkeit eines PTDM variiert in der Literatur aufgrund der verschiedenen Definitionen und der unterschiedlichen Nachsorgestrategien stark und reicht bis zu 30 % [26, 27]. Auffällig hierbei ist die stetige Abnahme der Inzidenz in jüngerer Zeit [28].
Die Diagnose und Therapie eines PTDM stellen die Behandelnden immer wieder vor Herausforderungen. Gerade die transiente medikamentös induzierte Hyperglykämie, die häufig in der Frühphase nach Transplantation auftreten kann, ist nicht immer problemlos von einem manifesten PTDM zu unterscheiden. Wichtig hierbei zu wissen ist, dass in den ersten Monaten nach Transplantation der HbA1c als Marker eines Diabetes mellitus und somit eines PTDM nur eingeschränkt nutzbar ist [29]. In der Frühphase nach Transplantation wird unter Verwendung des HbA1c das Vorhandensein einer PTDM unterschätzt. Erst nach ca. neun bis zwölf Monaten kann dieser, bei stabiler Transplantatfunktion und Stabilisierung der Erythropoese, wieder valide eingesetzt werden. Daher spielen in der Frühphase weitere Screeningteste wie regelmäßige Blutzuckermessungen oder ein oraler Glukosetoleranztest eine große Rolle [10, 29].
Wie sollte nun ein PTDM therapiert werden?
Wenn man sich die verschiedenen Nebenwirkungsprofile der Immunsuppressiva betrachtet (Tab. 3), wäre eine spezifische Auswahl bzw. Verzicht einer bestimmten immunsuppressiven Therapie mit einer Verbesserung eines bestehenden bzw. ein geringeres Auftreten eines PTDM möglich. Zuallererst erscheint der Verzicht bzw. das Absetzen der Steroide ein guter Ansatzpunkt zur Vermeidung oder Verbesserung eines PTDM. In der multizentrischen Harmony-Studie wurde unter anderem ein frühes und rasches Ausschleichen der Steroide mit einem Standardregime verglichen. Hierbei kam es zu einer signifikanten Reduktion eines PTDM nach zwölf Monaten [30].
Neben der Vermeidung der Steroide könnte auch der reduzierte Einsatz oder auch die Vermeidung pro-diabetogener Immunsuppressiva unabhängig von den Steroiden eine Option darstellen. Hier kann auf verschiedene Konversionsstudien (HERAKLES, ZEUS) zurückgegriffen werden, bei denen der CNI gegen Everolimus ausgetauscht worden ist. Interessanterweise traten hier nach einem Jahr keine signifikanten Unterschiede bzgl. des Auftretens eines PTDM auf [31].
Neben einer Konversion zu Everolimus kann auch der Umstieg von Tacrolimus, das eine deutlich höhere diabetogene Potenz als Cyclosporin besitzt, positive Effekte bringen, wie sich in einer kleinen Studie zeigen ließ [32]. Vergleichbare Vorteile scheint es bei Einsatz von Belatacept zu geben [33]. Für die Wahl des immunsuppressiven Regimes gilt am Ende aber, dass das beste Patienten- und Organüberleben erreicht wird, unabhängig vom Risiko eines PTDM [29].
Die weitere Therapie umfasst prinzipiell alle bekannten Optionen unter Berücksichtigung der spezifischen Kontraindikationen, insbesondere bei eingeschränkter Nierenfunktion. Bei diskordanten Ergebnissen zweier Screeningtests sollte immer der pathologische Wert erneut bestimmt werden, so dass die gleichen Therapiegrundsätze wie für jeden anderen Diabetes mellitus gelten [34]:
- Lebensstiländerung mit körperlicher Bewegung (nach KDIGO 5 x 30 min/ Woche)
- Diabetes- und Ernährungsberatung bzw. -schulung
- Medikamentöse Therapie
Die medikamentöse Therapie umfasst die seit Jahren bekannten und sicher einsetzbaren (oralen) Antidiabetika wie Metformin, DDP-4-Inhibitoren, GLP-1-Rezeptor-Agonisten oder die verschiedenen Insuline. Zunehmend haben auch die SGLT2-Inhibitoren immer mehr an Bedeutung gewonnen, nicht nur in der Behandlung eines PTDM. Die teils drastische Risikoreduktion kardiovaskulärer Ereignisse wie auch für die Progression einer diabetischen Nephropathie haben auch den Einsatz in der (Nieren-) Transplantation gefördert [35, 36]. Bisherige Daten aus einer retrospektiven Kohortenstudie zeigen erfolgversprechende Überlebensvorteile, aber erst mit Abschluss der renal lifecycle study werden randomisierte Daten vorliegen [37, 38].
Zusammenfassung
Das kardiovaskuläre Risiko nach Langzeitimmunsuppression nach Nierentransplantation stellt die Behandler immer wieder vor Herausforderungen, um gesteckte Behandlungsziele erreichen zu können. Diese sind mit denen in der Normalbevölkerung hinsichtlich klassischer Risikofaktoren vergleichbar. Von den verfügbaren Antihypertensiva sollen insbesondere RAAS-Blocker und Dihydropyridin-Kalziumantagonisten Verwendung finden. Als lipidsenkende Therapie sollten vorzugsweise Statine wie Fluvastatin, Rosuvastatin und Atorvastatin zum Einsatz kommen. Aufgrund ihres günstigen kardiovaskulären Profils werden GLP-1-Agonisten und SGLT-2 Hemmer auch zunehmend interessant bei Patienten mit einem Diabetes mellitus nach einer Transplantation.
Änderungen des immunsuppressiven Regimes, die das kardiovaskuläre Risiko grundsätzlich positiv beeinflussen könnten, müssen immer bzgl. des möglichen Auftretens potenzieller Nebenwirkungen wie eine akute Rejektion abgewogen werden und sollten nur in Absprache mit dem federführendem Transplantationszentrum initiiert werden.
Prof. Dr. med. Bernd Krüger, MHBA, Medizinische Klinik III, Klinikum Darmstadt
Die Literaturhinweise finden Sie hier.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Nach Nierentransplantation: Kardiovaskuläres Risiko unter Langzeitimmunsuppression“ von Prof. Dr. med. Bernd Krüger finden Sie hier abgedruckt und im Mitgliederportal (https://portal.laekh.de) sowie auf den Online-Seiten des Hessischen Ärzteblattes (www.laekh.de).
Die Teilnahme zur Erlangung von Fortbildungspunkten ist nur online über das Portal vom 25.06.2025 bis 24.12.2025 möglich. Die Fortbildung ist mit 3 CME zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Der Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben des Autors sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es gibt kein Sponsoring und es bestehen keine Interessenkonflikte. (red)