Prof. Dr. med. Marion Haubitz
Vaskulitiden sind seltene Erkrankungen, die durch einen Entzündungsprozess in den Blutgefäßen gekennzeichnet sind, wobei die Art und Lokalisation der befallenen Gefäße die Symptomatik bestimmt, sodass hier eine interdisziplinäre Betreuung der Patientinnen und Patienten wichtig ist. Die Nieren können bei fast allen Vaskulitiden betroffen sein und führen über eine Biopsie nicht selten zur Diagnose.
Die ANCA-assoziierten Vaskulitiden (AAV) sind systemische nekrotisierende Vaskulitiden mit überwiegendem Befall kleiner Gefäße (Arteriolen, Venolen und Kapillaren), die häufig mit antineutrophilen zytoplasmatischen Antikörpern (ANCA) assoziiert sind. Dabei werden in der Immunfluoreszenz mit alkoholfixierten Neutrophilen c-ANCA (zytoplasmatische Fluoreszenz) von p-ANCA (perinukleäre Fluoreszenz) unterschieden. Im ELISA finden sich bei den c-ANCA meist Antikörper
gegen Proteinase 3 (PR3-ANCA), bei den p-ANCA meist gegen Myeloperoxidase (MPO-ANCA).
In der Histologie finden sich nur spärlich Immunglobuline (pauci-immun). Zu den AAV gehören die
- Granulomatose mit Polyangiitis (GPA)
- Mikroskopische Polyangiitis (MPA)
- Eosinophile Granulomatose mit Polyangiitis (EGPA)
- Renal limitierte AAV, als „single-organ AAV“ bezeichnet.
In jüngerer Zeit haben sich die therapeutischen Möglichkeiten enorm entwickelt, und die Prognose der Patienten hat sich weiter gebessert.
Diagnose
Bei den AAV ist weiterhin der wichtigste Faktor, an eine Vaskulitis zu denken, insbesondere, wenn unterschiedliche Organsysteme betroffen sind. Auch unspezifische Allgemeinsymptome wie Abgeschlagenheit, Fieber, Nachtschweiß und Gewichtsverlust treten auf. Als Suchtest ist heute zunächst der anti-MPO- bzw. anti-PR3-ELISA zu empfehlen [1]. Prinzipiell kann jedes Organ betroffen sein [2], vgl. Tab. 1.
| Tab. 1: Klinische Manifestation [2] | ||||
| Organsystem | GPA [%] n=184 | MPA [%] n=167 | EGPA [%] n=99 | Alle Patienten [%] n=450 |
| Fieber | 52 | 52 | 55 | 53 |
| Niere | 56 | 86 | 32 | 62 |
| Lunge | 63 | 43 | 60 | 55 |
| HNO | 72 | 10 | 53 | 45 |
| Haut | 25 | 17 | 37 | 25 |
| Muskel/Gelenke | 58 | 46 | 53 | 56 |
| Mononeuritis multipl. Sens. peri. Neuropathie | 13 10 | 11 17 | 39 17 | 18 14 |
| ZNS | 6 | 5 | 2 | 5 ** |
| Auge/Orbita | 24 | 4 | 10 | 13 |
| Herz | 11 | 11 | 20 | 13 |
| Gastrointestinaltrakt | 5 | 5 | 2 | 4 |
| ** Manifestation sicher unterschätzt (MRT zeigt häufiger Veränderungen) | ||||
Im Folgenden soll der Schwerpunkt auf der Nierenmanifestation liegen. Es findet sich meist ein rascher Nierenfunktionsverlust (bis zur Dialyse) innerhalb weniger Wochen und Monate zusammen mit einem positiven Protein- und Hb-Nachweis im Urinstatus. Das Sediment zeigt Erythrozyten (oft dysmorph, klassischerweise Akanthozyten) und Zylinder (typisch Erythrozytenzylinder) (nephritisches Sediment). Bei der EGPA ist die renale Beteiligung häufig mit einem ANCA-Nachweis assoziiert. Ohne renale Manifestation sind bei der EGPA die ANCA fast immer negativ.
Bei der Diagnostik und der Differenzialdiagnose (z. B. anti-GBM-Nephritis, Lupusnephritis, postinfektiöse Glomerulonephritis, Kryoglobulinämie, systemische Infektionen) steht neben den Antikörperbestimmungen die Nierenbiopsie ganz im Vordergrund. Sie ist in allen Fällen anzustreben, da nicht einmal die beschriebenen Urinveränderungen mit einem positiven ANCA die Diagnose sichern (Beispiel: Endokarditis mit Immunkomplex-Glomerulonephritis und positivem PR3-ANCA). Darüber hinaus liefert sie Hinweise für die Prognose (Zahl der nicht befallenen Glomeruli sowie Tubulusatrophie und interstitielle Fibrose) [3, 4]. Dabei sollte der Behandlungsbeginn (vor allem die Steroidgabe) nicht durch das Warten auf die Histologie verzögert werden. Besonders dramatisch ist ein pulmorenales Syndrom (pulmonale Hämorrhagie und AKI – 15 % bei GPA und 26 % bei MPA [2]), bei dem die AAV die häufigste Ursache darstellt. Bei dieser lebensbedrohlichen Manifestation ist der sofortige Therapiebeginn entscheidend.
Folgende Laborparameter sollten bestimmt werden: Kreatinin, Harnstoff, Harnsäure, sämtliche Elektrolyte, Urinstatus und -sediment sowie Proteinurie in mg/g Kreatinin. Zur Einordnung des Grades der Funktionseinschränkung sollten eGFR und eine Cystatin-C-GFR berechnet werden. Bei eingeschränkter Nierenfunktion sind auch venöse Gase, PTH und Vitamin D erforderlich. Eine Nierensonografie darf nicht fehlen.
Ein Differenzialblutbild und ein CRP zur Erfassung der Entzündungsaktivität sind unerlässlich und meist auch ein Procalcitonin zum Ausschluss einer bakteriellen Infektion. Blutzucker, Leberwerte einschließlich der Hepatitisserologie und Lipase sind vor der immunsuppressiven Therapie wichtig.
Die weitere Basisdiagnostik sollte immer die häufig befallenen Organe umfassen:
- Lunge bei allen AAV; wobei ein CT eine wesentlich höhere Sensitivität und Spezifität im Vergleich zur konventionellen Thoraxaufnahme hat
- peripheres und zentrales Nervensystem klinisch bei allen AAV
- HNO bei GPA und EGPA
- Herz bei EGPA.
Weitere Untersuchungen richten sich nach den betroffenen Organen.
Nierenhistologie
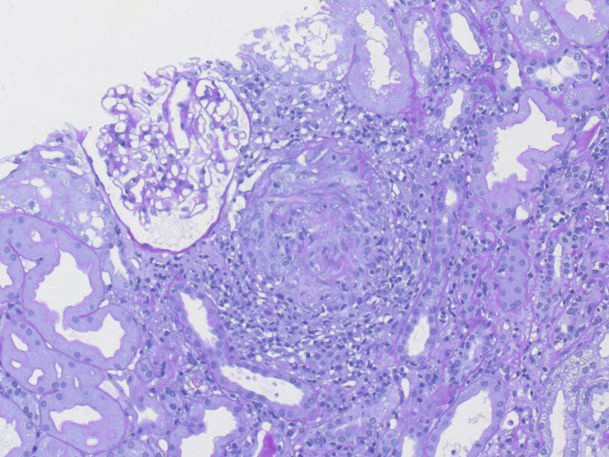
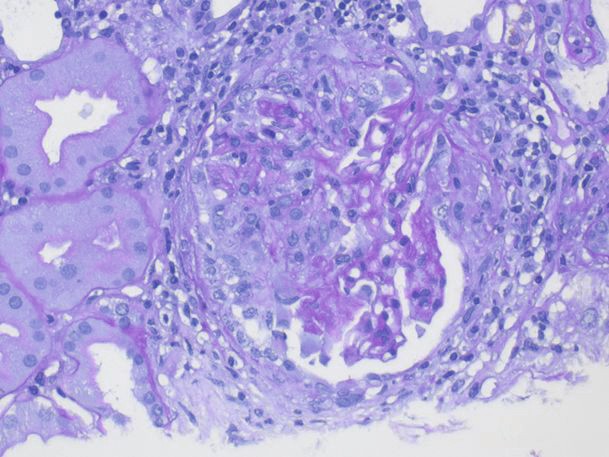
In der Histologie findet man eine nekrotisierende extrakapillär proliferative (= halbmondbildende) Glomerulonephritis (siehe Abb. 1) und keine oder nur spärliche Immunglobulinablagerungen in der Immunhistologie (wichtig zur Abgrenzung gegenüber der anti-GBM-Nephritis oder einer Immunkomplexnephritis z. B. beim SLE). Auch bei der GPA werden nur sehr selten Granulome in der Niere angetroffen. Hierfür sind der HNO-Trakt und gegebenenfalls bei Rundherden die Lunge das Zielorgan.
Induktionstherapie
Therapieziel ist das Erreichen einer kompletten Remission und deren Erhaltung mit möglichst wenigen Nebenwirkungen. Zur Remissionsinduktion bei organ- oder lebensbedrohlicher MPA oder GPA, wie es eine AAV mit Nierenbeteiligung darstellt, sollen Glucocorticoide mit Rituximab (RTX) oder Cyclophosphamid (CYC) kombiniert werden. Vor allem bei einem Rezidiv und bei jungen Patienten zum Fertilitätserhalt sowie bei reduzierter Knochenmarks-Reserve sollte RTX bevorzugt werden [5, 6].
Patienten mit einer aktiven Hepatitis B dürfen kein RTX erhalten. Kombinationen von RTX und CYC wurden vereinzelt bei kleinen Patientengruppen vor allem mit schwerer Nierenbeteiligung verwendet. Bezüglich der Steroiddosis wird heute meist eine raschere Reduktion gewählt [5].
Cyclophosphamid i.v.
750 mg/m2 alle drei bis vier Wochen für drei bis sechs Monate je nach Erreichen der Remission
(500 mg/m2 bei Niereninsuffizienz Stadium IV-V oder Alter > 70 Jahre)
oder
15 mg/kg, drei Gaben in zwei-, dann in dreiwöchentlichem Abstand (meist sechs Gaben)
(12,5 mg/kg bei Niereninsuffizienz Stadium IV-V oder Alter > 60 Jahre)
Beide mit evtl. späterer Anpassung bzgl. Effekt, Nebenwirkungen, Leukozyten.
Rituximab i.v.
4 x 375 mg/m2 in wöchentlichem Abstand (Zulassungsstudie) [5]
oder
2 x 1 g in zweiwöchentlichem Abstand (formal off-label)
Siehe weiterhin auch das Steroidschema (Tab. 2).
| Tab. 2: Steroidschema (> 75 kg) 3 Tage i. v. 250–500 mg Methylprednisolon | |
| 75 mg | Woche 1 |
| 40 mg | Woche 2 |
| 30 mg | Woche 3 |
| 30 mg | Woche 4 |
| 25 mg | Woche 5 |
| 25 mg | Woche 6 |
| 20 mg | Woche 7/8 |
| 15 mg | Woche 9/10 |
| 12,5 mg | Woche 11/12 |
| 10 mg | Woche 13/14 |
| 7,5 mg | Woche 15/16 |
| 5 mg | Monate 7–12 |
| Im 2. Jahr Steroid ausschleichen | |
Bei raschem Kreatininanstieg mit Werten > 300 µmol/l sollten zusätzlich Plasmapheresen erwogen werden [6] je nach Blutungsrisiko mit einer Citrat-Antikoagulation bzw. eine Behandlung gegen FFP bzw. FFP/Albumin.
Bei schweren alveolären Hämorrhagien werden als Rescuetherapie auch Plasmapheresen eingesetzt. Alternativ oder zusätzlich wurden hier positive retrospektive Ergebnisse einer Avacopantherapie bei kleinen Patientengruppen (n = 7–15) berichtet [7–9].
Avacopan, ein selektiver C5a-Rezeptor-Inhibitor, ist in Deutschland seit 2022 zur adjuvanten Therapie bei schwerer AAV zur Einsparung von Steroiden zusätzlich zu RTX oder CYC zugelassen. Basis ist eine randomisierte kontrollierte Studie [10], wobei im Avacopanarm die Remissionrate nach 52 Wochen höher als im Plazeboarm war, allerdings wurde das Steroid im Plazeboarm nach der 20. Woche beendet. Im Avacopanarm erholte sich die Nierenfunktion besser, besonders bei Patienten mit einer GFR < 20 ml/min. Eine bessere GFR-Erholung beschreiben auch Real-World-Erfahrungen bei Patienten mit einer GFR unter 15 ml/min, die in der Studie ausgeschlossen waren [11]. Erfahrungen mit größeren Patientinnen- und Patientengruppen und Langzeitdaten fehlen.
Auch MMF wurde zur Induktion in einer randomisierten Studie eingesetzt [12], allerdings mit mehr Rezidiven im Vergleich zu CYC, sodass es nicht als Erstlinientherapie empfohlen werden kann.
Supportive Therapie
Bei allen Patienten empfiehlt sich ein Magenschutz, eine Osteoporose- und Candidaprophylaxe sowie Cotrim v.a. zur Verhinderung einer Pneumocystis jirovecii Pneumonie (bei Unverträglichkeit Pentamidin-Inhalation). Bei CYC-Pulsen sollte neben einer Volumengabe MESNA zum Blasenschutz (bei Dialyse bzw. Diurese < 1l nicht sinnvoll) und ein Antiemetikum (Serotonin-Antagonist) gegeben werden. Bei jungen Patienten muss die dosisabhängige Gonadentoxizität beachtet werden (evtl. Spermien- bzw. Eizellkonservierung). Oral wird CYC aufgrund höherer Toxizität kaum noch gewählt. Vor RTX sind 100 mg Methylprednisolon und ein H1-Antihistaminikum indiziert.
Therapie zur Remissionserhaltung
Die Hälfte der Patienten entwickelt ein Rezidiv. Risikofaktoren sind eine GPA, ein PR3-ANCA, ein frühes Steroidende und eine geringere CYC-Gesamtdosis bzw. eine kürzere Therapiedauer (weniger Immunsuppression = höheres Rezidivrisiko). Auch ein positiver PR3-ANCA beim Übergang auf eine Erhaltungstherapie erhöht das Risiko, ebenso eine gute Nierenfunktion (Review [13]).
Nach RTX erfordern nicht nur wiederkehrende CD-20-Zellen und ein ANCA-Anstieg eine erhöhte klinische Aufmerksamkeit, sondern möglicherweise auch bestimmte B-Zell-Gruppen bei der Repopulation. Für die Nieren könnten Urinmarker (CD163, MCP-1, T-Zellen oder eine persistierende Hämaturie) hilfreich sein [13]. Für die Zukunft sind Risikostratifizierungen mit unterschiedlichen Therapien zu erwarten. Schon heute sind Rezidive bei AAV-Erkrankten, die nach Induktion konstant negativ für MPO-ANCA getestet werden, sehr selten, sodass hier ein „Watchfull waiting“ möglich erscheint [14]. Darüber hinaus können geschulte Patientinnen und Patienten häufig früh erste Zeichen eines Rezidivs erkennen.
Bei der Erhaltungstherapie ist Rituximab das Mittel erster Wahl. 500 mg RTX (0,6, 12 und 18 Monate nach Induktion) war Azathioprin überlegen [15]. Dies wurde für den rezidivierenden Krankheitsverlauf mit 1 g RTX alle vier Monate bestätigt [16]. Alternativ kommt vor allem bei Kontraindikation (aktive Hepatitis B) Azathioprin in Frage (cave: keine Kombination mit Xanthinoxidasehemmern), wobei die Therapie für mindestens 48 Monate fortgeführt werden sollte [17]. MMF war Azathioprin bei der Remissionserhaltung unterlegen [18]. Methotrexat kann bei den meisten Erkrankten aufgrund der Nierenfunktionseinschränkung nicht gegeben werden. Leflunomid kann als „Reserve“ eingesetzt werden, bei Dialysepatienten aufgrund geringer Knochenmarkstoxizität auch Cyclosporin [19].
Eine unbegrenzte Weiterführung kann für RTX nicht empfohlen werden, u. a., da nicht selten Leukopenien und Hypo-γ-Globulinämien beobachtet werden.
Ob und gegebenenfalls wie lange Steroide in welcher Dosis zum Remissionserhalt notwendig sind, ist nicht bekannt. In einer Übersichtsarbeit war die Beendigung der Steroidtherapie der stärkste Prädiktor eines Rezidivs [20]. Bei der aktuellen Datenlage empfiehlt es sich, im ersten Jahr eine Dosis von 5 mg Prednisolon beizubehalten, und es im zweiten Therapiejahr je nach ANCA-Titer und Organmanifestation mehr oder weniger rasch auszuschleichen.
Besondere Aspekte der Therapie jenseits der Immunsuppression
Obwohl sich Lebenserwartung und Lebensqualität der Patienten dramatisch verbessert haben, müssen chronische Organschäden und Therapienebenwirkungen wie Steroiddiabetes, Osteoporose, Katarakt, mögliche Gonadentoxizität und das Malignomrisiko sowie die gesteigerte Inzidenz kardiovaskulärer Ereignisse jenseits des ersten Jahres in die Betreuung dieser Patienten einbezogen werden. Bei eingeschränkter Nierenfunktion ist eine optimale Blutdruckeinstellung mit ACE-Hemmer oder Sartan empfehlenswert sowie im Verlauf die Gabe eines SGLT-2-Inhibitors.
Für die Zukunft sind neue therapeutische Ansätze mit immunologischem Fokus einerseits und Entzündungshemmung und Reduktion der Fibrose andererseits zu erwarten. Auch bei den Vaskulitiden könnten CAR-T-Zellen eine Rolle spielen.
Prof. Dr. med. Marion Haubitz, Klinikum Fulda gAG, Medizinische Klinik III, Nephrologie, E-Mail: marion.haubitz@klinikum-fulda.de
Die Literaturangaben zum Artikel finden Sie hier.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „ANCA-assoziierte Vaskulitis – Diagnostik und Therapie“ von Prof. Dr. med. Marion Haubitz finden Sie in der PDF-Version dieses Artikels und im Mitgliederportal unter https://portal.laekh.de. Die Teilnahme zur Erlangung von Fortbildungspunkten (3 CME) ist nur online über das Portal vom 25.06.2025 bis 24.12.2025 möglich. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Der Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autorin sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es gibt kein Sponsoring. Offenlegung eines möglichen Interessenkonflikts: Teilnahme am Advisory board Avacopan CSL Vifor. (red)