Dr. med. Christopher Hackenberg, Dr. med. Daniel Monastyrski, Dr. med. Carmen Schmitz, Dr. med. Philip Esters, Prof. Dr. med. Axel Dignaß
Einleitung
Die Inzidenz und Prävalenz der chronisch entzündlichen Darmerkrankungen (CED) und insbesondere des Morbus Crohn (MC) haben in jüngerer Zeit weltweit und auch in Deutschland zugenommen [1]. Die Prävalenz beträgt ca. 100–200 Fälle pro 100.000 Einwohner [2]. Es sind insbesondere jüngere Menschen mit meist normaler Lebenserwartung betroffen, prinzipiell tritt die Erkrankung aber in jedem Alter auf. Eine wirksame Therapie ist entscheidend für das Privat-, Arbeits- und Sozialleben der Betroffenen, welches von einer guten Krankheitskontrolle abhängig ist. Somit wird das Verständnis über evidenzbasierte Diagnostik und Therapie für immer mehr Ärzte relevant.
Diagnostik
Die Diagnostik des Morbus Crohn ist ebenso vielfältig wie das klinische Bild und mögliche Symptomkomplexe. Letztendlich lässt sich aber durch den gezielten Einsatz und die Interpretation verschiedener Untersuchungsmethoden eine sichere Diagnose stellen. Dabei hilft ein systematisches Vorgehen, das den Ausschluss möglicher Differenzialdiagnosen ermöglicht.
Anamnese und körperliche Untersuchung
Bei (Erst-) Vorstellung eines Patienten mit dem Verdacht auf eine chronisch entzündliche Darmerkrankung stehen an aller erster Stelle die Anamnese und eine körperliche Untersuchung. Hierbei sind die Art und der zeitliche Verlauf der Beschwerden zu erfragen. Ein protrahierender Verlauf mit nicht-blutigen oder auch gelegentlich blutigen Diarrhoen, einhergehend mit Bauchschmerzen, Tenesmen, Arthralgien, oralen Aphten oder perianalen Fistelbildungen deutet auf einen Morbus Crohn hin. Letztere Symptome sind typische extraintestinale Manifestationen, die sich durch eine gezielte körperliche Untersuchung erheben lassen.
Des Weiteren sind eine ausführliche Reise- und Medikamentenanamnese zu eruieren. Dadurch lassen sich klassische Differentialdiagnosen wie die infektiöse Colitis und medikamenteninduzierte Diarrhoen (u. a. NSAR, C. difficile-Colitis) abgrenzen. Patienten mit Morbus Crohn sollten darüber aufgeklärt werden, dass die Einnahme von nicht steroidalen Antirheumatika (NSAR) den Krankheitsverlauf negativ beeinflussen kann [3]. Eine Anamnese auf Noxen spielt insbesondere im Hinblick auf den Nikotinkonsum eine wichtige Rolle, da dieser mit einem komplizierteren Krankheitsverlauf einhergehen kann [4]. Da bei erstgradigen Verwandten von Patienten mit CED ein relatives Risiko von bis zu 10 % besteht, dass sie ebenfalls erkranken, ist eine Familienanamnese von großer Bedeutung [5].
Ungefähr die Hälfte der Patienten mit Morbus Crohn erhalten im Verlauf ihrer Erkrankung eine immunsuppressive Therapie, sodass bereits im Vorfeld auf der Vervollständigung des Impfstatus nach den Empfehlungen der STIKO (Ständige Impfkommission) liegen sollte. Totimpfstoffe unter immunsuppressiver Therapie gelten als sicher, während Lebendimpfungen unter einer immunsuppressiven Therapie kontraindiziert sind [6].
Labordiagnostik
Die Labordiagnostik sollte ein großes Blutbild, Inflammations- (CRP, ggf. PCT), Nierenretentions-, Leber- und Cholestaseparameter sowie den Eisenstatus umfassen [7]. Ein für den Morbus Crohn spezifischer Laborparameter existiert nicht. Das CRP korreliert noch am ehesten mit der Krankheitsaktivität, wobei zu beachten ist, dass ein negativer oder geringer Wert einen aktiven Morbus Crohn nicht ausschließt [8]. Außerdem können je nach Befall, Muster, Dauer und Schwere der Erkrankung weitere Mangelerscheinungen durch die Bestimmung spezifischer Laborparameter wie zum Beispiel Vitamin B12, Vitamin D und Albumin diagnostiziert werden [9, 10]. Des Weiteren wird die Bestimmung von Calprotectin aus dem Stuhl empfohlen. Das fäkale Calprotectin ist ein Neutrophilenprotein, welches mit der endoskopischen Aktivität korreliert. Zu beachten ist jedoch, dass ein reiner Ileumbefall oder isolierter Befall des oberen GI-Traktes häufig zu keinen erhöhten Calprotectinwerten führt [11]. Die Bestimmung des fäkalen Calprotectin ist insbesondere zur Differenzierung von funktionellen Beschwerden sehr nützlich.
Die Erstmanifestation einer chronisch entzündlichen Darmerkrankung lässt sich nur schwer von einer infektiösen Kolitis unterscheiden, weshalb bei der Erstdiagnose, aber auch bei einem akuten Schub stets die Asservierung von Stuhlkulturen empfohlen wird [12]. Hierbei sollte eine Testung auf pathogene Keime, unter anderem Campylobacter, Salmonellen, Shigellen, Escherichia coli, ggf. Yersinien und insbesondere auch Clostridioides difficile, erfolgen, da Patienten mit einer CED im Vergleich zu Patienten ohne CED ein knapp fünffach erhöhtes Risiko haben, eine Infektion mit dem Erreger Clostridioides difficile zu erleiden [13].
Bei einem schweren akuten Schub sowie therapierefraktärem Morbus Crohn ist differenzialdiagnostisch an eine Zytomegalie Virus-assoziierte Kolitis (CMV) zu denken, wobei diese deutlich seltener als bei der Colitis ulcerosa auftritt. Der Nachweis erfolgt mittels PCR im Blut oder im Gewebe und durch die immunhistochemische Untersuchung einer endoskopisch gewonnenen Gewebeprobe [14, 15].
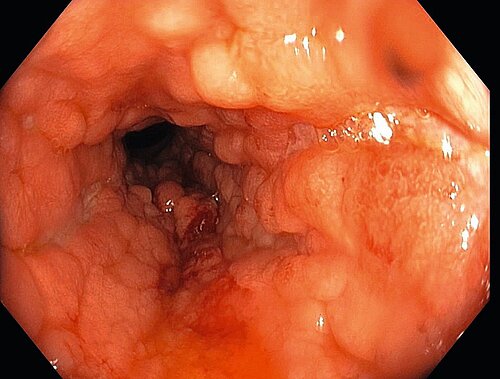
Im nächsten Schritt sollen eine Ileokoloskopie und auch eine Ösophagusgastroduodenoskopie durchgeführt werden. Von großer Bedeutung ist dabei die makroskopische Beurteilung der Schleimhaut mit Augenmerk auf Crohn-spezifische Veränderungen wie einen diskontinuierlichen Befall und fissurale Ulzerationen [16]. Die Beschreibung der Lokalisation und des Schweregrades der Entzündung sind für den weiteren Verlauf und die Therapie von zentraler Bedeutung. Außerdem sollten Stufenbiopsien aus dem Bereich des Ileums sowie des Colons und des Rektums zur weiterführenden histopathologischen Begutachtung gewonnen werden. Da der Morbus Crohn im gesamten Gastrointestinaltrakt auftreten kann, wird insbesondere bei Erstdiagnose und im Verlauf je nach Symptomatik eine Ösophagogastroduodenoskopie empfohlen. Grundlage für diese Empfehlungen in der Deutschen Leitlinie ist eine hohe Anzahl an Morbus Crohn-Patienten mit Magenbefall [17]. Die Durchführung einer MRT Enterografie (Sellink) ist zur Beurteilung des mittleren Gastrointestinaltrakts indiziert (Goldstandard) und sollte bei Erstdiagnose eines Morbus Crohn durchgeführt werden. Die Darmsonografie bietet bei entsprechender Expertise ein praktisch gleichwertiges diagnostisches Mittel (da annähernd gleich hohe Sensitivität) in der Beurteilung einer Dünndarmbeteiligung, wobei auch das Colon gut beurteilt werden kann [18]. Die Kapselendoskopie kann im Einzelfall bei unschlüssigen Befunden (erhöhtes CRP/Calprotectin, unklare Eisenmangelanämie) und fortbestehendem Verdacht auf eine Dünndarmmanifestation durchgeführt werden (keine allgemeine GKV-Leistung, nur bei unklarer Anämie und unklarer Befundkonstellation nach unauffälliger Gastroskopie und Ileo-Koloskopie) [19]. Die Ballon-Enteroskopie wird gelegentlich diagnostisch zur Gewinnung von Gewebeproben bei isolierter Dünndarmerkrankung zur Diagnossicherung oder zum Ausschluss anderer Entzündungsursachen und von Neoplasien, häufiger aber therapeutisch zur Dilatation von Stenosen angewandt. Bei Verdacht auf extramurale Komplikationen, wie zum Beispiel Abszesse oder Fisteln, sind je nach Lokalisation eine MRT-Enterografie, ein MRT des Beckens, eine transrektale Endosonografie sowie die Darmsonografie Mittel der Wahl [18].
Verlaufsdiagnostik
Ein klar definiertes singuläres Therapieziel nach Einleitung einer Morbus Crohn spezifischen Therapie steht derzeit in einer intensiven Diskussion. Nach der aktuellen Leitlinie sollen zur Verlaufsbeurteilung sowohl die klinische Symptomatik als auch objektive Parameter wie das CRP, das fäkale Calprotectin, die Darmsonografie/ MRT-Sellink und die endoskopische Diagnostik berücksichtigt werden. Wenn Patienten also im akuten Schub eine CRP-Erhöhung aufweisen, kann dieser Parameter zur weiteren Verlaufsbeurteilung hilfreich sein und korreliert letztendlich mit der klinischen und endoskopischen Aktivität [20]. Hingegen ist das fäkale Calprotectin mit einem hohen negativen prädiktiven Wert ein guter Surrogatmarker für die endoskopische Aktivität des Morbus Crohn und offeriert daher einen guten Verlaufsparameter unter Therapie, falls es initial erhöht ist [21]. Hierbei sollte berücksichtigt werden, dass bei Patienten mit Morbus Crohn ein Cut-Off-Wert zwischen 200 – 250 mg/kg als normal angesehen wird. Zur weiteren Objektivierung eines Therapieansprechens wird frühestens drei Monate nach Beginn einer medikamentösen Therapie zur Remissionsinduktion eine Darmsonografie zur Beurteilung der Darmwand empfohlen [22]. In der Regel sollte sechs bis neun Monaten (Zeitpunkt abhängig vom eingesetzten Medikament) nach Therapieeinleitung-/Therapieumstellung eine endoskopische Diagnostik durchgeführt werden. Vorausgesetzt ist eine hieraus zu ziehende therapeutische Konsequenz. Die Grundlage dieser Empfehlung beruht auf mehreren Studien, die eine positive Assoziation zwischen mukosaler Heilung und Verlauf der Erkrankung aufzeigen konnten. Hierzu gehören unter anderem eine Verbesserung der Lebensqualität sowie die Verminderung der Schubhäufigkeit, eine erhöhte Rate an klinischer Remission und eine geringe Notwendigkeit für eine operative Intervention im Verlauf. [23, 24]. Bei Patienten mit einer klinischen Remission kann das Calprotectin in regelmäßigen Abständen bestimmt werden. Es dient unter anderem zur Früherkennung von Rezidiven. Mehrere Studien konnten bei asymptomatischen Patienten mit erhöhtem Calprotectinwert das Risiko eines akuten Schubes in den folgenden zwei bis drei Monaten zwischen 53–83 % ermitteln, wobei offenbleibt, welche therapeutische Konsequenz bei isoliert erhöhtem Calprotectinwert zu erwägen ist [25].
Patienten nach Ileozökalresektion sollten innerhalb der ersten sechs bis zwölf Monate postoperativ eine endoskopische Diagnostik mit Beurteilung der Anastomose erhalten (siehe Indikationen zur remissionserhaltenden Therapie). Zusätzlich ist die Bestimmung des fäkalen Calprotectins sinnvoll. Eine Karzinomprophylaxe bei einem Morbus Crohn mit Kolonbefall wird nach Risikostratifizierung angelehnt an den Empfehlungen zur Colitis ulcerosa empfohlen [6].
Therapie
Trotz wesentlicher Fortschritte beim Verständnis der Ätiopathogenese chronisch entzündlicher Darmerkrankungen ist bis heute keine kausale Therapie des Morbus Crohn möglich. Ziel ist daher zunächst die Kontrolle entzündlicher Veränderungen, um möglichst eine Beschwerdefreiheit mit guter Lebensqualität sowie die Vermeidung von Komplikationen zu erreichen [26].
Remissionsinduktion
Bevor man sich für eine spezifische Therapie entscheidet, sollte man verschiedene Überlegungen und Aspekte berücksichtigen. Von großer Relevanz sind die Krankheitsaktivität sowie das Befallsmuster. Außerdem sollte man das Alter, Komorbiditäten, eine mögliche Familienplanung, den Ernährungszustand, das Ansprechen auf und die Nebenwirkungen bisheriger Vortherapien sowie extraintestinale Manifestationen und Komorbiditäten, insbesondere rezidivierende opportunistische Infekte oder vorbestehende Malignome beachten.
Hauptziele sind eine steroidfreie klinische Remission mit normaler Lebensqualität sowie die Vermeidung Morbus Crohn-bedingter Komplikationen [27].
Bevor man die Therapie wechselt, sollte die bisherige Therapie zunächst optimiert werden. Dies kann zum Beispiel durch Änderung der Dosisintervalle, Komedikation oder einer Adhärenzprüfung erfolgen. Es sollte vor einer Therapieänderung die entzündliche Aktivität bestätigt werden und geprüft werden, ob z. B. Bauchschmerz durch narbige Stenosen oder Diarrhoen im Rahmen eines Gallensäureverlustsyndroms bestehen.
Morbus Crohn mit Ileozökalalbefall und/ oder rechtsseitigem Kolon
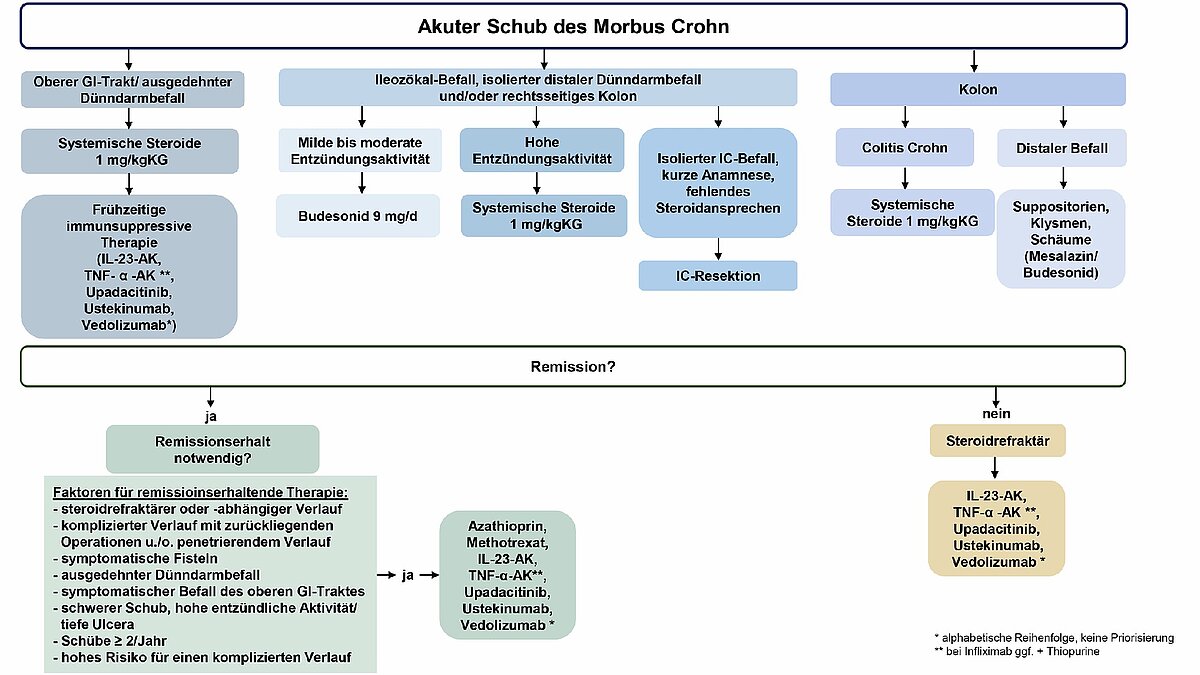
Bei einem Morbus Crohn mit isoliertem Befall der Ileozökalregion und/ oder im rechtsseitigen Kolon sowie milder bis moderater Krankheitsaktivität ist Budesonid in einer Dosis von 9 mg pro Tag für einen Zeitraum von acht bis zwölf Wochen empfohlen [28, 29]. Bei fehlender Besserung beziehungsweise hoher Entzündungsaktivität sollte eine Therapie mit systemischen Glucocorticoiden (zum Beispiel mit 1 mg/kg Körpergewicht (KG) Prednisolon-Äquivalent pro Tag) erfolgen [30].
Alternativ sollte bei isoliertem Befall der Ileozökalregion eine Ilezökalresektion diskutiert werden, wenn ein steroidrefraktärer Zustand sowie eine kurze Krankheitsanamnese vorliegen [31]. Leitliniengerecht sollte die Steroidtherapie außerdem „zur Senkung des perioperativen Komplikationsrisikos reduziert oder wenn möglich beendet werden“ [27].
Colitis Crohn
Auch bei Kolonbefall ist eine systemische Steroidtherapie (zum Beispiel mit 1 mg/ kg KG Prednisolon-Äquivalent pro Tag) empfohlen [30]. Falls lediglich ein distaler Befall vorliegt, kann ergänzend eine topische Therapie mittels Klysmen, Schäumen oder Suppositorien erfolgen (mit Mesalazin, Budesonid, weiteren lokal anwendbaren Steroiden) [27].
Ausgedehnter Dünndarmbefall/Befall von Ösophagus, Magen
Ist der obere Gastrointestinaltrakt betroffen, sollte eine systemische Steroidtherapie begonnen werden (zum Beispiel mit 1 mg/kg KG Prednisolon-Äquivalent pro Tag). Des Weiteren sollte frühzeitig eine immunsuppressive Therapie, beispielsweise mit TNF-a-Antikörpern (im Falle von Infliximab ist die Kombination mit Thiopurinen zu erwägen), Guselkumab, Mirikizumab, Risankizumab, Upadacitinib, Ustekinumab oder Vedolizumab (alphabetische Reihenfolge, keine Priorisierung) erwogen werden, da der Dünndarmbefall einen Prädiktor für einen ungünstigen Verlauf darstellt [32–40].
Steroidrefraktärer Schub
Falls keine Besserung durch Steroide erzielt werden kann, sollte eine Therapie mit TNF-α-Antikörpern [41–47], Guselkumab, Mirikizumab, Risankizumab [48], Upadacitinib [49], Ustekinumab [32] oder Vedolizumab [32, 50–52] (alphabetische Reihenfolge, keine Priorisierung) eingeleitet werden. Im Falle von Infliximab kann eine Kombination mit Thiopurinen erfolgen [53].
Steroidabhängiger Schub
Patienten, die innerhalb von drei Monaten nach Beginn einer Steroidtherapie die Dosis nicht unter ein Prednisolonäquivalent von 10 mg pro Tag (oder Budesonid auf unter 3 mg/Tag) reduzieren können, ohne dass die Krankheitsaktivität wieder zunimmt, die einen erneuten Schub innerhalb von drei Monaten nach Absetzen der Steroide erfahren oder mehr als einer Steroidtherapie pro Jahr bedürfen [27], gelten als steroidabhängig.
Diese Patientengruppe sollte mit Thiopurinen [54–56], Methotrexat [57–60], einem TNF-α-Antikörper [41–45] (im Falle von Infliximab gegebenenfalls kombiniert mit Thiopurinen), Risankizumab [48], Upadacitinib [49], Ustekinumab [61–63] oder Vedolizumab [64] (alphabetische Reihenfolge, keine Priorisierung) therapiert werden.
Indikationen zur remissionserhaltenden Therapie
Im Gegensatz zu den Empfehlungen bei der Colitis ulcerosa besteht beim Morbus Crohn keine generelle Indikation zur remissionserhaltenden Therapie.
Die Entscheidung zur Einleitung einer Remissionserhaltungstherapie sollte unter Berücksichtigung des individuellen Krankheitsverlaufs, des spezifischen Risikoprofils, der Vortherapien und des Patientenwunsches festgelegt werden.
Folgende Faktoren sprechen gemäß der aktuellen deutschen Leitlinie der DGVS für eine remissionserhaltende Therapie:
- steroidrefraktärer Verlauf
- steroidabhängiger Verlauf
- komplizierter Verlauf mit zurückliegenden Operationen und/ oder penetrierendem Verlauf
- symptomatische Fisteln
- ausgedehnter Dünndarmbefall
- symptomatischer Befall des oberen Gastrointestinaltraktes
- schwerer Schub, hohe entzündliche Aktivität/tiefe Ulcera
- Schübe ≥ 2/Jahr
- hohes Risiko für einen komplizierten Verlauf.
Ziel einer Langzeittherapie sollte die Erhaltung der steroidfreien klinischen Remission mit einer anhaltenden Normalisierung der Lebensqualität sein.
Eine besondere und viel diskutierte Situation betrifft die postoperative Rezidivprophylaxe in Form einer medikamentösen Remissionserhaltung, beispielsweise nach einer Ileozökalresektion.
Bestimmte Risikofaktoren, die für den sofortigen Beginn einer Remissionserhaltung sprechen, wurden in einer großen Studie identifiziert [65, 66]:
- hohe präoperative Krankheitsaktivität
- Tabak-Abusus
- penetrierender Verlauf
- junges Alter
- ausgedehnter Befall
- männliches Geschlecht
- frühere intestinale Resektionen.
Bei Abwesenheit von Risikofaktoren sollte zunächst postoperativ keine remissionserhaltende Therapie durchgeführt werden und sechs Monate nach der Operation eine endoskopische Kontrolle erfolgen [67]. Sollte bei dieser Untersuchung eine relevante entzündliche Aktivität im Bereich der Anastomose diagnostiziert werden, besteht die Indikation zur Einleitung einer remissionserhaltenden antientzündlichen Therapie. Der modifizierte Rutgeerts-Score (Tab. 1) hilft hier bei der Entscheidung [68].
| Tab. 1: Modifizierter Rutgeerts-Score | |
| Schweregrad | Endoskopischer Befund |
| i0 | keine Läsionen |
| i1 | < 5 aphthöse Läsionen im neoterminalen Ileum |
| i2 | > 5 aphthöse Läsionen oder tiefe Ulzerationen (Skip Lesions) oder Läsionen im Bereich der Anastomose
|
| i3 | diffuse aphthöse Ileitis |
| i4 | diffuse Ileitis mit tiefen Ulzerationen und/oder Stenose |
Medikamentöse Therapie zum Remissionserhalt
In den vergangenen Jahren und Jahrzehnten sind eine Reihe an wirksamen Substanzen für die remissionserhaltende Therapie zugelassen worden. Die ersten Biologika für diese Indikation, die mittlerweile zur Standardtherapie gehören, sind die TNF-α-Inhibitoren Infliximab und Adalimumab [47]. Des Weiteren gibt es die Möglichkeit mit dem Anti-Integrin-Antikörper Vedolizumab zu therapieren [64]. Darüber hinaus sind die Interleukin-12/23 beziehungsweise Interleukin-23-Antikörper Ustekinumab und Risankizumab für die Behandlung zugelassen [48, 61]. Zudem besteht mit dem JAK-Inhibitor Upadacitinib eine orale Alternative [49]. Letztlich gibt es den oral verfügbaren Antimetaboliten Azathioprin und auch Methotrexat, was jedoch zunehmend an Relevanz verliert [69].
Die Leitlinie nimmt keine Priorisierung hinsichtlich des Einsatzes der verschiedenen Substanzen beim Morbus Crohn vor, sodass die Auswahl der einzelnen Präparate abhängt von Patientenpräferenz, Vortherapie, individuellem Krankheitsbild und Vorerkrankungen.
Prinzipiell gelten die TNF-α-Inhibitoren Infliximab und Adalimumab sowie der JAK-Inhibitor Upadacitinib und die Thiopurine als nebenwirkungsreicher, jedoch ist häufiger ein schnellerer Wirkungseintritt (außer bei Thiopurinen) zu beobachten [70]. Die Interleukin-12/23 oder 23-Antikörper Mirikizumab, Guselkumab, Risankizumab und Ustekinumab sowie der Integrin-Antikörper Vedolizumab weisen hingegen ein Nebenwirkungsprofil auf, das demjenigen einer Therapie mit Placebo entspricht, sodass diese Substanzen insbesondere bei Komorbiditäten oder fortgeschrittenem Patientenalter in Frage kommen [48, 61, 64].
Prinzipiell zu beachten ist, dass Steroide keinen Stellenwert in der Remissionserhaltung haben und keine Zulassung für eine Dauertherapie besitzen, dies betrifft sowohl topische als auch systemische Formulierungen [71, 72]. Eine Dauertherapie mit Steroiden in reduzierter Dosierung ist nicht wirksamer als Placebo und auch bei niedrigen Dosierungen nebenwirkungsreich. Darüber hinaus wird auch Mesalazin im Gegensatz zur Therapie der Colitis ulcerosa nicht zur Behandlung des Morbus Crohn empfohlen, da der Nachweis der Wirksamkeit nicht gegeben ist [73].
Seit Jahrzehnten zugelassen für die Remissionserhaltung ist der Immunmodulator Azathioprin [69]. Auf Grund der langen Dauer bis zum Wirkeintritt, der moderaten Wirksamkeit, der häufigen Unverträglichkeiten (gastro-intestinale Nebenwirkungen) und dem Lymphomrisiko und Hautkrebsrisiko sowie erhöhtem Risiiko cervicaler Dysplasien bei langjährigem Einsatz rücken die Thiopurine in den Hintergrund [74] .
Allerdings ist bei Risikofaktoren wie beispielsweise jungem Erkrankungsalter, langstreckigem Dünndarmbefall oder perianalem Morbus Crohn unter Nutzen-/Risikoabwägung eine Kombinationstherapie von Infliximab und Thiopurinen zur Remissionserhaltung eine wirksame Option [53].
Es gibt eine Reihe von Daten, die zeigen, dass durch die Beendigung des Rauchens die langfristige Rezidivrate des Morbus Crohn halbiert werden kann [75, 76].
Nebenwirkungen
Hinsichtlich der Nebenwirkungen einer immunsuppressiven Therapie sind einige Besonderheiten zu beachten.
Prinzipiell gibt es ein altersabhängiges Risiko für schwere Infektionen, wobei hier insbesondere TNF-α- und JAK-Inhibitoren verantwortlich sind [77].
Der Impfstatus sollte vor Beginn einer immunsuppressiven Therapie auf das Vorhandensein der Standardimpfungen kontrolliert und aktualisiert werden. Totimpfstoffe unter immunsuppressiver Therapie gelten als sicher, während Lebendimpfungen kontraindiziert sind [78].
Vor einer Therapie mit JAK-Inhibitoren sollte auf Grund des erhöhten Risikos für einen Herpes zoster eine entsprechende Impfung erfolgen, wobei dies bei Personen unter 60 Jahren beim Kostenträger beantragt werden muss.
Vor Beginn einer immunsuppressiven Therapie sollte bei allen Patienten ein Infektionsscreening auf Hepatitis B, Tuberkulose und EBV durchgeführt werden [78]. Dies schließt eine Röntgenaufnahme der Lunge und einen Interferon-gamma-Release-Assay (IGRA) mit ein, um eine aktive oder latente Tuberkulose-Infektion auszuschließen.
Bei Nachweis einer latenten Tuberkulose ist eine chemopräventive Therapie indiziert [78]. Die Indikation für eine antivirale Therapie der Hepatitis B richtet sich nach der immunsuppressiven Therapie und der serologischen Konstellation (siehe Hepatitis B-Leitlinie) [79].
Für die JAK-Inhibitoren liegt ein Rote Hand Brief vor, der auf das erhöhte Risiko von thromboembolischen bzw. schwerwiegenden unerwünschten kardiovaskulären Ereignissen (MACE) Ereignissen unter einer entsprechenden Therapie hinweist [80]. Diese Erkenntnisse stammen aus der Therapie von Patienten, die an einer rheumatoiden Arthritis leiden. Diese Daten führten bedauerlicherweise dazu, dass ein Rote-Hand-Brief für alle JAK-Inhibitoren ungeachtet der Indikation erstellt wurde, da die EMA das erhöhte Risiko für kardiovaskuläre Ereignisse und venöse Thromboembolien als Klasseneffekt ansah.
Diese unerwünschten Ereignisse wurden in den vorliegenden Studiendaten bei Patienten mit Colitis ulcerosa und Morbus Crohn bisher nur in sehr geringer Inzidenz beobachtet [81]. Es bleibt daher fraglich, ob die Daten vom Kollektiv der Patienten mit rheumatoider Arthritis ohne Weiteres auf CED-Patienten übertragen werden können.
Wegen des erhöhten Risikos für den Nicht-Melanom-Hautkrebs (NMSC) unter der Therapie mit Thiopurinen und des nicht auszuschließenden Risikos für maligne Melanome unter einer TNF-α-Antikörper-Therapie sollte ein regelmäßiges Hautkrebsscreening beim Einsatz dieser Medikamente erfolgen [82, 83].
Therapiemonitoring
Es ist wichtig, zwischen einem primären und einem sekundären Therapieversagen zu unterscheiden. Das fehlende Ansprechen auf eine begonnene Therapie muss von einem sekundären Verlust des initial vorhandenen Ansprechens nach Verstreichen einer gewissen Periode der erfolgreichen Behandlung unterschieden werden. Bei einem primären Therapieversagen handelt es sich meistens um ein pharmakodynamisches Problem, die Medikation muss in der überwiegenden Anzahl der Fälle geändert werden. Ein sekundäres Therapieversagen kann entweder durch immunologisch vermittelte pharmakokinetische oder pharmakodynamische Prozesse verursacht werden. Diese zugrunde liegenden Mechanismen können unter anderem durch das Monitoring von Anti-Drug-Antikörpern (gegen Infliximab oder Adalimumab gerichtete Antikörper, die weiteren Biologika besitzen kaum immunogenes Potenzial) sowie den zugehörigen Talspiegel des Biologikums im Serum erfasst werden [84, 85].
EXIT
Eine Frage, die sich immer wieder stellt, zielt auf die Dauer der remissionserhaltenden Therapie ab, wobei auf Grund fehlender Evidenz zu dieser Frage keine generelle Empfehlung gegeben werden kann. In der Regel empfehlen wir jedoch eine Therapie von ca. zwei Jahren (durchschnittliche Therapiedauer in den meisten retrospektiven Analysen). Vor Beendigung der Therapie sollte mit dem Patienten die aktuelle private wie auch berufliche Lebenssituation besprochen werden, zudem ist der bisherige Krankheitsverlauf zu beachten, ein kompliziertes Fistelleiden, mehrfach notwendige Operationen oder anderer schwerwiegende Ereignisse sprechen für eine Fortsetzung der Therapie. Prinzipiell ist ein Rezidivrisiko von ca. 50 % binnen zwei Jahren nach Absetzen der Therapie zu beachten [103].
Vgl. Tab. 2.
| Tab. 2: Therapieplan über eine durchschnittliche Therapiedauer von zwei Jahren | |||||||
| Induktion | |||||||
| Infliximab | Adalimumab | Mirikizumab | Guselkumab | Risankizumab | Vedolizumab | Ustekinumab | Upadacitinib |
| Biosimilar | Biosimilar | Biosimilar | |||||
| Woche 0, 2, 6: 5 mg/kg i.v. | Woche 0: 160 mg Woche 2: 80 mg | Woche 0, 4, 8: 900 mg i.v. | Woche 0, 4, 8: 200 mg i.v. oder Woche 0, 4, 8: 400 mg s.c. | Woche 0, 4, 8: 600 mg i.v. | Woche 0, 2, 6: Ggf. zusätzliche | Woche 0: 260/390 oder 520 mg i.v. Woche 8: sc | 12 Wochen: 45 mg p.o. täglich |
| Erhaltung | |||||||
| Infliximab | Adalimumab | Mirikizumab | Guselkumab | Risankizumab | Vedolizumab | Ustekinumab | Upadacitinib |
5 mg/kg i.v.: Alternativ ab Woche 6: s.c. alle 14 Tage 120 mg | 40 mg s.c. alle 1–2 Wochen | 300 mg s.c. alle 4 Wochen | 200 mg s.c. oder 100 mg s.c. alle 8 Wochen | 360 mg s.c. in Woche 12, dann alle 8 Wochen | 300 mg i.v. Alternativ | 90 mg s.c. alle 8–12 Wochen | 30 oder 15 mg p.o. täglich |
| Azathioprin p.o. lediglich zur Erhaltung zugelassen | |||||||
Fisteln
Perianale, enterokutane, enterovaginale, enterovesikale oder enteroenterale Fisteln sind häufige Komplikationen und typische Manifestationen des Morbus Crohn. Nach 20 Jahren sind ca. 25 % der Patienten kumulativ betroffen [27].
Diese sollten interdisziplinär, sowohl internistisch als auch chirurgisch, evaluiert und therapiert werden. Medikamentös ist bei perianalen Fisteln (eventuell nach Abszessausschluss oder -drainage) in erster Linie Infliximab anzuwenden [86, 87], in der Zweitlinientherapie Adalimumab [88, 89], Upadacitinib [90], Ustekinumab [91] oder Vedolizumab [92].
Eine Operationsindikation besteht bei enterovesikalen Fisteln [93], im Retroperitoneum blind endenden Fisteln, Fisteln mit daraus resultierendem Kurzdarmsyndrom und enterokutanen Fisteln mit hoher Fördermenge [27]. Fadendrainagen sollten bei sezernierenden Fisteln gelegt werden. Dagegen müssen asymptomatische perianale Fisteln in der Regel nicht therapiert werden [27].
Falls es trotz adäquater medikamentöser und chirurgischer Therapie nicht zu einer ausreichenden Besserung von perianalen Fisteln kommt oder die Patienten stark in ihrer Lebensqualität eingeschränkt sind, kann ein Deviationsstoma angelegt werden [94–96]. Im Falle eines persistierenden Therapieversagens stellt die Proktektomie eine weitere Option dar [94–97]. Laut der Leitlinienempfehlung sollte ein operativer Fistelverschluss oder eine Entfernung der Fadendrainage aus einer nicht sezernierenden Fistel im Rektum lediglich erfolgen, wenn eine endoskopische Remission besteht [27]. Der Fistelverschluss wird mittels plastischem Fistelverschluss [98, 99] oder dem LIFT-Verfahren [100, 101] durchgeführt.
Fazit
Die Diagnosestellung eines Morbus Crohn erfordert die Betrachtung verschiedener Untersuchungsergebnisse. Erst nach sicherer Diagnosestellung kann eine gezielte Therapie erfolgen, die sich je nach Befall, Krankheitsschwere und Verlauf richtet. Eine langfristige remissionserhaltende Therapie hängt ebenfalls von verschiedenen Faktoren ab, sollte jedoch immer bei steroidabhängigem oder steroidrefraktärem Verlauf erfolgen.
Dr. med. Christopher Hackenberg, Dr. med. Daniel Monastyrski, Dr. med. Carmen Schmitz, Dr. med. Philip Esters, Prof. Dr. med. Axel Dignaß
Agaplesion Frankfurter Diakonie Kliniken, Markus Krankenhaus, Wilhelm-Epstein-Str. 4, 60431 Frankfurt, Kontakt via E-Mail: haebl@laekh.de
Die Literaturangaben zum Artikel finden Sie hier.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Evidenzbasierte Diagnostik und Therapie bei Morbus Crohn“ von Dr. med. Christopher Hackenberg und Prof. Dr. med. Axel Dignaß et al. finden Sie im Portal.
Die Teilnahme zur Erlangung von Fortbildungspunkten ist nur online über das Portal vom 25.11.2025 bis 24.05.2026 möglich. Die Fortbildung ist mit drei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Der Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es gibt kein Sponsoring und es bestehen keine Interessenkonflikte. (red)