VNR: 276060202319129000
Prof. Dr. med. Julian Bösel
Einleitung
Die akute Behandlung des ischämischen Schlaganfalls, also des plötzlichen Verschlusses eines Hirngefäßes, ist in den vergangenen 15 Jahren revolutioniert worden. Hatte man früher oft den Eindruck, dass drei Stunden nach diesem „schicksalhaften“ Ereignis akut kaum noch etwas medizinisch Sinnvolles getan werden kann und man auf eine Erholung in der Rehabilitation hoffen musste, sind die Möglichkeiten heute besser denn je. Dieser Übersichtsartikel wendet sich an alle, die in dieser Prozesskette interdisziplinär eine Rolle spielen. Dazu gehören Hausärztinnen und -ärzte, niedergelassene Neurologen bzw. Internisten, Notärzte, Rettungsdienst, Ärzte und Pflegekräfte in Notaufnahmen, klinisch tätige Neurologen, Neuroradiologen, Pflegekräfte und Therapeuten auf Stroke Units und ggf. Intensivstationen.
Wissenschaftlich belegte Diagnostik- und Therapiemöglichkeiten wie die Gefäß- und Durchblutungsdarstellung sowie die erweiterte Anwendbarkeit von Rekanalisierung per Thrombolytikum und/oder Katheter erlauben es heute, dass bei raschem und richtigem Handeln ein geringes oder gar kein neurologisches Defizit resultiert – sogar teilweise erstaunlich spät nach dem Gefäßverschluss.
Die folgende Übersicht ist angelehnt an die aktuelle AWMF S2e-Leitlinie [1] zur Akuttherapie des ischämischen Schlaganfalls. Prävention, Sekundärprophylaxe, Spezialfälle, Rehabilitation und Prognose – allesamt sehr wichtige Themen – werden nicht behandelt.

Begriffe, Definitionen, Ursachen
Als ischämischer Schlaganfall werden plötzliche neurologische Ausfallerscheinungen (akute(s) (fokal)neurologische(s) Defizit(e)) bezeichnet, denen eine regionale Minderdurchblutung des Gehirns zugrunde liegt. Der ebenfalls gebräuchliche Begriff Hirninfarkt beschreibt bereits das Korrelat des durch die Minderdurchblutung geschädigten Hirngewebes. Daneben sind Begriffe wie Apoplex, Hirninsult, Hirnschlag usw. in Gebrauch, die meist synonym verwendet werden, aber letztlich unschärfer sind. Der Überbegriff Schlaganfall (engl. „stroke“) umfasst jeglichen akuten krankhaften gefäßbedingten Hirnprozess, neben den Ischämien (über 80 % aller Schlaganfälle) auch spontane Blutungen wie intrazerebrale Blutung und Subarachnoidalblutung.
Der akute ischämische Schlaganfall kann mit AIS abgekürzt werden und wird im Folgenden auch so bezeichnet. Dauert ein neurologisches oder auch okuläres Defizit, das durch eine Minderdurchblutung bedingt ist, nicht länger als 24 h an, spricht man von einer transitorischen ischämischen Attacke (TIA). Dem AIS liegt der Verschluss eines Hirngefäß(ast)es und damit eine territoriale Minderversorgung des Gehirns durch Blut und Sauerstoff zugrunde. Je nach Ausdehnung und Dauer des Verschlusses und je nach individuell sehr unterschiedlicher Versorgung jener Hirnregion durch benachbarte „Ersatzgefäße“ (Kollateralisierung) kommt es zunächst rasch zu einem Funktionsverlust und später meist zu einem irreversiblen Schaden des abhängigen Hirngewebes. Die Entstehung des Gefäßverschlusses kann sehr unterschiedliche Ursachen haben. Neben lokalen thrombotischen Verschlüssen, ggf. auf dem Boden atherosklerotischer Verengungen, kommen oft auch embolische Verschlüsse vor, die ihren Ausgang z. B. von vorgeschalteten größeren Hals- oder Hirngefäßen oder auch dem Herzen bzw. Aortenbogen nehmen können. Zu den häufigsten Ursachen des AIS gehören makroangiopathisch die Karotisstenose, das Vorhofflimmern und mikro-angiopathisch Hirngefäßverschlüsse infolge Bluthochdruck, Diabetes und Nikotinkonsum.
Erkennung und Graduierung des Hirninfarkts
Je nach betroffener Hirnregion, Ausdehnung der Ischämie, individuell unterschiedlicher Kollateralversorgung und aufgrund der komplexen Netzwerkstruktur des Gehirns können sehr unterschiedliche klinische Auswirkungen des AIS resultieren. Auch die Dynamik variiert stark, so können Symptome für Minuten bis Stunden andauern oder darüber hinaus anhalten, schwanken, in ihrer Ausprägung abnehmen, aber auch zunehmen. Typisch und wichtig in der (Fremd)Anamnese herauszuarbeiten ist der plötzliche (apoplektiforme) Beginn der Symptomatik. Seltenere Schlaganfalltypen wie die Basilaris-thrombose oder Hirnvenen- und Sinus-thrombose können allerdings auch eine stotternde, schleichende oder schwankende Symptomatik mit sich bringen. Deshalb werden diese oft verspätet erkannt. Prinzipiell kann der AIS jede Art akuter neurologischer Ausfälle hervorrufen. Besonders häufig sind aber plötzliche Extremitäten- oder Gesichtslähmungen, Sprach- oder Sprechstörungen, Sehstörungen und Gefühlsstörungen. Trotz erheblicher Bemühungen von Fachgesellschaften und Gesundheitsorganisationen, den Schlaganfall seit Jahrzehnten zum Notfall zu erklären und ihm mindestens dieselbe Brisanz wie dem Herzinfarkt zu verleihen, deuten viele Umfragestudien auf ein immer noch geringes Wissen zu Anzeichen eines AIS in der Bevölkerung hin. Wegen des zeitkritischen Behandlungsbedarfs ist dies nach wie vor ein großes Problem. Zwar haben öffentliche Aufklärungskampagnen insgesamt zugenommen [2], deren Wirkung scheint allerdings nicht sehr langlebig zu sein. Weil solche Kampagnen aber mit einer Steigerung vom Thrombolytika-Einsatz assoziiert erscheinen, sollte die Schlaganfall-Aufklärung, auch in den Praxen, weiter verfolgt und gesteigert werden. Für den Rettungsdienst wurden einfache klinische Screening-Instrumente (Skalen und Scores) etabliert, die es erlauben, den Schlaganfall als solchen zu erkennen. Zu empfehlen ist hier insbesondere der Face-Arm-Speech-Time (FAST) Test [3, 4] (siehe Tabelle), der schnell zu erheben und sehr treffsicher ist. Darüber hinaus gibt es – ebenfalls für den Rettungsdienst – mittlerweile etwa 20 verschiedene vereinfachte Scores, von denen es manche erlauben, mit mehr als 80 % Treffsicherheit einen Schlaganfall als besonders schwer zu graduieren [5]. Ein solcher liegt auch dann vor, wenn die Kombination aus Halbseitenlähmung und sog. kortikalen Symptomen (z. B. Sprachstörung, Vernachlässigung einer Seite, Blicklähmung) besteht. Diese Graduierung ist wichtig, weil solche AIS meist durch den Verschluss eines großen Hirngefäßes („large vessel occlusion“, LVO), also der Hauptstämme oder proximalen Abschnitte der distalen Karotis, der mittleren Hirnarterie oder der A. basilaris, verursacht sind, die heutzutage (zusätzlich zur Thrombolyse) einer katheterbasierten Therapie (Thrombektomie) zugeführt werden sollten. Dies kann wichtige versorgungslogistische Implikationen haben. Die Erkennung eines Schlaganfalls oder der Verdacht darauf müssen den sofortigen Transport des Patienten in ein Klinikum zur Folge haben, nicht den privaten Transport und auch nicht die Vorstellung in der (Hausarzt-)Praxis. Sollte letzteres doch passieren, müssen von dort die sofortige Alarmierung und der Transport durch den Rettungsdienst in eine passende Klinik erfolgen.
Tabelle: FAST-Test zur Schlaganfallerkennung | |||
F (Face) | Lächeln lassen | Beide Mundwinkel gehen nach oben? | Ja oder Nein |
A (Arm) | Arme mit Handflächen nach oben vorstrecken lassen | Beide Arme können aktiv gehoben werden, keiner sinkt ab oder dreht sich nach innen? | Ja oder Nein |
S (Speech) | Einfachen Satz nachsprechen lassen | Sprache deutlich und verständlich? | Ja oder Nein |
T (Time) | Jede Minute zählt! TIME IS BRAIN | Ist die Anwort wenigstens einmal „Nein“ besteht Verdacht auf Schlaganfall, der Patient muss sofort in die Klinik. | |
FAST (Face-Arm-Speech-Time) Test nach [3, 4] | |||
Sofortmaßnahmen vor Ort
Bei einem Patienten mit Verdacht auf AIS oder TIA sollte nicht unnötig Zeit vor dem Transport verschwendet werden. Bei einem schweren Schlaganfall, insbesondere im hinteren Hirnkreislauf, der mit Bewusstseinsstörung und/oder Atem-/Kreislauf-Störung einhergehen kann, sind aber möglicherweise die Vitalfunktionen nicht intakt. Diese müssen also überprüft und ggf. stabilisiert werden. Letzteres kann sogar (selten) die Intubation vor Ort erfordern.
Bei einer Sauerstoffsättigung von < 95 % sollte mit dem Ziel der Normoxämie Sauerstoff verabreicht werden, dies sollte aber nicht routinemäßig erfolgen [6, 7]. Der Blutdruck sollte in den meisten Fällen nicht beeinflusst werden, allenfalls bei Werten von > 220 mmHg systolisch und > 120 mmHg diastolisch kann er vorsichtig gesenkt werden, wobei ein Abfall > 25 % vermieden werden sollte.
Für den Transport sollten ein intravenöser peripherer Zugang gelegt und ein EKG angelegt werden, um etwaige schlaganfallassoziierte Herzrhythmusstörungen zu erkennen. In manchen Regionen sind Rettungsfahrzeuge für Schlaganfallpatienten speziell ausgestattet, z. B. mit einem Schlaganfallbehandlungsteam, erweiterten Sofortlabormöglichkeiten und einem Computertomographen (CT); diese werden mitunter „mobile stroke units“ (MSU) genannt. In solchen Fällen können die Vor-Ort-Maßnahmen sinnvoll über das erweitert werden, was oben beschrieben wurde.
Zuweisung und Transport zur Akuttherapie
Nicht zuletzt mit Etablierung der Katheterbehandlung (Thrombektomie) von durch LVO verursachten AIS haben sich der Anspruch an und die Organisation von Transportwegen des Patienten in die Klinik grundsätzlich verändert. Ging es früher darum, den Patienten schnellstmöglich in die nächste Klinik mit CT und Möglichkeit zur Thrombolyse zu bringen, muss der Anspruch heute sein, den Patienten schnellstmöglich in das am besten für seine individuelle Rekanalisierung geeignete Krankenhaus zu bringen. Dies kann je nach Situation (z. B. Verdacht auf LVO oder nicht, s. o.) immer noch das nächstgelegene lysefähige Krankenhaus mit CT sein, aber auch ein an ein thrombektomiefähiges Schlaganfallzentrum (telemedizinisch) angeschlossenes lysefähiges Primärkrankenhaus (Konzept „drip-and-ship“) oder direkt in das Schlaganfallzentrum selbst (Konzept „mothership“). Regional und international haben sich so die unterschiedlichsten Schlaganfallnetzwerke entwickelt.
In Deutschland gibt es inzwischen viele telemedizinische Netzwerke unterschiedlicher Größe zur Regelung der optimalen Zuweisung von Schlaganfallpatienten. Etwa zwanzig Schlaganfallnetzwerke, die teils mit diesen überlappen, sind bereits durch die Deutsche Schlaganfall-Gesellschaft (DSG) als neurovaskuläre Netzwerke zertifiziert, andere befinden sich in der Vorbereitung dazu. In manchen Regionen kommt auch der interventionelle Neuroradiologe per boden- oder luftgebundenem Fahrzeug [8] in ein Primärkrankenhaus, um dort die Rekanalisierung vorzunehmen, statt den Patienten weiter zu transportieren (Konzept „drip-and-drive“). Sicherlich gibt es für unterschiedliche Regionen unterschiedlich gut geeignete Netzwerkarten, dies ist Gegenstand aktiver Forschung. Bisher kann nicht pauschal einem bestimmten Transportkonzept der Vorzug gegeben werden [9]. Vermutlich ist es in Ballungsgebieten bei einer voraussichtlichen Transportzeit von unter 30 bis 45 Minuten vorteilhaft, gemäß „mothership“ den Patienten direkt ins thrombektomiefähige Schlaganfallzentrum zu bringen, während bei längerer Transportzeit vermutlich gemäß „drip-and-ship“ der Patient zunächst in ein CT- und lysefähiges Primärkrankenhaus gebracht werden sollte, das mit einem Schlaganfallzentrum in Verbindung steht [10]. Sollte dort der AIS in der Bildgebung und ebenso ein größerer Gefäßverschluss nachgewiesen werden, kann es geboten sein, eine Thrombolyse zu starten und den Patienten unter laufender Lyse unverzüglich zum Schlaganfallzentrum und zur dortigen Thrombektomie weiter zu transportieren.
Akutbehandlung in der Notaufnahme
Parallel zur Untersuchung durch den Neurologen und der Organisation von Diagnostik und ggf. Rekanalisierung wird der Patient in der Notaufnahme monitoriert und hinsichtlich wichtiger phsysiologischer Parameter stabilisiert. Zum Monitoring gehören das EKG, die Messung der Sauerstoffsättigung, die Erfassung des Blutdrucks (mind. alle vier Stunden für die ersten 48 Stunden, bei auffälligen Schwankungen kurzfristiger), des Blutzuckers und der Temperatur. Vordringlich ist weiterhin die Sicherung der Vitalfunktionen. Der Blutdruck sollte nur dann vorsichtig (nicht unter 25 % vom Ausgangswert) gesenkt werden, wenn er 220/120 mmHg übersteigt [11, 12]. Vor und während einer systemischen Thrombolyse sollte der Blutdruck auf < 180/105 mmHg gesenkt werden [13], danach ist ein Zielblutdruck von 140–160 mmHg systolisch vermutlich günstig. Auch ein hypertensiver Notfall mit klinischen Begleiterscheinungen wie hypertensive Enzephalopathie, Nephropathie, Herzinsuffizienz, Aortendissektion, (Prä)Eklampsie o. ä. soll antihypertensiv behandelt werden, wobei generell ein plötzlicher Blutdruckabfall beim AIS zu vermeiden ist. Bei niedrigen Blutdruckwerten (< 120 mmHg systolisch) und Hinweisen auf eine Exsikkose sollten Kristalloide verabreicht werden, eine darüber hinaus gehende pharmakologische Steigerung niedriger Blutdruckwerte wird nicht routinemäßig empfohlen. Es sei an dieser Stelle darauf hingewiesen, dass erst die Bildgebung klären wird, ob tatsächlich ein AIS oder doch eine intrazerebrale Blutung vorliegt. Letzteres hätte dann andere Implikationen für die Blutdruckbehandlung. Der Blutzucker sollte für die ersten 72 h überwacht und eine Hyperglykämie (Glukose > 180 mg/dl) mit einem Ziel von 70–200 mg/dl (4–11 mmol/l) behandelt werden. Eine Hypoglykämie (< 60 mg/dl) sollte vermieden und z. B. durch Glucose 40 % ausgeglichen werden. Eine prästationäre oder notfällige Routinegabe von Insulin sollte unterbleiben [14, 15]. Die Temperatur, deren Erhöhung z. B. auf eine Endokarditis als Ursache des AIS hinweisen könnte, sollte alle vier Stunden für die ersten 48 Stunden gemessen werden. Bei einer Erhöhung (> 37,5°C), die mit einem schlechteren Verlauf des AIS assoziiert ist, sollte die Ursache gesucht und möglichst behoben werden, zusätzlich kann dann die Gabe eines Antipyretikums (z. B. Paracetamol) erfolgen, aber nicht prophylaktisch [16, 17].
Bildgebende Diagnostik
Ein Patient mit (V. a.) Schlaganfall muss unverzüglich einer zerebralen Bildgebung zugeführt werden, um einen ischämischen sicher von einem hämorrhagischen Schlaganfall zu unterscheiden, um festzustellen, wie weit fortgeschritten der Hirngewebeschaden ist und um die Gefäßsituation und das Ausmaß einer Minderdurchblutung zu klären. All diese Informationen sind essenziell zur Klärung, ob ein Patient ein Kandidat für eine Rekanalisierungsmaßnahme ist. Am weitesten verbreitet ist zur Bildgebung die kraniale CT, ggf. durch Kontrastmittelgabe erweitert zur CT-Perfusion oder CT-Angiografie. Die kraniale Magnetresonanztomografie (MRT) kann diese Fragen ebenfalls beantworten und ist noch präziser in der Darstellung des Ausmaßes und Alters des Gewebeschadens sowie in der Klärung etwaiger Differentialdiagnosen („stroke mimics“), allerdings ist sie aufwendiger und weniger verfügbar. Auch die MRT kann durch Kontrastmittelgabe zur MR-Perfusion erweitert werden. Die Bildgebung per CT oder MRT sollte bei allen Patienten frühestmöglich nach Symptombeginn erfolgen. Alle AIS-Patienten, die prinzipiell für eine Thrombektomie in Frage kommen, sollen unmittelbar nach der Gewebediagnostik auch eine nicht-invasive Gefäßdiagnostik erhalten, die die Gefäße vom Aortenbogen bis zum Vertex darstellt. Im Zeitfenster jenseits von viereinhalb Stunden sollte eine erweiterte multimodale Bildgebung (CT- oder MR-Perfusion) erfolgen, wenn gemäß klinischer Situation eine Indikation zur Rekanalisierung bestehen könnte. Allerdings sollte die Gefäßdiagnostik eine ggf. indizierte Thrombolyse nicht verzögern. Daher wird idealerweise eine Thrombolyse nach der Nativ-Bildgebung direkt in der Bildgebungsräumlichkeit begonnen und anschließend die Gefäßdiagnostik durchgeführt, um die Frage der Thrombektomierbarkeit zu klären. In eingespielten Schlaganfallzentren findet dies in kombinierten oder benachbarten Räumen und „in einem Fluss“ statt, ohne viele Unterbrechungen und Zwischenschritte. Neben der Bildgebung sind Labordiagnostik (v. a. Gerinnungsdiagnostik) und ggf. weitere Diagnostik (z. B. Echokardiografie) wichtig, die aus Platzgründen hier nicht vertieft werden können.
Rekanalisierung
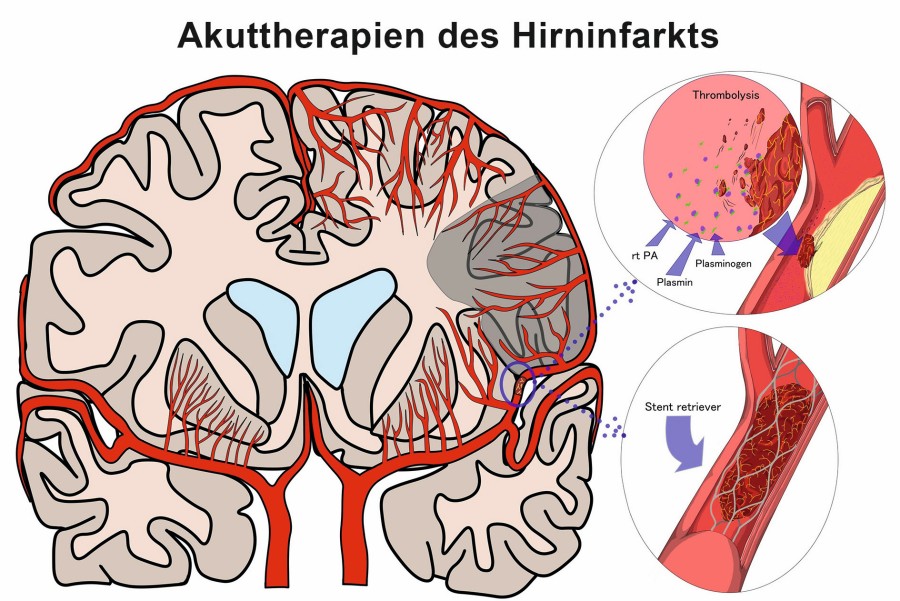
Nachdem erst in den 1990er-Jahren die systemische, intravenöse Thrombolyse mit Alteplase als Standardtherapie zur Rekanalisierung bei AIS etabliert und in den ersten drei Stunden angewandt werden konnte, dauerte es bis 2008, diese Therapie evidenzbasiert auf das sog. viereinhalb Stunden-Zeitfenster auszuweiten. Seitdem hat es durch Fortschritte in der erweiterten zerebralen Bildgebung und insbesondere ab 2014/15 durch die wissenschaftliche Etablierung der mechanischen Thrombektomie, also der katheterbasierten Thrombusentfernung, einen revolutionären Progress in der Rekanalisierung bei AIS gegeben, der zunehmend weg von dem Konzept eines starren Zeitfensters hin zu einer individualisierten, optimalen Therapie des einzelnen Patienten führt. Aber auch wenn dadurch heutzutage – bei selektierten Patienten – sehr gute Ergebnisse sogar bis 24 Stunden nach Symptombeginn erzielt werden können, gilt weiterhin, dass das Ergebnis um so besser ist, je früher das verschlossene Hirngefäß wieder eröffnet wird: Time is brain.
Thrombolyse-Patienten mit einem AIS, die innerhalb von Stunden nach Symptombeginn bzw. nachdem sie zuletzt gesund gesehen wurden, keine Kontraindikationen gegen eine Thrombolyse aufweisen, sollen so schnell wie möglich mit Alteplase IV (0,9 mg/kg, maximal 90 mg, über 60 Minuten, initial 10 % der Dosis als Bolus über eine Minute) behandelt werden [5, 18, 19]. Als vorausgehende Bildgebung ist ein natives kraniales CT ausreichend, wobei eine nicht-invasive Gefäßdiagnostik per CTA oder MRA inkl. Aortenbogen empfohlen wird, um ggf. die Indikation zur Thrombektomie zu stellen. Die Lyse sollte unabhängig vom Alter erfolgen [20–22]. Sie sollte bei behinderndem Defizit unabhängig vom durch die „National Institutes of Health Stroke Scale“ (NIHSS)-gradudierten Schweregrad erfolgen, also auch bei NIHSS < 5 oder > 25 [20, 23]. Dabei muss individuell entschieden werden, ob ein bestimmtes Defizit für den jeweiligen Patienten behindernd ist. Bei milden, nicht behindernden Defiziten kann auf eine Lyse verzichtet werden. Auf mögliche Komplikationen wie (zerebrale) Blutungen oder angioneurotisches Ödem muss das Behandlungsteam vorbereitet sein. Sollte der Beginn unklar sein, z. B. weil Patienten mit ihren Schlaganfallsymptomen erwacht sind („wake-up stroke“), gilt Folgendes: Wenn solche Patienten mehr als viereinhalb Stunden zuvor gesund gesehen wurden, aber innerhalb von viereinhalb Stunden in der Klinik vorgestellt werden und in der MRT ein sog. DWI/FLAIR-Mismatch vorliegt, sollte eine Thrombolyse erfolgen [13, 24], ersatzweise ist dies auch mittels erweiterter CT-Bildgebung möglich. Lässt sich das zeitlich unklare Ereignis auf einen Zeitraum von viereinhalb bis neun Stunden eingrenzen und besteht in CT oder MRT ein Mismatch zwischen Infarktkern und Penumbra, sollte ebenfalls eine Lyse erfolgen [13, 25, 26]. Letztgenanntes Mismatch kann heute durch eine automatisierende Software besser erkannt werden. Derzeit laufen Studien zu dem alternativen Thrombolytikum Tenecteplase, das hinsichtlich bestimmter Applikationsaspekte und seiner Wirkung vorteilhaft sein könnte. Weil dieses derzeit in Europa nur für den Herzinfarkt zugelassen ist und die belastbare Evidenz für die relevanten Situationen der AIS-Akuttherapie noch unvollständig ist, kann der Einsatz aktuell noch nicht durchgehend empfohlen werden.
Thrombektomie
Ist bei Patienten mit AIS, behinderndem Defizit und Verschluss eines großen Gefäßes im vorderen Hirnkreislauf innerhalb von sechs Stunden (Zeit von Symptombeginn bis Leistenpunktion) eine Thrombektomie möglich, sollte diese schnellstmöglich erfolgen [5, 10, 27]. Zunehmend werden gute klinische Ergebnisse auch für mehrere Verschlüsse kleinkalibrigerer Gefäße berichtet. Wenn durch erweiterte Bildgebung (z.B. CT-Perfusion, MRT-Perfusion, Darstellung kleiner Infarktkern, Mismatch, Kollateralendarstellung, etc.) im Kontext der klinischen Symptomatik zu vermuten ist, dass rettbares Hirngewebe vorliegt, sollte die Thrombektomie relevanter Verschlüsse von Hirngefäßen des vorderen Kreislaufs auch jenseits des Sechs-Stunden-Zeitfensters so früh wie möglich erfolgen (z. B. bis zu 24 Stunden nach Symptombeginn) [10, 28, 29]. Sie sollte auch jenseits eines Alters von 80 Jahren durchgeführt werden [27, 30]. Patienten, die für eine Thrombektomie in Frage kommen und Thrombolyse-Kriterien erfüllen, sollten letztere auch erhalten, ohne dass sich dadurch die Thrombektomie verzögert. Derzeit laufende
bzw. kürzlich abgeschlossene Studien zur Thrombektomie ohne vorherige Lyse haben bisher keine Ergebnisse erbracht, die den Verzicht auf die Lyse nahelegen würden. Zur Thrombektomie bei Verschluss von Gefäßen des hinteren Hirnkreislaufs (z. B. der lebenswichtigen A. basilaris) lauteten die Leitlinienempfehlungen von 2021 noch, dass bei solchen Patienten frühestmöglich eine Thrombektomie erfolgen sollte, sofern nicht klinische Zeichen wie Koma > 4 Stunden oder ausgefallene Hirnstammreflexe bzw. radiologische Befunde ausgedehnter irreversibler Infarktzeichen dagegen sprechen [13, 31]. Bis vor kurzem gab es allerdings keine überzeugende Evidenz dafür, dass diese zusätzliche Thrombektomie der Lyse allein im hinteren Kreislauf überlegen ist. Sehr aktuell haben aber zwei große randomisierte Studien aus China dies belegt [32, 33]. Die Thrombektomie ist eine komplexe Therapie, zu der nicht nur die Verfügbarkeit einer Angiografie-Einheit und eines interventionellen Neuroradiologen, sondern auch ein peri-interventionelles Management durch darauf spezialisierten Neuro-Anästhesisten oder Neuro-Intensivmediziner gehört, die individuell die optimale Sedierungsart (z. B. Intubationsnarkose) und Blutdrucksteuerung versehen [34]. Der Blutdruck sollte während und in den ersten 24 Stunden nach Thrombektomie ≤ 180/105 mmHg betragen, es kann sinnvoll sein, ihn nach erfolgreicher Rekanalisation auf systolische Werte von 120 bis 160 mmHg einzustellen [10, 35, 36].
Behandlung auf der Stroke Unit
Die frühzeitige Unterbringung auf einer Schlaganfall-Spezialstation („stroke unit“) ist in ihrer Wichtigkeit mindestens so hoch und „wirksam“ einzuschätzen wie die Rekanalisierungsmaßnahmen. In keinem anderen Land ist die Dichte von Stroke Units so hoch wie in Deutschland, und die Qualität der dortigen Behandlung per Monitoring, Protokollen und insbesondere spezialisierten Teams aus Ärzten, Pflegekräften und Therapeuten (Physio- und Ergotherapie, Logopädie, Neuropsychologie) ist beispielhaft. Alle Patienten mit AIS und TIA sollten daher auf einer Stroke Unit behandelt werden. Die Überwachung (Monitoring) sollte mindestens die ersten zwei bis drei Tage umfassen und beinhalten: Blutdruck, Herzfrequenz, EKG (inkl. der Suche nach Vorhofflimmern), Atmung, Sauerstoffsättigung, Körpertemperatur [37]. Auch ein engmaschiges klinisches Monitoring (z. B. alle sechs bis acht Stunden) ist wegen des Risikos einer sekundären Verschlechterung des AIS sinnvoll. Die Dauer des Aufenthalts von Patienten auf der Stroke Unit hängt von Schlaganfallschwere und -ursache, Komplikationen und Komorbiditäten ab und ist damit individuell unterschiedlich. Da Patienten mit AIS in vielen Fällen (z. B. höhergradige Beinlähmung, Mobilisierungseinschränkung, Dehydrierung) ein erhöhtes Thromboembolierisiko haben, ist ein wichtiger Teil der Behandlung auf der Stroke Unit eine Thromboseprophylaxe. Hier ist evidenzbasiert zuvorderst eine intermittierende pneumatische Kompression bei immobilen Patienten zu empfehlen, dies allerdings nicht bei offenen Wunden an den Beinen [38]. Kompressionsstrümpfe sollten nicht verwendet werden [39]. Die gängige Praxis ist aber zumeist die Anwendung niedermolekularer Heparinoide.
Alternativ kann bei immobilen Patienten eine prophylaktische Antikoagulation mit unfraktioniertem Heparin (5000 IU zwei bis dreimal täglich) oder niedermolekularem Heparinoid zum Einsatz kommen [40, 41]. So früh wie möglich (< 24 h) sollte auf der Stroke Unit ein Screening auf Schluckstörung (Dysphagie) durchgeführt werden und dies ggf. weiter abgeklärt werden (z. B. per endoskopischer Schluckdiagnostik). Bei schwerer Dysphagie ist eine enterale Ernährung über Magensonde geboten [42, 43]. Infektionen müssen aktiv gesucht und ggf. frühzeitig antibiotisch behandelt werden. Eine prophylaktische Antibiose ist jedoch nicht zu empfehlen [44]. Ein einzelner, selbstlimitierender epileptischer Anfall nach AIS (= akutsymptomatischer Anfall, „post-stroke seizure“) sollte nicht langfristig mit Antiepileptika behandelt werden, wiederkehrende Anfälle schon. Ein Antiepileptikaprophylaxe sollte nicht erfolgen [45]. Nach AIS wird gehäuft ein Delir („post-stroke delir“) beobachtet, also eine akute Hirnfunktionsstörung, gekennzeichnet durch fluktuierende Störung der Aufmerksamkeit und des Bewusstseins [46]. Da dies mit einem schwerwiegenderen klinischen Verlauf und häufig kognitiven Langzeitfolgen assoziiert ist, sollte auf der Stroke Unit ein Delir-Screening mittels etablierter Scoring-Instrumente durchgeführt werden [47]. Zusätzlich sollten nicht-medikamentöse Maßnahmen zur Delirprävention durchgeführt werden (z. B. frühe Mobilisation, Orientierungshilfen, Licht-/Lärmreduktion, Tag-Nach-Rhythmisierung). Bei Auftreten eines Delirs trotz nichtmedikamentöser Maßnahmen kann symptomorientiert medikamentös behandelt werden. Sollte bei Annahme einer kardialen Emboliequelle die initiale Routinediagnostik inkl. Bildgebung und transthorakaler Echokardiografie die Ursache von AIS oder TIA nicht klären können, sollten die Patienten eine transösophageale Echokardiografie (TEE) erhalten. Auch eine zusätzliche kardiale CT oder MRT kann in der Frühphase Vorteile bei der Klärung der Ätiologie bieten und eventuell eine frühe Sekundärprophylaxe unterstützen. Innerhalb von 24–48 Stunden sollte zur Klärung der Ätiologie eine Darstellung der extra- und intrakraniellen Gefäße per Duplexsonografie, CT- oder MR-Angiografie erfolgen, um so z. B. Gefäßstenosen zu detektieren, die einer frühen Behandlung bedürfen könnten. Im Rahmen der Stroke Unit -Behandlung sollte eine frühe Sekundärprophylaxe eingeleitet werden, die sich nach Infarktätiologie und -ausmaß richtet und z. B. eine Einfach- oder Doppeltthrombozytenaggregationshemmung, eine Antikoagulation, eine Stenoseintervention oder -operation, u. a. beinhalten kann, aber nicht Gegenstand dieser Übersicht ist.
Behandlung auf der neurologischen Intensivstation
Auch wenn die überwiegende Mehrheit aller Patienten mit AIS vollumfänglich auf einer Stroke Unit und im weiteren Verlauf auf einer Post-Stroke Unit bzw. Normalstation behandelt werden kann, ist die Verfügbarkeit einer bzw. die Verlegbarkeit auf eine neurologische(n) Intensivstation sehr wichtig, mitunter lebenswichtig. Eine derart spezialisierte Intensivstation ist dann vonnöten, wenn der Schlaganfall zu einer Instabilität von Vitalfunktionen, also v. a. Atem- und Kreislaufversagen führt, wenn Hemisphären- oder Kleinhirninfarkte durch Schwellung raumfordernd werden, wenn z. B. nach einer Thrombektomie weiter invasiv beatmet werden muss, wenn zusätzlich neurochirurgische Eingriffe erfolgen müssen, oder wenn eine erweiterte Form des bettseitigen Neuromonitorings geboten ist.
Sollte die Klinik nicht über eine neurologisch geleitete Intensivstation verfügen, können ersatzweise schwer betroffene Schlaganfallpatienten auch auf interdisziplinären Intensivstationen behandelt werden, sofern die neurologische Expertise durch engmaschige, regelmäßige Mitbetreuung durch die Neurologie sichergestellt wird, die idealerweise deutlich über das Konsilwesen hinausgeht.
Bei Patienten bis 60 Jahren mit großem, raumforderndem Mediainfarkt sollte innerhalb von 48 Stunden unabhängig von der betroffenen Hirnseite eine dekompressive Hemikraniektomie durchgeführt werden, um Überleben und funktionelles Outcome zu verbessern [48, 49]. Bei Patienten > 60 Jahren kann dies ebenfalls erwogen werden, allerdings muss eine besonders gründliche Evaluation des Patientenwillens bei erheblichem Risiko des Überlebens mit relevanter Behinderung vorausgehen, weil der Benefit der Operation hier v. a. in einem verbesserten Überleben liegt [48, 50–52]. Bei Patienten mit raumforderndem Infarkt des Kleinhirns kann bei (drohendem) Hydrozephalus die Anlage einer externen Ventrikeldrainage erfolgen [53], zusätzlich sollten diese eine subokzipitale Dekompression erhalten, um vor sekundären Kompressionsschäden des Hirnstamms zu schützen [53]. Der Nutzen einer therapeutischen Hypothermie ist unklar, in Kombination mit einer Dekompression nach raumforderndem Mediainfarkt sollte diese nicht erfolgen [48, 54, 55]. Die Osmotherapie bei AIS-assoziiertem Hirnödem kann ergänzt werden, um Überleben und neurologisches Outcome zu verbessern [29].
Prof. Dr. med. Julian Bösel, 1. Vize-Präsident der Deutschen Gesellschaft für Neuro- Intensiv- und Notfallmedizin (DGNI); Regionalbeauftragter der Deutschen Schlaganfall-Hilfe (DSH); Goethestr. 74, 34119 Kassel, Kontakt: mail@julian-boesel.de
Die Literaturhinweise finden Sie am Ende dieser Seite unter „Artikel herunterladen“ in der PDF-Version dieses Artikels.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Time is brain – Update Akuttherapie des ischämischen Schlaganfalls“ von Prof. Dr. med. Julian Bösel finden Sie am Ende dieser Seite im PDF unter „Artikel herunterladen“ sowie im Portal (https://portal.laekh.de). Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Portal vom 25. Mai 2023 bis 24. November 2023 möglich. Die Fortbildung ist mit zwei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben.
Dieser Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben des Autors sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte.