Dr. med. Andreas Klinge, Dr. med. Günther Egidi, Prof. Dr. med. Ulrich A. Müller
Der Artikel ist ein genehmigter Nachdruck aus Arzneiverordnung in der Praxis (AVP) Band 49, Heft 4, Dezember 2022, abrufbar auf der Website der Arzneimittelkommission der deutschen Ärzteschaft.
Der Artikel basiert auf: Müller UA, Egidi G, Klinge A: Elsevier Essentials: Diabetes. Das Wichtigste für Ärztinnen und Ärzte aller Fachrichtungen Diabetes. 1. Auflage. München: Urban & Fischer/Elsevier, 2021. ISBN: 9783437214219.
Einleitung
Typ-2-Diabetes mellitus (T2DM) ist eine häufige Erkrankung. 6–8 % der Gesamtbevölkerung sind davon betroffen. Dies entspricht mehr als 6,5 Millionen Personen in Deutschland. T2DM entwickelt sich zumeist langsam. Typische Hyperglykämiesymptome wie Polydipsie, Polyurie, Müdigkeit und ungewollter Gewichtsverlust sind häufig nicht vorhanden, werden nicht erkannt oder dem normalen Älterwerden zugeschrieben.
Therapieziele bei Diabetes mellitus
Welche Therapieziele sollen für jüngere und ältere Patienten mit Typ-2-Diabetes gesetzt werden?
Die Senkung deutlich erhöhter Glukosewerte bzw. HbA1c-Werte beseitigt Symptome einer Hyperglykämie und kann diabetische Folgeerkrankungen vermindern. Je höher der HbA1c-Wert vor Beginn oder Intensivierung der Glukosesenkung ist, umso höher ist auch der Nutzen zur Vermeidung von Folgeerkrankungen. Für eine HbA1c-Senkung unter 7,0 % konnte in randomisierten Interventionsstudien kein Nutzen hinsichtlich einer Reduktion von Mortalität und mikrovaskulären Endpunkten nachgewiesen werden.
Schlussfolgerung:
In keiner der Interventionsstudien konnte der Nettonutzen einer Senkung des HbA1c unter 7,0 % belegt werden.
Bitte beachten!
Bei Typ-2-Diabetes kann eine zu starke medikamentöse Senkung des HbA1c unter 7,0 % sogar mehr schaden als sie nützt.
HbA1c-Zielwerte
Diabetes mellitus bedeutet ein unterschiedliches Risiko für ältere und jüngere Patienten – dementsprechend brauchen wir unterschiedliche HbA1c-Ziele. In den westlichen Ländern ging die Sterblichkeit an T2DM in den vergangenen Jahrzehnten deutlich zurück, in den USA z. B. im Vergleich der Jahre 1988–1994 und 2010–2015 von 23,1 auf 15,2 pro 1.000 Personenjahre. Diese Tendenz war bei Männern und bei den 65–74-Jährigen am stärksten ausgeprägt. Bei den 20–44-Jährigen konnte sie nicht nachgewiesen werden. Interessanterweise sank die Sterblichkeit bei Menschen mit Diabetes stärker als bei Personen ohne Diabetes. Damit verlor die Krankheit einen Teil ihrer Übersterblichkeit.
In Schweden wurde 2018 eine Untersuchung veröffentlicht, die zeigte: Das Risiko von Menschen mit Diabetes unterschied sich nicht von dem Stoffwechsel Gesunder, wenn keine weiteren kardiovaskulären Risikofaktoren bestanden [1]. Bei Menschen mit Diabetes war die Höhe des HbA1c der stärkste Prädiktor für Herzinfarkt und Schlaganfall.
Das ist die Rationale dafür, dass das durchschnittliche HbA1c des zurückliegenden Jahres in den hausärztlichen Risikorechner für das kardiovaskuläre Risiko arriba®1 eingefügt wurde.
Das Ausmaß der durch einen Diabetes erhöhten Sterblichkeit hängt nach einer schwedischen Untersuchung wesentlich vom Alter ab. Unabhängig vom Alter ging sie deutlich zurück. Bei der jüngsten Erhebung war sie bei den unter 55-Jährigen mit Diabetes noch mehr als verdoppelt im Vergleich zu Stoffwechselgesunden. Bei den über 75-Jährigen unterschied sie sich dagegen kaum noch von der von Menschen ohne Diabetes [2].
Generell ging in den westlichen Ländern die Sterblichkeit bei Menschen mit Diabetes noch stärker zurück als bei Personen ohne die Krankheit. Vermutlich liegt der Rückgang der Sterblichkeit nicht nur an einer Senkung der Blutglukose, sondern eher an der Behandlung anderer Risikofaktoren und dem allgemeinen Rückgang des Rauchens.
HbA1c-Richtwerte
Wenn Antidiabetika eingesetzt werden, sollte im Allgemeinen ein HbA1c zwischen 7,0 und 8,0 % angestrebt werden. Bei über 75-jährigen Menschen und/oder Personen mit Lebenserwartung von bis zu zehn Jahren reicht es meist aus, das HbA1c nicht über 8,5 % ansteigen zu lassen.
Bei der Nationalen Versorgungsleitlinie (NVL) Typ-2-Diabetes [3] haben sich die Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) und die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) für HbA1c-Ziele von 7,0–8,0 % im Allgemeinen und bei den über 75-Jährigen bzw. bei Menschen mit einer Lebenserwartung unter zehn Jahren von unter 9,0 % eingesetzt. Bei HbA1c > 9,0 % wird ein Diabetes oft symptomatisch (Durst, Harndrang, Schwäche). Die Schwelle dafür kann im Einzelfall höher oder auch niedriger liegen. Die Patienten sollten genau nach Symptomen gefragt werden – oft berichten sie sonst erst rückblickend nach einer Besserung der Stoffwechselsituation. Das Disease Management Programm (DMP) Diabetes ist eine gute Gelegenheit, solche Fragen zu stellen.
Empfehlungen der NVL Diabetes
Zwischen Arzt und Patient sollen regelmäßig gemeinsam individuelle Therapieziele vereinbart werden. Dabei soll in verständlicher Form eine vollständige Aufklärung über Nutzen und Schaden erfolgen. Das Ergebnis der gemeinsamen Entscheidungsfindung soll dokumentiert werden. Dabei sollen Patientenpräferenzen, Alter, Komorbidität und Art der eingesetzten Therapie berücksichtigt werden.
Generell sollte bei der medikamentösen Behandlung jüngerer und sonst gesunder Patienten mit T2DM ein HbA1c nahe am unteren Zielwert von 7,0 % angestrebt werden, wenn dies nicht zu relevanten Hypoglykämien führt. Bei den über 70-Jährigen und/oder bei Personen mit eingeschränkter Lebenserwartung, eingeschränkten funktionellen und kognitiven Fähigkeiten und ausgeprägter Komorbidität/Multimedikation sollten eher weniger ehrgeizige HbA1c-Ziele angestrebt werden.
Ansonsten ist die Nierenfunktion entscheidungsrelevant: Metformin und Sulfonylharnstoffe sind bei höhergradiger Einschränkung der Nierenfunktion kontraindiziert. Mit Insulin kann dann behandelt werden, aber da Insulin über die Niere ausgeschieden wird, ist hier besonders aufmerksam auf mögliche Hypoglykämien zu achten.
Für die verschiedenen Natrium-Glukose-Cotransporter-2-(SGLT-2)-Inhibitoren (Gliflozine) und Glucagon-like-Peptid-1-(GLP-1)-Rezeptor-Agonisten gelten unterschiedliche Zulassungen bzw. Kon-traindikationen bei schwerer Niereninsuffizienz. Die jeweiligen aktuellen Fachinformationen müssen beachtet werden. Vgl. Abb. 1 „HbA1c-Zielkorridor“.
Therapie des T2DM mit oralen Antidiabetika und GLP-1-Rezeptor-Agonisten
Einleitung
- Orale Antidiabetika und GLP-1-Rezeptor-Agonisten sind der nächste Schritt in der Stufentherapie des T2DM, wenn nichtmedikamentöse Therapiemöglichkeiten/Basistherapie ausgeschöpft sind und die Patienten das individuell vereinbarte Therapieziel nicht mehr erreichen.
- Die Basistherapie (Steuerung von Essen und Trinken sowie ggf. der Bewegung, Schulung, ggf. Stoffwechselselbstkontrolle) wird aber nicht beendet und hat auch unter jeder pharmakologischen Therapie einen wichtigen Stellenwert.
Vor Beginn einer pharmakologischen antidiabetischen Therapie sollte geklärt werden:
- Soll Symptomfreiheit erhalten bzw. erreicht werden? Dies gilt oft für ältere Menschen.
- Oder sollen – vorrangig bei Jüngeren – Folgeschäden verhindert werden?
- Die Therapie sollte mit Substanzen erfolgen, für die die Wirksamkeit auf klinische und patientenrelevante Endpunkte nachgewiesen wurde.
Antidiabetika mit gesicherter günstiger Beeinflussung klinischer und patientenrelevanter Endpunkte
Metformin (Biguanide)
- Metformin aktiviert die AMP-Kinase in der Leber und stimuliert die Ausschüttung von Glucagon-like-Peptid-1 (GLP-1) im Dünndarm. Dadurch kommt es zur Hemmung der Glukagonausschüttung und zur Verminderung der hepatischen Glukoseproduktion.
- Vorteil der Substanz sind die große Erfahrung, die Verbesserung von patientenrelevanten mikro- und makrovaskulären Endpunkten und der Mortalität sowie die fehlende bis minimale Hypoglykämieneigung.
- Nachteilig bei Metformin sind gastrointestinale Nebenwirkungen (Diarrhö, Bauchkrämpfe, Metallgeschmack), die initial bei jedem fünften Patienten auftreten. Bei Beginn mit einer niedrigen Dosis von 500 mg abends und langsamer Dosissteigerung lassen sich Nebenwirkungen häufig vermeiden. Bei chronischer Niereninsuffizienz mit einer eGFR von < 30 ml/min, Azidose, Hypoxie, Dehydratation ist Metformin kontraindiziert.
- Metformin führt in der Monotherapie zu einer mittleren HbA1c-Senkung von 1,3 %.
- Metformin ist eine kostengünstige Therapie. Die Tagestherapiekosten liegen bei etwa 0,16–0,18 Euro2.
Dosierung
- Metformin ist bis zu einer Dosierung von 3000 mg/d zugelassen. Diese Maximaldosis sollte in der Regel aber nicht ausgeschöpft werden.
- Eine sinnvolle Höchstdosis (Kreatinin-Clearance ≥ 50 ml/min) liegt bei jüngeren Patienten bei 2 x 1000 mg/d und bei betagten Patienten bei 2 x 500 mg/d.
- Bei einer Kreatinin-Clearance von 30–50 ml/min darf eine Dosis von 2 x 500 mg/d nicht überschritten werden. Hier sollte initial mit einer Tagesmaximaldosis 500 mg begonnen werden.
Laktatazidose unter Metformin ist sehr selten, aber eine schwerwiegende metabolische Komplikation. Meist spielen hier andere Faktoren (Komedikation, schwerste Hypoxie, akutes Nierenversagen, vorbestehende Niereninsuffizienz, usw.) eine Rolle. Bei akuter Verschlechterung der Nierenfunktion kommt es zur Kumulation von Metformin, die das Risiko einer Laktatazidose erhöht.
Informationen für Patienten
- Durch akute Erkrankungen, speziell Durchfallerkrankungen oder fieberhafte Infekte, kann sich eine vormals > 30 ml/min gelegene Kreatinin-Clearance rasch verschlechtern. Daher soll darüber informiert werden, dass in einer solchen Situation Metformin vorübergehend pausiert werden soll.
- Um die relativ häufigen gastrointestinalen Nebenwirkungen zu reduzieren, sollte Metformin grundsätzlich während oder nach einer Mahlzeit eingenommen werden.
Sulfonylharnstoffe (Glibenclamid,
Glimepirid)
- Sulfonylharnstoffe sind starke Senker der Blutglukose. Sie stimulieren die Insulinsekretion über die Schließung der KATP-Kanäle auf der β-Zell-Membran. Die 2. Generation umfasst Glibenclamid, Glipizid und Gliclazid, die 3. Generation Glimepirid. Sulfonylharnstoffe können bei Unverträglichkeit von Metformin eingesetzt werden.
- Für Glibenclamid und Gliclazid wurden in Langzeitstudien Endpunktverbesserungen nachgewiesen, was für die Sulfonylharnstoffe der 3. Generation (Glimepirid) nicht zutrifft.
- 2019 erschien mit dem CAROLINA-Trial eine Vergleichsstudie zwischen einem Dipeptidylpeptidase (DPP) 4-Hemmer und Glimepirid [4]. Hier zeigte sich hinsichtlich der Qualität der Stoffwechsellage, dem Gewichtsverlauf und insbesondere der kardiovaskulären Sicherheit kein Unterschied zwischen beiden Wirkstoffen.
- Mit Sulfonylharnstoffen besteht große Erfahrung, zudem sind sie kostengünstig. Die blutglukosesenkende Wirkung nimmt im Verlauf ab, da die Inselzellfunktion nachlässt, wofür auch die dauerhafte Stimulation der Insulinsekretion unter Sulfonylharnstoffen verantwortlich gemacht wird. Nach etwa zehn Jahren ist zumeist das Sekundärversagen erreicht, es sei denn es liegt ein MODY-Diabetes3 vor. Bei letzterem ist eine erfolgreiche Therapie über mehrere Jahrzehnte möglich.
- Als Nachteil gelten eine Hypoglykämieneigung (Hypoglykämierate: 0,5–1 Ereignis pro Patientenjahr) und eine relativ geringe (nie > 2 kg) Gewichtszunahme [5]. Risikofaktoren für schwere Unterzuckerungen sind hohes Lebensalter, Niereninsuffizienz und HbA1c < 7 %. Bei mäßiger Niereninsuffizienz (eGFR ≥ 30 ml/min) ist die Gesamtelimination nicht verändert; bei schwerer Niereninsuffizienz ist eine Kumulation möglich. Bei schwerer Niereninsuffizienz (eGFR ≤ 30 ml/min) sind Sulfonylharnstoffe kontraindiziert. Die Dosierung von Sulfonylharnstoffen erfolgt 1–2 x/d.
- Sulfonylharnstoffe sind eine kostengünstige Therapie. Die Tagestherapiekosten liegen bei etwa 0,20–0,25 Euro.
- Die sehr seltenen schweren Hypoglykämien unter Sulfonylharnstoffen sollten grundsätzlich Anlass für eine stationäre Einweisung sein, da sowohl Glibenclamid als auch Glimepirid eine lange Halbwertszeit haben und somit zu einem späteren Zeitpunkt erneut zur Hypoglykämie führen können.
- Schwere Hypoglykämien können verhindert werden, wenn Sulfonylharnstoffe in folgenden Konstellationen abgesetzt oder pausiert werden: HbA1c unter 7 %, postprandiale Blutglukose < mmol/l (180 mg/dl), Harnglukose postprandial immer negativ, Einschränkung der Nierenfunktion mit eGFR unter 40 ml/min.
Dosierung
- Traditionell wird Glibenclamid zweimal täglich (morgens und abends) und Glimepirid einmal täglich (morgens) gegeben. Die Einmalgabe wird als Vorteil des Glimepirid angegeben. Aus Sicht der Pharmakokinetik unterscheiden sich die Substanzen kaum. Auch Glibenclamid kann einmal am Tag gegeben werden.
- Die Startdosis liegt für Glibenclamid bei 1,75 mg einmal täglich, für Glimepirid bei 1 mg einmal täglich. Sinnvolle Höchstdosierungen liegen für Glibenclamid bei drei Tabletten zu 3,5 mg und für Glimepirid bei einmalig 3 mg/d.
Informationen für Patienten
- Wenn eine Therapie mit einem Sulfonylharnstoff begonnen wird, soll über die Symptome von Hypoglykämien und die richtigen Gegenmaßnahmen informiert werden.
- Wie bei allen Substanzen mit einem Hypoglykämierisiko ist es ratsam, dass die Patienten über die Möglichkeit zur Blutzucker-Selbstmessung verfügen, um Hypoglykämien von anderen Körperzuständen sicher unterscheiden zu können.
GLP-1-Rezeptor-Agonisten
- Die Analoga des Inkretinhormons GLP-1 binden an den GLP-1-Rezeptor und führen zur Freisetzung von Insulin aus den β-Zellen, zur Hemmung der Glukagonsekretion, zur zentralen Hemmung des Appetits und zu einer Verzögerung der Magenentleerung. Alle bisher verfügbaren GLP-1-Analoga müssen mit einem Pen durch den Patienten selbst gespritzt werden. In Deutschland sind im Handel: Exenatid und Liraglutid mit täglicher Injektion; Exenatid als Long-acting release, Dulaglutid, Albiglutid und Semaglutid mit wöchentlicher Injektion.
- Ein gruppenspezifischer Effekt zur Verminderung kardiovaskulärer und renaler Komplikationen beim Typ-2-Diabetes wird angenommen, der jedoch bei verschiedenen Substanzen unterschiedlich ausgeprägt ist [6]. Für Liraglutid wurde in der LEADER-Studie [7] neben einer reduzierten kardiovaskulären Mortalität auch eine Reduktion der Entwicklung einer Makroalbuminurie nachgewiesen. Vergleichbare Resultate konnten für die GLP-1-Rezeptor-Agonisten Albiglutid (in Deutschland noch nicht erhältlich) und Semaglutid gezeigt werden [6]. Aktuell ist Liraglutid die am besten untersuchte Substanz. Weitere Vorteile der GLP-1-Agonisten sind die geringe Hypoglykämiegefahr und eine Gewichtsabnahme von etwa 2,8 kg. Bei kardiovaskulären Risikopatienten wird die kardiovaskuläre Mortalität um absolut 1,4 % vermindert. Liraglutid ist für Diabetespatienten mit eingeschränkter Nierenfunktion besonders interessant, denn bei genauerer Betrachtung hat ausschließlich die Patientengruppe mit manifester kardiovaskulärer Erkrankung und moderat eingeschränkter Nierenfunktion einen Nutzen. Für ältere Patienten ohne das Therapieziel Lebensverlängerung kann auch Dulaglutid mit einer Injektion pro Woche eine Option sein.
- GLP-1-Rezeptor-Agonisten gehören zu den kostenintensiven Therapien. Die Tagestherapiekosten liegen bei 4,00–6,00 Euro.
Dosierung
- Die Therapie mit den ein- oder zweimal täglich zu injizierenden GLP-1-Rezeptor-Agonisten wird mit einer niedrigeren Dosis begonnen, um die gastrointestinale Nebenwirkungen zu minimieren (Exenatid zweimal täglich 5 μg, Liraglutid einmal täglich 0,6 mg). Im Verlauf von einer Woche wird die Dosis dann auf die Enddosis verdoppelt (Exenatid zweimal täglich 10 μg, Liraglutid einmal täglich 1,2 bis max. 1,8 mg).
- Exenatid in Bydureon® wird mit 2 mg einmal pro Woche, Dulaglutid wird mit 0,75 mg pro Woche begonnen und kann auf 1,5 mg (oder mehr) einmal pro Woche gesteigert werden. Albiglutid wird mit 30 mg einmal pro Woche dosiert.
Ausgewählte Nebenwirkungen
- Übelkeit tritt bei etwa jeder fünften behandelten Person, Erbrechen bei jeder zwanzigsten sowie Durchfall bei jeder zehnten auf. Diese unerwünschten Wirkungen treten zu Beginn der Therapie häufiger auf als im weiteren Verlauf.
- Ob die Gewichtsabnahme durch die gewünschten oder unerwünschten Effekte der GLP-1-Rezeptor-Agonisten erklärt werden kann, oder durch eine Kombination von beiden, ist nicht vollständig geklärt.
- Akute Pankreatitis ist eine mittlerweile bekannte Nebenwirkung. Bei einer chronischen oder akuten Pankreatitis sollte vom Einsatz der GLP-1-Rezeptor-Agonisten Abstand genommen werden.
Informationen für Patienten
- Es soll über die Nebenwirkungen der GLP-1-Rezeptor-Agonisten informiert werden und auch darüber, dass das Medikament im Zweifel wieder abgesetzt werden kann.
SGLT-2-Inhibitoren
- SGLT-2-Inhibitoren (Gliflozine) hemmen die Natrium-Glukose-Cotransporter vom Typ 2 (SGLT-2) im proximalen Nephron. Dadurch werden die Glukoserückresorption vermindert und die Glukose- und Natriumausscheidung erhöht. Schon bei normalen Blutglukosewerten ist dann eine Glukosurie vorhanden. SGLT-1-Transporter im distalen Tubulus werden nicht gehemmt, sodass es nicht zu Hypoglykämien kommt. In Deutschland stehen Empagliflozin, Dapagliflozin und Ertugliflozin zur Verfügung.
- Fast die gesamte Substanzgruppe vermindert bei Patienten mit manifester kardiovaskulärer Erkrankung kardiovaskuläre Ereignisse. Nur für Ertugliflozin konnten keine positiven Effekte in einer kardiovaskulären Endpunktstudie nachgewiesen werden. Unabhängig vom Vorhandensein einer kardiovaskulären Erkrankung besteht ein Nutzen zur Reduktion von Hospitalisationen wegen Herzinsuffizienz und Nephropathie. Empagliflozin senkte in der EMPA-REG-OUTCOME-Studie kardiovaskuläre Komplikationen um absolut 1,6 %, die Mortalität um 2,5 % und einen kombinierten Endpunkt zur Nephropathie (Verdoppelung des Serumkreatinins bei Patienten mit eGFR ≤ 45 ml/min/1,73 m2, Beginn einer Nierenersatztherapie oder Tod durch Nierenerkrankungen) um 5,2 % [8].
- SGLT-2-Inhibitoren wirken über eine Reduktion der Hyperfiltration direkt nephroprotektiv. Sie führen aufgrund der Natriumausscheidung zu einer besseren Blutdruckkontrolle und die Patienten nehmen ab, da durch die Glukosurie letztendlich „Energie“ verloren geht. Zu den potenziellen Nebenwirkungen gehören genitale Infektionen (vor allem durch Pilze), Harnwegsinfektionen (die im klinischen Alltag häufiger zu Therapieabbrüchen führen als in klinischen Studien), Polyurie, Volumenmangel, Hypotension, Schwindel, ein meist vorübergehender Kreatininanstieg (aufgrund der initialen Reduktion der Hyperfiltration) sowie, in manchen Erhebungen, eine geringe Zunahme von Amputationen an der unteren Extremität. Sehr selten (d. h. weniger als ein Ereignis auf 1.000 Patientenjahre) treten euglykämische Ketoazidosen auf.
- Bei moderater Niereninsuffizienz soll Empagliflozin nicht höher als mit 10 mg dosiert werden. Hinsichtlich des Outcomes unterschieden sich die Dosierungen von 10 und 25 mg Empagliflozin in EMPA-REG-OUTCOME nicht. Bei einer eGFR < 45 ml/min soll die Therapie bislang noch beendet werden. Die Nierenfunktion sollte bei Beginn einer Therapie mit SGLT-2-Inhibitoren engmaschig kontrolliert werden, da es vor allem bei älteren Menschen durch die diuretische Wirkung zum Volumenmangel mit akutem Nierenversagen kommen kann. Besondere Vorsicht ist bei Zuständen mit möglichen Volumenverlusten (Durchfall, Fieber usw.) sowie Komedikation mit Thiazid- und Schleifendiuretika geboten. Die Diuretikadosen sollten jeweils angepasst werden. SGLT-2-Inhibitoren sollten mit Metformin kombiniert werden.
- SGLT-2-Inhibitoren liegen preislich im oberen Mittelfeld der hier geschilderten Therapien. Die Tagestherapiekosten liegen bei etwa 1,15–2,75 Euro.
Dosierung
- Die empfohlene Dosierung beträgt sowohl für Dapagliflozin als auch für Empagliflozin je 10 mg einmal täglich.
- Die für Empagliflozin verfügbare Dosierung von 25 mg/d hat sich in den Studien in ihrem Wirkungs- oder Nebenwirkungsprofil von der 10-mg-Dosierung nicht unterschieden.
Ausgewählte Nebenwirkungen
- Die Glukosurie führt zu einer osmotischen Diurese und zu einem leichten Anstieg des Hämatokrits. Bei älteren Menschen die nicht ausreichend trinken, kann dies zu einer Exsikkose führen.
- Unter SGLT-2-Inhibitoren kann eine nekrotisierende Fasziitis des Perineums (Fournier-Gangrän) bei weiblichen und männlichen Patienten auftreten. Der Diabetes mellitus stellt an sich ein erhöhtes Risiko für das Auftreten dieses Krankheitsbildes dar. Die Häufigkeit liegt aber unter den SGLT-2-Inhibitoren höher als unter anderen Therapieformen. Bei Fournier-Gangrän handelt es sich um ein seltenes, aber schwerwiegendes und potenziell lebensbedrohliches Ereignis, das einen dringenden chirurgischen Eingriff und eine Behandlung mit Antibiotika erfordert. Patienten sollten einen Arzt aufsuchen, wenn Schmerzen, Berührungsempfindlichkeit, Erythem oder Schwellungen im Bereich der Genitalien oder des Perineums gleichzeitig mit Fieber oder Unwohlsein auftreten.
- Ebenfalls sicherheitsrelevant unter den SGLT-2-Inhibitoren sind Ketoazidosen bei nur gering erhöhten Glukosewerten [9]. Es wird empfohlen, SGLT-2-Inhibitoren im Fall von schweren Erkrankungen mit stationärer Behandlung sowie bei operativen Eingriffen vorübergehend abzusetzen.
Informationen für Patienten
- Es soll über mögliche Genitalinfektionen informiert werden, damit eine Behandlung dieser Komplikationen ggf. frühzeitig erfolgen kann.
- Und es soll dazu geraten werden, SGLT-2-Inhibitoren bei schweren akuten Erkrankungen oder operativen Eingriffen nach Rücksprache mit dem behandelnden Arzt zu pausieren.
Antidiabetika ohne gesicherte günstige Beeinflussung klinischer und patientenrelevanter Endpunkte
Glinide (Repaglinid, Nateglinid)
- Aus der Gruppe der Glinide ist in Deutschland nur Repaglinid verfügbar. Wie Sulfonylharnstoffe stimulieren Glinide die Insulinsekretion. Die Dosierung erfolgt vor den Hauptmahlzeiten, also meist dreimal täglich. Endpunktstudien liegen zu Gliniden nicht vor. Repaglinid darf nur bei eGFR < 25 ml/min zulasten der GKV verordnet werden, Nateglinid gar nicht.
- Die Tagestherapiekosten liegen bei etwa 0,50–0,80 Euro.
DPP-4-Inhibitoren
- DPP-4-Inhibitoren bremsen die Aktivität der Dipeptidylpeptidase(DPP)-4 und verzögern so den Abbau der postprandial ausgeschütteten Inkretinhormone GLP-1 und GIP. Die längere Wirkung von GLP-1 führt zur Steigerung der Insulinsekretion und Hemmung der Glukagonsekretion. Zur Verfügung stehen: Sitagliptin, Vildagliptin und Saxagliptin.
- DPP-4-Inhibitoren sind schwache Senker des HbA1c und führen oft zu Therapieversagen. Sie bedingen weder Gewichtszunahme noch -reduktion.
- Mit der TECOS-Studie liegt für Sitagliptin eine Studie zur kardiovaskulären Sicherheit vor. Nach einem mittleren Beobachtungszeitraum von drei Jahren zeigte sich für den kombinierten Endpunkt (kardiosvaskulärer Tod, nichttödlicher Herzinfarkt, nichttödlicher Schlaganfall oder Hospitalisierung wegen instabiler Angina Pectoris) kein Vorteil für die mit Sitagliptin behandelte Gruppe [10].
- Die Tagestherapiekosten liegen bei etwa 0,35–1,00 Euro.
Dosierung
- Sitagliptin und Saxagliptin werden in 100 mg bzw. 5 mg einmal täglich dosiert. Vildagliptin in 50 mg zweimal täglich.
- Eine Dosisreduktion ist bei Sitagliptin notwendig: eGFR ≤ 45 ml/min: 50 mg und GFR ≤ 30 ml/min: 25 mg; Saxagliptin: eGFR < 45 ml/min: 2,5 mg; Vildagliptin eGFR ≤ 50 ml/min: 1 x 50 mg. Bei einer eGFR ≤ 15 ml/min können Sitagliptin und Vildagliptin in reduzierter Dosis gegeben werden.
Ausgewählte Nebenwirkungen
- DPP-4-Inhibitoren verursachen nur sehr selten Hypoglykämien. Als Nebenwirkungen können Angioödem, Urtikaria und andere immunvermittelte Hauteffekte auftreten und es kann zu Nebenwirkungen am Pankreas, zu einem signifikanten Anstieg von Hospitalisationen wegen Herzinsuffizienz durch Saxagliptin sowie zu einer geringen, aber signifikanten Zunahme der Retinopathie durch Sitagliptin kommen. DPP-4-Inhibitoren können auch bei Niereninsuffizienz eingesetzt werden.
- Auch bei den DPP-4-Inhibitoren können akute Pankreatitiden auftreten. Bei einer Vorgeschichte einer chronischen oder akuten Pankreatitis sollte vom Einsatz von DPP-4-Inhibitoren Abstand genommen werden.
Tab. 1: Wirkmechanismen von Antidiabetikan (mit jeweils einem Wirkstoff als Beispiel) | |
Wirkmechanismus | Beispiele |
setzen Insulin frei | Sulfonylharnstoffe (Glibenclamid), Glinide (Repaglinid), Inkretinverstärker (Sitagliptin), GLP-1-Rezeptor-Agonisten (Liraglutid) |
hemmen die Glukagonsekretion | Metformin, Inkretinverstärker (Sitagliptin), GLP-1-Rezeptor-Agonisten (Liraglutid) |
verbessern die Insulinwirkung | Glitazone (Pioglitazon) |
hemmen die Kohlenhydratverdauung | Disaccharidasehemmer (Acarbose) |
hemmen den Appetit/ die Magenentleerung | Dipeptidyl-Peptidase-4-(DPP4)-Inhibitoren (Sitagliptin), GLP-1-Rezeptor-Agonisten (Liraglutid), Metformin |
steigern die Glukoseausscheidung über die Niere | Natrium-Glukose-Cotransporter-2-(SGLT-2)-Inhibitoren (Empagliflozin) |
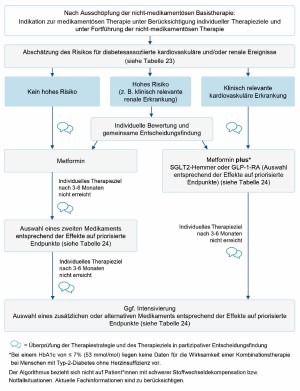
Algorithmus „Medikamentöse Therapie des T2DM“
Der in Abb. 2 dargestellte Algorithmus „Medikamentöse Therapie des T2DM“ stammt aus der NVL Typ-2-Diabetes und bildet die gemeinsame Sichtweise der verschiedenen Fachgesellschaften und Organisationen auf Basis systematischer Recherchen ab. Der Algorithmus bezieht sich nicht auf Patienten mit schwerer Stoffwechseldekompensation bzw. Notfallsituationen.
Therapie bei Patienten mit niedrigem kardiovaskulärem Risiko
- Substanz der ersten Wahl ist Metformin. Wenn Metformin allein nicht ausreicht, um das individuell vereinbarte HbA1c-Ziel zu erreichen, sollte die Therapie um Glibenclamid erweitert werden. Konkret wird dies empfohlen für unter 70-Jährige mit HbA1c > 8,0 % und über 70-Jährige mit HbA1c > 8,5 %.
- Anders als von unterschiedlichen Seiten suggeriert, haben die Sulfonylharnstoffe Glibenclamid und Glimepirid kein kardiovaskuläres Schadpotenzial, wenn sie nicht zu Hypoglykämien führen. Wenn keine zu niedrigen HbA1c-Ziele (< 7,5 %) angestrebt werden, ist das Hypoglykämierisiko sehr gering. Für Glibenclamid konnte in der ADOPT-Studie [11] sogar ein kardiovaskulärer Nutzen belegt werden, Glimepirid erwies sich in der CAROLINA-Studie [4] als kardiovaskulär unschädlich.
- Wegen der insgesamt schlechten Datenlage zu Kombinationstherapie, die mit Ausnahme von Metformin nicht ausreichend untersucht erscheint, sollten Zweifachkombinationen insbesondere mit Metformin erfolgen und Dreifachkombinationen möglichst vermieden werden. Werden Sulfonylharnstoffe eingesetzt, soll Metformin nicht abgesetzt werden.
Therapie bei Patienten mit manifester kardiovaskulärer Erkrankung
- Bei manifester kardiovaskulärer Erkrankung ergab sich in Studien ein relevanter Vorteil für eine Kombination SGLT-2-Inhibitoren oder GLP-1-Rezeptor-Agonisten, wenn das individuelle HbA1c-Ziel mit Metformin allein nicht erreicht werden konnte. In dieser Patientengruppe konnte eine verringerte Mortalität gezeigt werden.
- Für den Nutzen von Empagliflozin oder Liraglutid bei Personen mit kardiovaskulären Erkrankungen und einem HbA1c unter 7,0 % gibt es bisher keine ausreichende Evidenz.
Therapie bei hohem kardiovaskulärem Risiko
- Bei Patienten mit hohem kardiovaskulärem Risiko, aber ohne bislang eingetretene kardiovaskuläre Erkrankungen, sollten die oben genannten SGLT-2-Inhibitoren bzw. GLP-1-Rezeptor-Agonisten nur angeboten werden, wenn Glibenclamid wegen eines spezifisch erhöhten individuellen Hypoglykämie-Risikos nicht infrage kommt.
- Die Definition eines hohen kardiovaskulären Risikos wird von unterschiedlichen Fachgesellschaften sehr unterschiedlich empfohlen. Die European Society of Cardiology wertet schon das Vorliegen eines T2DM oder einer chronischen Niereninsuffizienz als KHK-Äquivalent. Dieser Sichtweise können sich die Autoren nicht anschließen. Wir empfehlen die Verwendung des arriba®-Rechners (www.arriba-hausarzt.de).
Therapie bei Patienten mit fortgeschrittener Niereninsuffizienz
- Metformin und Sulfonylharnstoffe können jedoch bei nachlassender Nierenfunktion ab einer GFR < 60 ml/min nur noch bedingt eingesetzt werden, ab einer GFR < 30 ml/min sind sie kontraindiziert. Für den sachgerechten Einsatz von oralen Antidiabetika bei Menschen mit T2DM und Niereninsuffizienz ist die Kenntnis der aktuellen Nierenfunktion (eGFR) essenziell. Bei unzureichender Stoffwechselführung unter oralen Antidiabetika oder GLP-1-Rezeptor-Agonisten kann ein Versuch mit dem allerdings nur schwach wirksamen Sitagliptin versucht, ansonsten Insulin eingesetzt werden. In Tab. 2 sind die Kriterien für die Auswahl der medikamentösen Therapie und deren Intensivierung.
Tab. 2: Antidiabetika bei Niereninsuffizienz | ||||
Wirkstoff | Dosis | CKD 3 (GFR 60–30 ml/min) | CKD 4 (GFR 29–15 ml/min) | CKD 5 (GFR < 15 ml/min) |
Acarbose | 3 x 50 mg bis 3 x 200 mg | möglich | kontraindiziert bei GFR < 25 ml/min | kontraindiziert |
Dapagliflozin | 5–10 mg | möglich, keine Dosisanpassung | GFR < 25 ml/min: nicht empfohlen | nicht empfohlen |
Dulaglutid | 0,75–1,5 mg/Woche | möglich, keine Dosisanpassung | möglich, keine Dosisanpassung | nicht empfohlen |
Empagliflozin | 10–25 mg | 10 mg | nicht empfohlen | nicht empfohlen |
Exenatid | 2 x 5 bis 2 x 10 μg | 2 x 5 μg | nicht empfohlen | nicht empfohlen |
Glibenclamid | 1,75–10 mg | mit Vorsicht einsetzen | kontraindiziert | kontraindiziert |
Glimepirid | 1–6 mg | mit Vorsicht einsetzen | kontraindiziert | kontraindiziert |
Gliquidon | 30–90 mg | mit Vorsicht einsetzen | kontraindiziert | kontraindiziert |
Insulin | variabel | möglich | möglich, ggf. Dosisreduktion erforderlich | möglich, ggf. Dosisreduktion erforderlich |
Liraglutid | 0,6–1,8 mg | möglich | möglich | nicht empfohlen |
Metformin | 500–2000 mg | 2 x 500 mg | kontraindiziert | kontraindiziert |
Repaglinid | 0,2–12 mg | möglich | möglich | nicht empfohlen |
Pioglitazon | 15–45 mg | 15–45 mg | 15–45 mg | GFR < 4 ml/min und Dialyse: kontraindiziert |
Saxagliptin | 2,5–5 mg | GFR < 45 ml/ min: 2,5 mg | 2,5 mg | nicht empfohlen |
Sitagliptin | 50–100 mg | GFR < 45 ml/ min: 50 mg | 25 mg | 25 mg |
Semaglutid | 0,25–0,5 mg | möglich | möglich | nicht empfohlen |
Vildaglitpin | 2 × 50 mg | GFR < 50 ml/ min: 1 x 50 mg | 1 x 50 mg | 1 x 50 mg |
CKD: chronische Nierenerkrankung; GFR: glomeruläre Filtrationsrate | ||||
Fazit für die Praxis
Die Behandlung des T2DM hat sich in den vergangenen Jahren deutlich gewandelt. Sowohl die technischen Therapieziele (HbA1c, Blutdruck, Cholesterin) als auch die verwendeten Therapien müssen an die spezielle Situation des einzelnen Patienten angepasst werden.
Durch die Einführung von Substanzen, die neben einer (nur geringen bis moderaten) Blutzuckersenkung das Auftreten von kardiovaskulären Ereignissen und/oder die Gesamtmortalität reduzieren, liegt der Fokus nicht mehr auf einer alleinigen Blutzuckersenkung und die Ziele für den HbA1c sind weniger strikt geworden. Die neue NVL Typ-2-Diabetes spiegelt diese Entwicklung wider.
Dr. med. Andreas Klinge, Hamburg, E-Mail: klinge@diabetes-eidelstedt.de
Dr. med. Günther Egidi, Bremen
Prof. Dr. med. Ulrich A. Müller, Jena
Die Autoren geben an, keine Interessenkonflikte zu haben. Die Literaturhinweise findenSie hier.
1 arriba® ist eine Bibliothek der Entscheidungshilfen (Shared Decision Aids) für die gemeinsame Entscheidungsfindung in der (haus)ärztlichen Konsultation. Mit dem arriba®-Modul „Kardiovaskuläre Prävention“ können Ärzte für ihre Patienten eine individuelle Risikoprognose für Herzinfarkt und Schlaganfall erstellen. Die Wahrscheinlichkeit für einen Patienten einen Herzinfarkt oder Schlaganfall zu erleiden, wird optisch demonstriert, die Effekte von Verhaltensänderungen oder medikamentösen Therapien werden anschaulich dargestellt. Ärzte und Patienten können so über eine dem objektiven kardiovaskulären Gesamtrisiko und den subjektiven Präferenzen des Patienten gleichermaßen Rechnung tragende Therapie gemeinsam entscheiden. Neben dem Modul „Kardiovaskuläre Prävention“ gibt es weitere Module z. B. zu den Behandlungsanlässen Diabetes mellitus, Antikoagulation bei chronischem Vorhofflimmern, depressive Störungen und Krebsfrüherkennungsuntersuchung. Weitere Informationen unter: https://arriba-hausarzt.de/.
2 Die Angabe der Tagestherapiekosten basiert auf einer Kostenberechnung nach Apothekenverkaufspreis anhand der größten verfügbaren Packung des kostengünstigsten Präparates (ohne Parallel- und Reimporte) unter Berücksichtigung der Dosierung gemäß Produktinformation. Quelle: Lauer-Taxe, Stand: 01.12.22.
3 MODY-Diabetes steht für „Maturity-On-set Diabetes of the Young“ also für den Erwachsenendiabetes, der bei Jugendlichen auftritt. MODY wird autosomal-dominant vererbt und tritt typischerweise vor dem 25. Lebensjahr familiär gehäuft auf. Er resultiert in erster Linie aus einem Defekt der Beta-Zell-Funktion aufgrund von Mutationen in sechs Genen, sodass in allen MODY-Formen die Insulinausschüttung gestört ist.