VNR: 2760602021198960002
Dr. med. Victoria Mortasawi, Prof. Dr. med. Wolfgang Pfützner
Einleitung
Das atopische Ekzem (AE) ist eine chronisch rezidivierende, stark juckende entzündliche Hautkrankheit, bedingt durch eine genetische Prädisposition und exogene Triggerfaktoren. Es zählt weltweit zu den häufigsten chronischen Erkrankungen mit einer geschätzten Prävalenz von bis zu 25 % im Kindes- und von etwa 10–15 % im Erwachsenenalter, wobei in Abhängigkeit von begünstigenden Umweltfaktoren deutliche geographische Unterschiede möglich sind [1].
Pathophysiologie
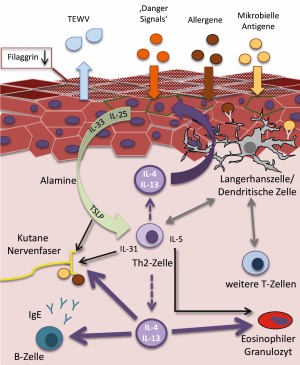
Das AE weist eine komplexe Pathophysiologie auf, die durch epitheliale, immunologische und neuronale Störungen im Zusammenspiel mit unterschiedlichen Umweltfaktoren (Mikroben, Allergene) gekennzeichnet ist (Abb. 1) [1–3].
Abb. 1: Pathophysiologie des atopischen Ekzems. Aufgrund einer Barrierestörung (bspw. durch verminderte epidermale Filaggrinexpression) kommt es zum einen zu einem gesteigerten transepidermalen Wasserverlust (TEWV), zum anderen zum vermehrten Eindringen von Allergenen, mikrobiellen Antigenen oder anderen „danger signals“. Diese aktivieren das innate Immunsystem zur Freisetzung von Alarminen wie IL-25, IL-33, TSLP. In Zusammenspiel mit epidermalen Langerhanszellen und dermalen dendritischen Zellen, die Allergene IgE-vermittelt aufnehmen können, werden vornehmlich Th2-Zellen aktiviert, die verschiedene Zytokine ausschütten. Eine zentrale Rolle kommen IL-4 und IL-13 zu, die u. a. die epidermale Barriere schwächen, eosinophile Effektorzellen (zusammen mit IL-5) aktivieren, B-Zellen zur Synthese von IgE-Anitikörpern anregen und kutane Nervenfasern stimulieren können. Weitere Juckreiz vermittelnde Faktoren sind IL-31, TSLP oder auch Proteasen von bspw. Hausstaubmilben- oder Staphylokokkenallergenen. Zusätzlich nehmen auch andere CD4 T-Zellen, insbesondere Th22-, aber auch Th1-Lymphozyten Einfluss, diskutiert wird dies auch für Th17– und CD8 T-Zellen.
Im Besonderen sind folgende Parameter bedeutsam:
- Epitheliale Barrierestörung: AE-Patienten weisen als eine wesentliche hereditäre Komponente eine verminderte Expression epidermaler Strukturproteine auf, die für die Ausbildung eines Schutzmantels und die Bindung von „natural moisturing factors“ in der Haut wesentlich sind. Ein Beispiel ist Filaggrin, für das etwa 20 % der Betroffenen eine Mutation aufweisen, zudem können Th2-mediierte Immuneffekte seine Expression vermindern. Die Folge ist zum einen ein erhöhter Wasserverlust mit vermehrter Hauttrockenheit, zum anderen eine gesteigerte epidermale Aufnahme von Allergenen, mikrobiellen Bestandteilen und Irritantien.
- Angeborenes Immunsystem: In der Haut von AE-Patienten ist die Bildung anti-mikrobieller Peptide gestört, was eine veränderte mikrobielle Besiedelung zur Folge hat. Des Weiteren kommt es durch das verstärkte Eindringen von „danger-signals” zur Aktivierung des innaten Immunsystems mit Freisetzung pro-inflammatorischer Botenstoffe („alarmins˝) wie Interleukin (IL)-25 und -33 sowie dem Thymic-Stromal-Lipoprotein (TSLP).
- Adaptives Immunsystem: Antigen-präsentierende Zellen der Haut, wie die Langerhans- und inflammatorischen dendritischen epidermalen Zellen, die den hoch-affinen IgE-Rezeptor FcɛRI exprimieren, können eindringende Al-lergene, mikrobielle Peptide oder auch Autoantigene den T-Zellen präsentieren. Unterstützt durch Faktoren wie IL-25, -33 und TSLP kommt es zur Aktivierung von CD4-positiven T-Helfer (Th)-2-Lymphozyten mit der Ausschüttung von IL-4 und IL-13 als entscheidenden Mediatoren der atopischen Entzündung und „target˝ neuer zielgerichteter Therapien mit Biologika (siehe unten). Daneben können auch Th-1, -17, -22 und auch CD8-positive T-Lymphozyten eine Rolle spielen, so dass neben der grundlegenden Th2-vermittelten weitere inflammatorische und möglicherweise auch (gegen bspw. epidermale Antigene gerichtete) autoimmunologische Immunreaktionen bedeutsam sein können.
- Mikrobiom: AE-Patienten zeigen eine deutlich verringerte mikrobielle Diversität der Haut mit Vorherrschen von Staphylokokken, insbesondere Staphylococcus aureus, der IgE-bindende Antigene und Juckreiz aktivierende Proteasen aufweist. Interessanterweise können topische Kortikosteroide und Calcineurin-Inhibitoren, möglichweise auch durch eine Stabilisierung der epidermalen Barriere, einen positiven Einfluss auf die mikrobielle Vielfalt mit Abnahme der Staphylokokken nehmen.
- Allergene/IgE: Neuere Erkenntnisse zeigen, dass die transkutane Aufnahme von Allergenen eine wesentliche Ursache einer IgE-vermittelten Sensibilisierung ist. Relevante Allergene sind insbesondere Hausstaubmilben und Pollen als Aero- sowie Hühnerei, Kuhmilch, Soja und Erdnuss als Nahrungsmittelallergene, die an FcɛRI auf dendritischen Zellen, Mastzellen und eosinophilen Granulozyten binden und AE-Schübe auslösen können. Allerdings werden IgE-abhängige Mechanismen zunehmend als ein nicht zwingend erforderlicher Kofaktor angesehen, so dass die jeweilige Relevanz stets diagnostisch zu klären ist, zumal etwa 20 % aller Erkrankten ein intrinsisches AE ohne vermehrte IgE-Bildung (gegenüber 80 % extrinsischen AE-Patienten) aufweisen.
- Nervensystem: In der Haut findet sich ein dichtes neuronales Netzwerk kutaner Nervenfasern, die durch unterschiedliche Neurotransmitter aktiviert werden können. Hierbei spielt für den Juckreiz des AE der nicht-histaminerge Pruritus eine wichtige Rolle, was das schlechte Ansprechen auf H1-Blocker erklären könnte. Sowohl exogene Aktivatoren, wie bspw. Hausstaubmilben- oder Staphylokokken-Proteasen, als auch endogene Signale, wie bspw. die immunologischen Mediatoren TSLP oder IL-31, können zu einer neuronalen Aktivierung führen und als Zielstruktur neuer therapeutischer Ansätze dienen. Der starke Juckreiz führt durch das vermehrte Kratzen zu einer zusätzlichen Schädigung der epidermalen Barriere.
Klinik
Klinisches Bild: Das klinische Bild des AE kann – bedingt durch Ethnizität, unterschiedliche exogene Triggerfaktoren sowie Schweregrad der Erkrankung – sehr vielgestaltig sein und altersabhängig unterschiedlich bevorzugte Lokalisationen betreffen [4]. Der Krankheitsbeginn liegt häufig bereits im Kleinkindalter, Erstmanifestationen können ab dem 2./3. Lebensmonat auftreten, wobei ein Teil der Betroffenen bis zum Abschluss des Kleinkindalters eine Abheilung erfährt [5–7]. Insbesondere der sehr frühzeitige „early-onset”-Typ kann aber bis ins Erwachsenenalter persistieren. Rezidive sind auch im Erwachsenenalter möglich, zudem existiert eine „late-onset“-Variante, bei der es erst im höheren Alter zur Erstmanifestation kommt [4].
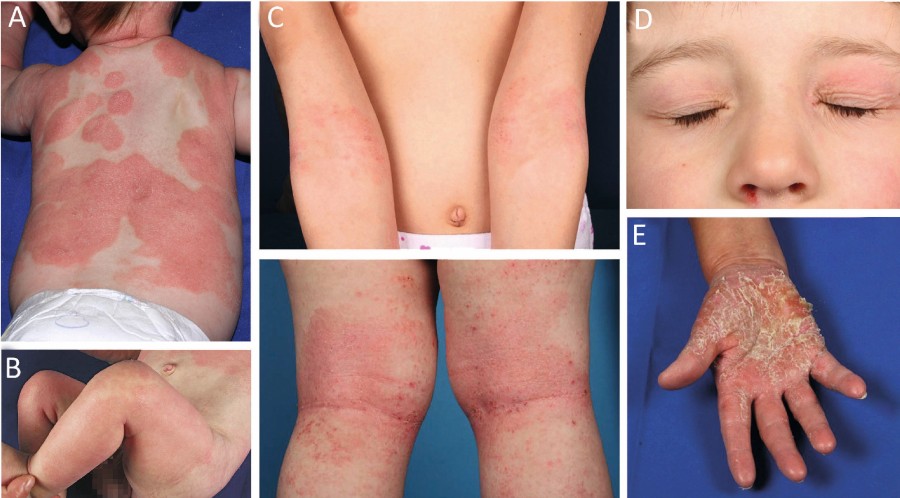
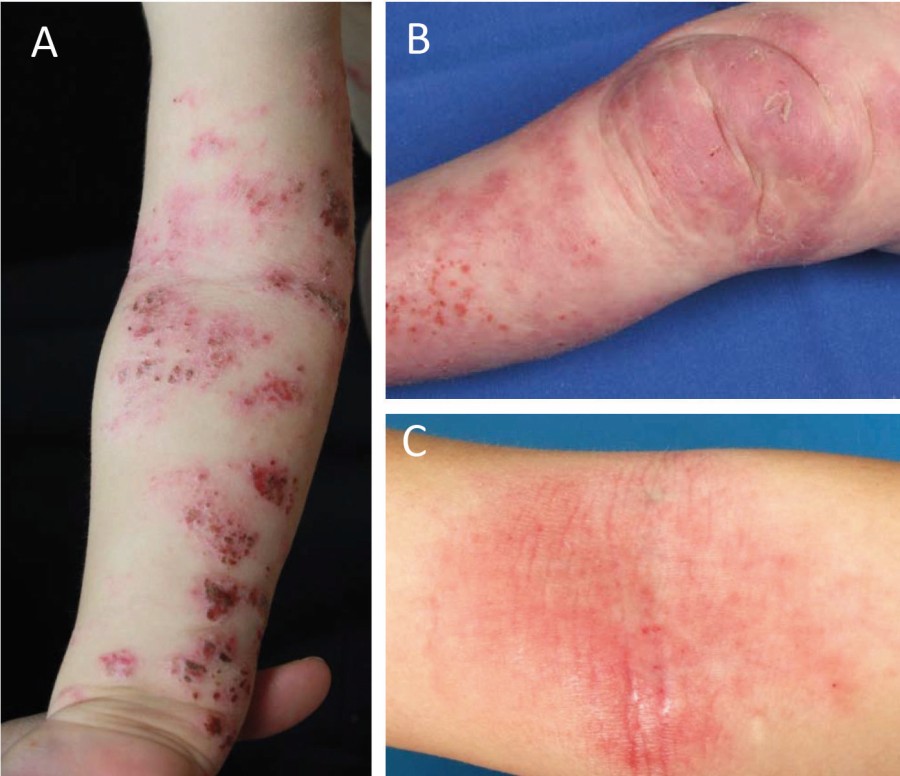
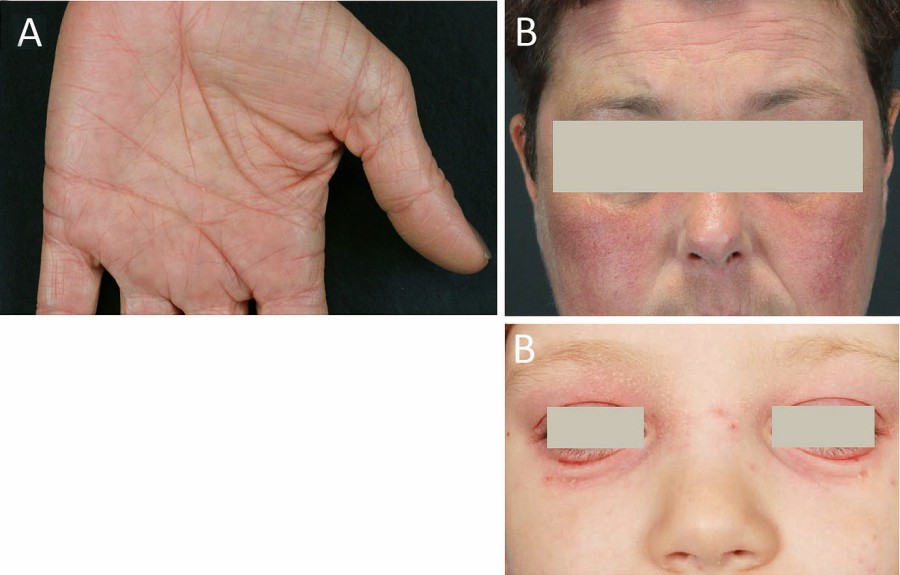
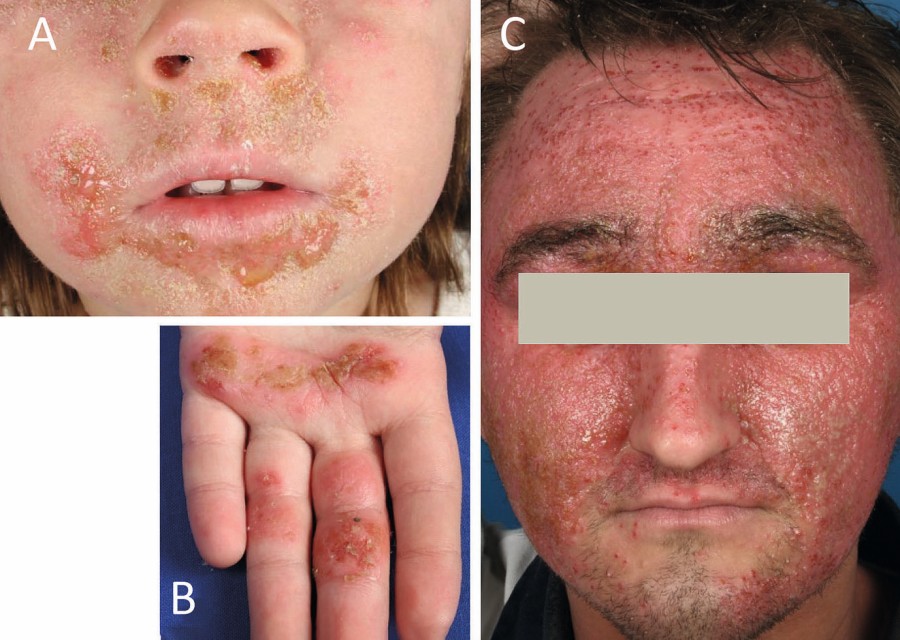
Bei Säuglingen zeigen sich die Hautveränderungen typischerweise diffus verteilt, vor allem jedoch an Wangen und Stamm unter Aussparung des Windelbereichs (Abb. 2 A, B). Im Kleinkindalter sind mehr und mehr die Beugeseiten betroffen (Abb. 2 C), bei Jugendlichen und Erwachsenen können verschiedenste Erscheinungsformen auftreten mit weiteren Prädilektionsstellen an den Lidern und Händen, (Abb. 2 D, E) [1]. Je nach Akuität finden sich unterschiedliche Ausprägungen mit akuten Ekzemen (erodierte Vesikel oder Papeln auf erythematösem Grund, nässend, mit Krusten belegt; Abb. 3 A), subakuten Ekzemen (verdickte und exkoriierte Plaques; Abb. 3 B) sowie chronischen Ekzemen geprägt durch Lichenifikation (Vergröberung des Hautreliefs; Abb. 3 C) und Hyperpigmentierungen [8]. Ein nahezu obligates Symptom ist die ausgeprägte Hauttrockenheit (Sebostase). Atopische Stigmata wie beispielsweise Hyperlinearität der Handinnenflächen und Fußsohlen (Abb. 4 A), eine Rarefizierung der lateralen Augenbrauen (Herthoghe Zeichen; Abb. 4 B) oder eine doppelte Lidfalte (Dennie-Morgan-Falte; Abb. 4 C) können hinweisend für eine atopische Veranlagung sein [1].
Abb. 2: A & B: Altersabhängige unterschiedliche Ausprägungen des atopischen Ekzems. A: Im Säuglingsalter findet sich das atopische Ekzem häufig diffus über den ganzen Körper verteilt, mit Aussparung der Windelregion. C: Im Kleinkind- und Jugendalter sind vornehmlich die Beugeseiten der Extremitäten betroffen. D & E: Typische umschriebene Formen sind das atopische Lid- oder Handekzem.
Abb. 3: Stadienabhängige Unterschiede des atopischen Ekzems. Während akute Ekzemherde durch großenteils erodierte Bläschen mit Krusten imponieren (A), stellen sich subakute Läsionen durch exkoriierte Plaques dar (B). Das chronische Ekzemstadium ist durch zumeist fein schuppende Erytheme mit deutlicher Vergröberung des Hautreliefs (Lichenifikation) gekennzeichnet (C).
Abb. 4: Atopie-Stigmata. Zu den Kennzeichen einer atopischen Diathese gehören u. a. das vermehrte Hervortreten der Handfurchen „I-Hände“ (A), eine Rarefizierung der seitlichen Augenbrauen (Hertoghe Zeichen; B) sowie eine gedoppelte Unterlidfalte (Dennie-Morgan-Falte; C).
Komplikationen: Die Haut von AE-Patieten ist für sekundäre mikrobielle Infektionen prädisponiert. So können Kolonialisierungen von Staphylococcus aureus zu einer Impetigenisierung führen (Abb. 5 A, B) [9, 10]. Bei 3 % aller Patienten kann es zu einem Eczema herpeticatum mit disseminierter kutaner Ausbreitung einer Herpes simplex-Virusinfektion kommen (Abb. 5C) [11]. Auch ist bei Kindern eine erhöhte Anfälligkeit für die Entwicklung von Dellwarzen durch Molluscum contagiosum-Viren zu beobachten [12].
Bei Erwachsenen, insbesondere bei am Kopf und im Nacken vorkommenden Ekzemen, ist eine Überbesiedelung mit Malassezia typisch [13] In sehr seltenen Fällen kann es zu Augenerkrankungen (Glaukom, Keratokonus, Erblindung, Netzhautablösung), zu einer assoziierten Alopecia areata mit kreisförmigem, nicht vernarbendem Haarausfall und oder zu Wachstumsverzögerungen kommen [14]
Abb. 5: Komplikationen. A, B: Staphylokokken können zu einer Impetiginisierung mit Ausbildung gelblicher Blasen und fest haftender Krusten führen. C: Besonders gefürchtet ist das Eczema herpeticatum, bei dem es zu einer diffusen Aussaat kleinster erodierter Bläschen als Zeichen einer disseminierten Herpes-simplex-Infektion der ekzematösen Haut kommt.
Komorbiditäten: Zu den klassischen, in 34,3–37 % der Fälle vorkommenden atopischen Komorbiditäten zählen Asthma bronchiale (10,7 %), allergische Rhinitis (22,4 %), allergische Konjunktivitis (14,1 %) [15–18], wobei das Vorkommen von Asthma bei AE-Patienten in jüngeren Studien seltener gefunden wurde als früher angenommen [19]. Nahrungsmittelallergien (NMA) in Form von Soforttyp- und späten Ekzemreaktionen [20] werden bei AE-Patienten ebenfalls beschrieben – bei Kindern in circa 10–37 % der Fälle (typische NMA im Kleinkindalter: Kuhmilch, Hühnerei, Erdnuss und Soja, typische NMA bei älteren Kindern: Weizen, Fisch, Baumnüsse); Vorkommen bei Erwachsenen aufgrund der Remission nur noch in circa 10 % der Fälle [21–23]. Juckreiz, Schlaflosigkeit und sozialer Rückzug begünstigen darüber hinaus die Entwicklung von Depressionen, Angststörungen und Verhaltensauffälligkeiten mit starker Beeinträchtigung der Lebensqualität [24, 25].
Therapie
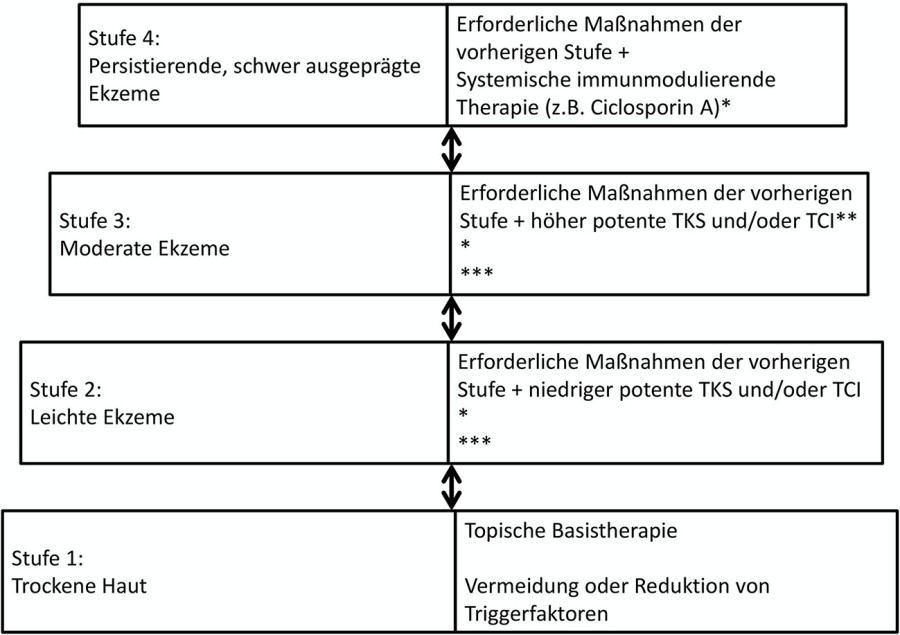
Primäres Therapieziel ist die Krankheitskontrolle, bestehend aus Reduktion des Juckreizes und Verringerung von Anzahl sowie Dauer der Schübe [1, 14]. Hierfür wurde ein mehrstufiges System etabliert (Stufenschema der S2k-Leitlinie „Atopiches Ekzem“, siehe Abb. 6). Die Therapie richtet sich nach Schweregrad und Alter der Patienten unter Berücksichtigung der Komorbiditäten [14].
Abb. 6: Stufentherapie der S2k-Leitlinien [14]. Je nach Hautzustand werden in Anlehnung an diese internationale Empfehlung vier Therapiestufen vorgeschlagen. Hier sind aus Gründen der Übersichtlichkeit nicht alle Verfahren dargestellt, die in der Leitlinie diskutiert werden.
* Eine UV-Therapie ist häufig ab Stufe 2 unter Berücksichtigung der Altersbeschränkung (nicht im Kindesalter) indiziert. Cave: keine Kombination mit Ciclosporin A und topischen Calcineurininhibitoren.
** First-Line-Therapie: In der Regel topische Glukokortikosteroide, bei Unverträglichkeit/Nichtwirksamkeit und an besonderen Lokalisationen (z.B. Gesicht, intertriginöse Hautareale, Genitalbereich, Capillitium bei Säuglingen) topische Calcineurininhibitoren
***Die zusätzliche Anwendung von antipruriginösen und antiseptischen Wirkstoffen kann erwogen werden.
Topische Therapie
Eine effiziente Lokaltherapie basiert auf drei fundamentalen Prinzipien: genügend stark wirksam, ausreichend dosiert und korrekt angewendet [26].
Die Basistherapie beinhaltet die Elimination bzw. Reduktion von Provokationsfaktoren und die Behandlung mit rückfettenden „Emollientien“ mindestens einmal täglich, um die Barrierefunktion der Haut zu stärken und der mit Juckreiz einhergehenden Hauttrockenheit entgegenzuwirken [27, 28]. Hierdurch lassen sich Exazerbationen vorbeugen und die Menge an benötigtem topischen Kortikosteroid reduzieren [29, 30]. Die Verordnung des möglichen Wirkstoffs sollte sich nach der individuellen Hautbeschaffenheit richten [14, 29–32].
Topische Kortikosteroide: Topische Kortikosteroide (TKS) gelten bei akuten Schüben aufgrund ihrer immunmodulatorischen und dadurch entzündungshemmenden Wirkung als First-Line-Therapie [33,34]. Sie werden je nach Ausprägung, Lokalisation und Alter des Patienten einmal täglich aufgetragen und im Verlauf langsam ausgeschlichen, um einen „Rebound“ zu verhindern. Eine Einsparung von TKS oder zu geringe Dosierung im akuten Schub wird aufgrund des längeren Therapiebedarfs und des Risikos einer zunehmenden Exazerbation nicht empfohlen. Vielmehr lassen sich durch TKS Ausmaß und Häufigkeit der Schübe reduzieren und die Intervalle geringeren Therapiebedarfs deutlich verlängern [35].
Topische Calcineurin-Inhibitoren: Topische Calcineurin-Inhibitoren (TCI), von denen zwei Wirkstoffe auf dem Markt erhältlich sind (Pimecrolimus und Tacrolimus), werden vor allem an für TKS nicht geeigneten Arealen (bspw. Gesicht) angewendet, da sie im Gegensatz zu TKS bei längerfristigem Einsatz nicht zu einer Hautatrophie führen [36,37]. Sie wirken über eine Hemmung der kutanen T-Zell-Aktivierung und -Proliferation [38] und haben darüber hinaus ähnlich den TKS einen positiven Effekt auf die Hautbarriere bei allerdings geringerer therapeutischer Effizienz insbesondere gegenüber stärker ausgeprägten Ekzemen [39].
Weitere topische Therapien
Obwohl kontrollierte Studien fehlen, kann aufgrund klinischer Erfahrungswerte die unterstützende Anwendung antipruriginöser Therapien mit Polidocanol [40] oder Gerbstoffen wie Tamol-haltigen Externa oder schwarzem Tee [41] überlegt werden, jedoch ersetzen diese die antientzündliche Therapie nicht [14]. Die Wirksamkeit von steinkohleteerhaltigen Wirkstoffen ist ausgesprochen gering, vergleichbar mit der von Hydrokortison 1 %. Zu beachten ist eine mögliche Phototoxizität [14, 42]. Sekundär bakteriell infizierte Läsionen können zusätzlich mit lokalen Antiseptika wie Polyhexanid oder Triclosan behandelt werden. Topische Antibiotika sind aufgrund des Risikos der Resistenzentwicklung möglichst zu meiden [43]. Trotz der nachgewiesenen Bedeutung von Staphylokokken als Triggerfaktor eines AE und der nahezu obligaten Besiedelung der Haut von AE-Patienten gibt es keine Evidenz für den Nutzen antistaphylogener Behandlungen (durch Antibiotika oder Antiseptika) einer klinisch nicht infizierten Haut [44].
Lichttherapie
Zusätzlich zur Lokaltherapie kann bei ausbleibender Besserung eine UVA 1- oder UVB 311-Lichttherapie durchgeführt werden [45]. Die Therapie hat durch ihre immunmodulatorische Wirkung einen anti-inflammatorischen Effekt und insbesondere UVB kann den Juckreiz reduzieren. Zu den Nebenwirkungen zählen neben Sonnenbrand-ähnlichen Hautveränderungen wie Rötung und Spannen abhängig von der kumulativen Dosis eine vorzeitige Hautalterung, Katarakt-Bildung und die Entstehung von Hauttumoren. [46] .
Systemische Therapien
Die Systemtherapie ist den moderaten bis schweren Formen des chronischen, gegenüber lokalen Behandlungsmaßnahmen resistenten und mit starker Beeinträchtigung der Lebensqualität einhergehenden AE vorbehalten. Hier steht mit dem monoklonalen Antikörper Dupilumab seit 2017 für Erwachsene und 2019 für Kinder ab dem 12. LJ eine äußerst effektive Therapie zur Verfügung. Der Antikörper ist gezielt immunmodulierend wirksam, indem er die α-Kette des IL-4- und IL-13-Rezeptors bindet und darüber den Einfluss dieser beiden Interleukine, die eine zentrale Funktion in der Pathophysiologie des AE aufweisen, blockiert [47]. Er wird in einer Dosis von 300mg/Injektion alle zwei Wochen subkutan appliziert (loading-dose: 600 mg) und führt nicht nur zu einer deutlichen Besserung der Ekzeme, sondern auch des Juckreizes, wobei das Ansprechen gelegentlich um einige Wochen verzögert sein kann [48, 49].
Die Behandlung ist insgesamt gut verträglich, die häufigste Nebenwirkung ist eine (oft asymptomatische) Konjunktivitis, Hautreaktionen an der Einstichstelle und Infektionen der oberen Atemwege. Diese sind zumeist mild ausgeprägt und bedingen normalerweise keinen Therapiestopp [50]. Gravierende oder gar lebenseinschränkende Nebenwirkungen sind nicht bekannt [48, 49].
Seit Oktober 2020 ist als „Biologic-Response-Modifier˝ der oral verfügbare Janus-Kinase 1 und 2 Inhibitor Baricitinib zur Behandlung des mittelschweren bis schweren atopischen Ekzems zugelassen, welcher in Kombination mit TKS zu einer Verbesserung der Inflammationen, des Juckreizes und der Schlaflosigkeit führt. Kopfschmerzen und nasopharyngeale Beschwerden stellen die häufigsten Nebenwirkungen dieses initial zur Behandlung der rheumatoiden Arthritis entwickelten Wirkstoffs dar [51].
Weitere „Biologic-Response-Modifier”, die sich ebenfalls gegen Janus-Kinasen oder gegen andere vielversprechende Moleküle wie TSLP, IL-22 und IL-31 richten, befinden sich in Entwicklung bzw. sind bereits in Phase-III-Studien in Erprobung [3].
Bei sehr schweren, therapierefraktären Verlaufsformen kann Ciclosporin eingesetzt werden [52]. Die kumulative Anwendungsdauer ist allerdings insbesondere aufgrund der potenziellen Nephrotoxizität und des erhöhten Risikos der späteren Entwicklung von Plattenepithelkarzinomen der Haut auf ein bis zwei Jahre beschränkt [53]. Mit wesentlich besserem Nebenwirkungsprofil, aber nur mäßig guter Wirksamkeit steht als off-label-Therapie Mycophenolatmofetil zur Verfügung [54, 55]. Off-label kann bei sehr schweren Verläufen Azathioprin und Methotrexat auch bei Kindern eingesetzt werden [56, 57].
Systemische Kortikosteroide sind allenfalls für einen kurzen Zeitraum in akuten Notfällen einzusetzen [58].
Schulungsprogramme
Strukturierte Schulungsprogramme sind ein weiteres wichtiges therapeutisches Element, durch das sich über ein verbessertes Verständnis der Erkrankung und ihres Behandlungsbedarfs sowie positive Effekte auf die psychosozialen Aspekte eine verbesserte Therapieadhärenz erzielen lässt [29, 59].
Prävention
Eine Vielzahl an Maßnahmen, die der Ausbildung oder Verschlechterung eines AE vorbeugen können, wird diskutiert (Tab. 1). Allerdings ist die Datenlage hierzu teilweise widersprüchlich und vielfach noch lückenhaft [60]. Zur Allergieprävention wird mit Evidenzklasse A neben der Vermeidung von Tabakrauchexposition sowohl prä- als auch postnatal [61–64] auch das Impfen nach Stiko-Schema empfohlen [64]. Darüber hinaus spielt die Ernährung eine wichtige Rolle. So wird Stillen bis zum vollendeten 4. Lebensmonat (LM) angeraten – oder alternativ die Gabe von hydrolisierter Säuglingsnahrung [64–66]. Auch sollte die Beikosteinführung ab dem 5. Lebensmonat erfolgen [67, 68]. Explizit nicht empfohlen wird jedoch die präventive Meidung potentieller allergener Nahrungsmittel, auch nicht im Falle eines bloßen Sensibilisierungsnachweises (positives IgE auf das NMA), da diese für die Entstehung eines AE nicht bedeutsam sind und es darüber hinaus zu einer fehlenden Toleranzinduktion kommen kann [23]. Eine gezielte IgE-Diagnostik sollte daher erst nach signifikanter Verbesserung des Hautzustandes bei probatorischer Meidung für max. zwei bis drei Wochen erfolgen – Ausnahme: Erdnussallergie [64, 69, 70].
Zur Vorbeugung von Exazerbationen hat sich die sog. pro-aktive Therapie bewährt, bei der für zwei bis drei Monate zweimal wöchentlich an vormals stärker betroffenen Stellen im schubfreien Intervall mit TKS niederer Potenz oder mit TCI weiter behandelt wird [1, 34, 71–74].
Tab 1: Maßnahmen zur Prävention nach der aktuellen S3-Leitlinie zur Allergieprävention (LM = Lebensmonate) | |
Primärprävention | Sekundärprävention |
Meidung einer aktiven/passiven Tabakrauchexposition [61–64, 75] | Meidung von Hautreizungen durch aktive/passive Tabakrauchexposition [61–64, 75], Hausstaub-, und Tierhaarpollen, Luftverschmutzung [76, 77] |
Impfung nach STIKO-Empfehlung [64] | Schulungsprogramme [59] |
Ausschließliches Stillen oder Gabe hydrolisierter Säuglingsnahrung in den ersten vier LM [64–66] | * Pro-aktive Therapie (Behandlung 2–3x/Woche mit TCI oder TKS auch bei bereits abgeheiltem Befund um die Anzahl an Schüben zu verringern) [1, 34, 71–74] |
Abwechslungsreiche Beikost ab dem 5. LM [64], einschließlich Joghurt [67, 68] | |
Fisch-Verzehr in Schwangerschaft, Stillzeit und als Beikost ab dem 5. LM [64] | |
Vermeidung von Übergewicht im Kindesalter [64, 78] | |
Meidung einer Katzenhaltung [64, 79] | |
Hausstaubmilbenkarenzmaßnahmen [64, 80] | |
* Vermeidung von Antibiotika vor Vollendung des 2. Lebensjahres [81] | |
* Vermeidung von Alkoholkonsum in der Schwangerschaft [82] | |
* Einnahme von Fischöl-Kapseln ab der 21. Schwangerschaftswoche bis zu Entbindung [83] | |
*Kontakt zu Bauernhoftieren während der Schwangerschaft [84] | |
* nicht in der aktuellen S3-Leitlinie zur Allergieprävention enthalten | |
Dr. med. Victoria Mortasawi, Prof. Dr. med. Wolfgang Pfützner
Klinik für Dermatologie und Allergologie, Allergie-Zentrum Hessen, Universitätsklinikum Marburg, Philipps-Universität Marburg, E-Mail: v.mortasawi@gmail.com, wolfgang.pfuetzner@uk-gm.de
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Atopisches Ekzem“ von Dr. med. Victoria Mortasawi und Prof. Dr. med. Wolfgang Pfützner finden Sie im Mitglieder-Portal (https://portal.laekh.de) sowie am Ende dieser Seite unter „Artikel herunterladen“ in der PDF-Version dieses Artikels. Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Mitglieder-Portal vom 25. August 2021 bis 24. Februar 2022 möglich. Die Fortbildung ist mit zwei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Dieser Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, Erklärungen zu möglichen Interessenkonflikten finden Sie in der Online-Ausgabe unter www. laekh.de, Rubrik Hessisches Ärzteblatt.
Die Literaturhinweise finden Sie am Ende dieser Seite unter „Artikel herunterladen“ in der PDF-Version dieses Artikels.