Diagnose und Behandlung nach der Leitlinie der Europäischen Gesellschaft für Kardiologie
VNR: 2760602021142480008
Prof. Dr. med. Thomas Voigtländer, Prof. Dr. med. Holger Eggebrecht, Prof. Dr. med. Christoph Liebetrau, Prof. Dr. med. Bernd Nowak, Prof. Dr. med. Axel Schmermund
ESC-Guidelines 2019: Diagnosis and management of chronic coronary syndromes (CCS).
Abkürzungsverzeichnis siehe am Ende dieses Artikels.
1. Einleitung
Die koronare Herzkrankheit ist aktuell für 19 % aller Todesfälle in Europa verantwortlich [1]. In Deutschland belegen die Diagnosen akuter Herzinfarkt und chronische ischämische Herzkrankheit die beiden ersten Plätze der Todesursachen [Herzbericht 2019]. Das Leitsymptom des chronischen Koronarsyndroms (CCS), die Angina pectoris, ist häufig. Daten aus den USA und Europa berichten über eine Inzidenz der Angina Pectoris von 12,3 Fällen/1.000 Patientenjahre (altersadjuziert 45–74 Jahre) und eine Prävalenz von 20 % bei über 60-jährigen Männern [2, 3, 4]. Die jährliche Sterblichkeit bei Patienten mit chronischem Koronarsyndrom beträgt 1,6–3,2 %, wobei selbstverständlich Faktoren wie linksventrikuläre Funktion, Ausmaß der koronaren Herzerkrankung und weitere Komorbiditäten eine wichtige Rolle spielen [5].
Dennoch zeigen die Daten des Deutschen Herzberichtes, dass bereits viel erreicht wurde. In Tab. 1 ist dargestellt, wie die Sterblichkeit an kardialen Erkrankungen insgesamt und insbesondere an koronarer Herzerkrankung durch Lebensstiländerung und optimierte Therapie deutlich gesenkt werden konnte.
Tab. 1: Altersstandardisierte Entwicklung der Sterblichkeit von 1990–2016 pro 100.000 Einwohner | |||||
Jahr | KHK1 | Klappenerkrankung | Rhythmus- störung | Heart failure | gesamt |
1990 | 330,5 | 10,5 | 24,1 | 122,9 | 459,2 |
2000 | 256,2 | 12,4 | 25,6 | 86,8 | 381,9 |
2016 | 134,3 | 18,7 | 28,7 | 42,8 | 225,1 |
1 KHK = Koronare Herzkrankheit Quelle: Deutscher Herzbericht, Deutsche Herzstiftung 2019 | |||||
Um die Sterblichkeit weiter zu senken, ist es erforderlich, die koronare Herzerkrankung früh zu erkennen und gemäß der vorgestellten Leitlinie zu behandeln. Dies wird besonders deutlich an der anhaltend hohen Zahl von Patienten, die am plötzlichen Herztod sterben (in Deutschland ca. 70.000 pro Jahr). Nach Ergebnissen einer Autopsiestudie ist eine koronare Herzerkrankung bei über 35-Jährigen in 73 % der Fälle die zugrunde liegende Todesursache. Auch bei den unter 35-Jährigen liegt die koronare Herzerkrankung mit 23 % immer noch an zweiter Stelle der Ursachen des plötzlichen Herztodes [6, 7].
Im Folgenden werden die neuen Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) vorgestellt [8]. Deutsche Kardiologen waren bei der Erstellung beteiligt. Die Deutsche Gesellschaft für Kardiologie hat diese Leitlinie übernommen, sodass diese im August 2019 erstmals vorgestellte Leitlinie auch für Deutschland gilt.
2. Konzeptionelle Überlegungen zum chronischen Koronarsyndrom
Die Atherosklerose der Koronararterien kann lange stabile Verläufe aufweisen, aber auch zu jedem Zeitpunkt durch Ereignisse mit einem akuten Koronarsyndrom (ACS) unterbrochen werden. Dies ist zumeist durch eine Erosion oder eine Ruptur einer Koronarplaque verursacht. Die Berücksichtigung des dynamischen Prozesses der koronaren Herzerkrankung hat dazu geführt, dass der Terminus chronisches Koronarsyndrom eingeführt wurde – statt des Begriffes stabile koronare Herzerkrankung oder auch stabile Angina Pectoris.
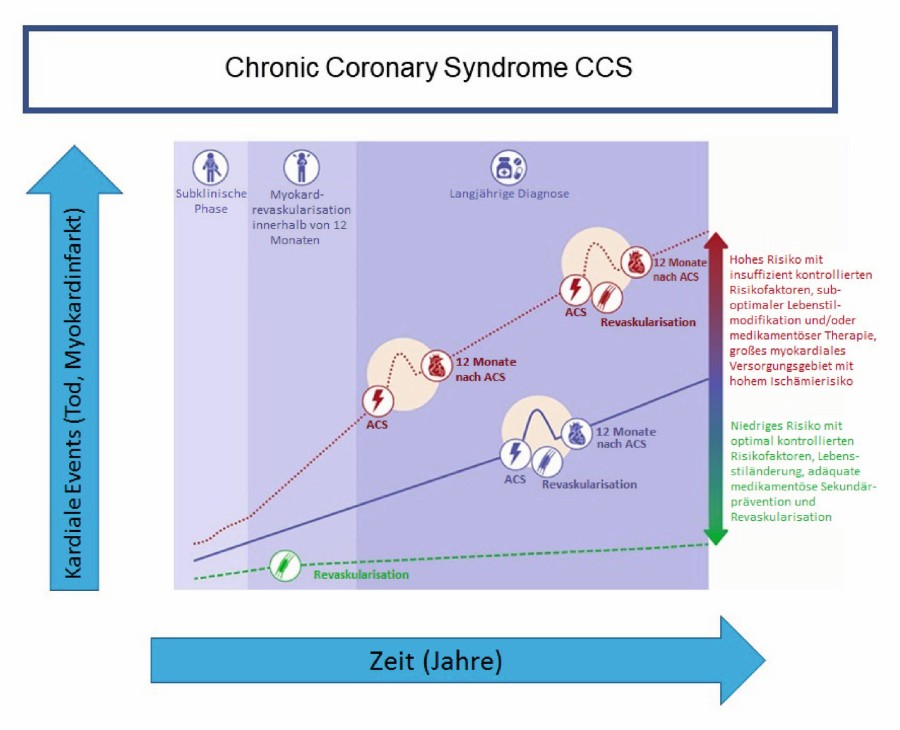
In der zentralen Abbildung der Leitlinie (Abb. 1) werden Patientenverläufe dargestellt, die den Varianten eines CCS entsprechen. Der Start der Krankheitshistorie beginnt mit der Diagnose koronare Herzerkrankung (Nachweis einer Stenose > 50 % oder Nachweis einer regionären Minderdurchblutung des linken Ventrikels) oder auch mit einer bereits erfolgten Revaskularisation (perkutane Koronarintervention – PCI, oder Bypassoperation). Danach entscheidet sich der Verlauf in Abhängigkeit von Lebensstiländerung, Kontrolle und Behandlung der Risikofaktoren sowie Ausmaß und Vollständigkeit der interventionellen oder operativen Revaskularisation.
Abb. 1: Das chronisch koronare Syndrom: Zeitverlauf und koronare Ereignisse. Grafik: Rechte bei den Autoren
Das ACS bleibt auch wegen der erheblichen prognostischen Bedeutung als eigene Entität abgegrenzt. Es beinhaltet neben den beiden Varianten des Herzinfarktes mit oder ohne ST-Hebung, STEMI und NSTEMI, auch die instabile Angina pectoris. Letztere ist definiert als Angina pectoris in Ruhe, zunehmende Angina oder als das Auftreten einer Angina pectoris innerhalb der vergangenen beiden Monate. Insbesondere auf die zuletzt genannte Definition einer instabilen Angina pectoris muss geachtet werden.
3. Diagnostisches Vorgehen bei Patienten mit Angina Pectoris und Verdacht auf koronare Herzerkrankung
3.1. Symptomatik
In der Beschreibung der ESC wird von einer typischen Angina pectoris gesprochen, wenn diese
- als Druck oder Brennen retrosternal, teils mit Ausstrahlung in die Arme, den Rücken, Oberbauch oder auch in den Unterkiefer auftritt,
- wenn die Symptomatik belastungsabhängig ist und
- wenn die Beschwerden auf Ruhe oder Nitrogabe rückläufig sind.
Sind nur zwei der drei Symptome vorhanden, wird von einer atypischen Angina Pectoris gesprochen. Wenn nur ein Kriterium erfüllt ist, liegt ein nichtanginöser Thoraxschmerz vor.
3.2. Vortestwahrscheinlichkeit
Insbesondere bei nicht typischer Angina pectoris hat vor der Einleitung einer weitergehenden Diagnostik die Bestimmung der Vortestwahrscheinlichkeit einen hohen Stellenwert. Im Vergleich zur letzten Guideline und zu den ursprünglichen Daten von Diamond und Forrester [9] in 1979 hat sich eine bemerkenswerte Verschiebung ergeben. Die Prävalenz der Erkrankung ist offenkundig geringer und auch die Korrelation von Symptomatik und Vorliegen einer Koronarproblematik ist geringer. Die Vortestwahrscheinlichkeit wird berechnet, indem auf der Grundlage von Alter, Geschlecht und Symptomatik die Wahrscheinlichkeit des Vorliegens einer Koronarstenose von > 50 % bestimmt wird (Tab. 2). Im Gegensatz zu den Daten von Forrester et al. wird in der neuen Vortestbestimmung Dyspnoe als Anginaäquivalent mit aufgenommen [10]. Bei < 5 % Vortestwahrscheinlichkeit wird keine weitere Diagnostik empfohlen. Liegt die Vortestwahrscheinlichkeit bei 5–15 %, wird empfohlen, das Vorliegen von Risikofaktoren in die Analyse aufzunehmen. So sollte bei Nachweis von Risikofaktoren auch bei dieser niedrigen Vortestwahrscheinlichkeit eine weitergehende Diagnostik erfolgen, um eine bedeutsame Koronarproblematik auszuschließen. Nach dieser ersten Einschätzung werden in einem nächsten Schritt die Lebensqualität und die Komorbiditäten der Patientin bzw. des Patienten analysiert, um ggfs. eine rein medikamentöse Therapie durchzuführen.
Tab. 2: Patienten mit Angina Pectoris und/oder Dyspnoe – Vortestwahrscheinlichkeit für eine Koronare Herzerkrankung | ||||||||
Typisch | Atypisch | Nicht-Anginös | Dyspnoe | |||||
Alter | M | W | M | W | M | W | M | W |
30–39 | 3 % | 5 % | 4 % | 3 % | 1 % | 1 % | 0 % | 3 % |
40–49 | 22 % | 10 % | 10 % | 6 % | 3 % | 2 % | 12 % | 3 % |
50–59 | 32 % | 13 % | 17 % | 6 % | 11 % | 3 % | 20 % | 9 % |
60–69 | 44 % | 16 % | 26 % | 11 % | 22 % | 6 % | 27 % | 14 % |
70 | 52 % | 27 % | 34 % | 19 % | 24 % | 10 % | 32 % | 12 % |
3.3. EKG/Echokardiographie
Die Leitlinie empfiehlt als nächsten Schritt die EKG-Ableitung und eine Echokardiographie. Wegen des erheblichen Einflusses auf die Prognose kommt dem Nachweis einer eingeschränkten linksventrikulären Funktion eine besondere Bedeutung zu. Dies hat einen wesentlichen Einfluss auf die frühe Indikationsstellung zur interventionellen oder auch chirurgischen Revaskularisationstherapie.
3.4. Diagnostik – weitergehende funktionelle oder anatomische Untersuchungen
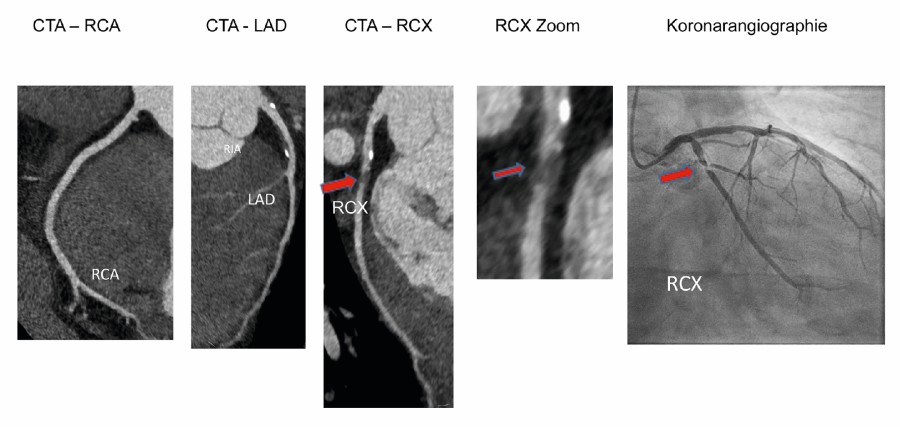
Im Vordergrund der weiteren Diagnostik steht die Frage: Liegt wirklich eine koronare Herzerkrankung vor? In der Guideline wird der Terminus „rule in – rule out“ verwendet. Die Untersuchungsmethoden werden daraufhin geprüft, wie zuverlässig sie eine koronare Herzerkrankung nachweisen (rule in) sowie ausschließen können (rule out). Die funktionelle Diagnostik kann mit einer Vielzahl von Methoden durchgeführt werden. Das viele Jahrzehnte durchgeführte konventionelle Belastungs-EKG wird allerdings mit Erscheinen der aktuellen Leitlinie nicht mehr empfohlen. Es erzielt bei der Fragestellung „rule in – rule out“ vor allem bei intermediärer Vortestwahrscheinlichkeit schlechte Ergebnisse. Bessere Ergebnisse erzielen das Kardio-MRT mit der auf der Perfusionsanalyse beruhenden Ischämiediagnostik, die Myokardszinitigraphie oder auch die Stressechokardiographie. Die anatomische oder auch morphologische Diagnostik stellt die Veränderungen der Koronar- arterien selbst dar. Mittels der koronaren CT-Angiographie (CTA) ist dies nichtinvasiv möglich. Voraussetzung ist ein modernes Multidetektor-CT-System mit mindestens 64 Detektorzeilen. Es kann eine Auflösung vergleichbar der invasiven Herzkatheteruntersuchung erreicht werden. Da ein zuverlässiges „rule in – rule out“ erreicht werden kann, hat die CTA in der Leitlinie eine I B-Empfehlung erhalten und ist somit den funktionellen Untersuchungen gleichgestellt (Abb. 2).
Der Vergleich ist die invasive Koronarangiographie und damit ein morphologischer Parameter. Ein ergänzender Ansatz untersucht den invasiven funktionellen Parameter der Fractional Flow Reserve (FFR) im Vergleich zu den nichtinvasiven Methoden (keine Daten allerdings zum Belastungs-EKG). Somit ist „rule in“ bei pathologischer FFR gegeben, „rule out“ bei normaler FFR. Auch bei diesem Ansatz schneidet CTA beim „rule out“ sehr gut ab. In der Summe empfehlen die Autoren bei eher niedriger Vortestwahrscheinlichkeit eine CTA und bei eher höherer Vortestwahrscheinlich einen funktionellen Ischämietest.
3.5. Risikoeinschätzung
Das chronische Koronarsyndrom hat eine Vielzahl von Facetten, sodass als weitere Grundlage der Therapie eine Risikoabschätzung erfolgen muss. Ein niedriges Risiko wird angenommen, wenn die jährliche kardiale Mortalität < 1 % ist, ein mittleres Risiko bei 1–2,9 % und ein hohes Risiko bei > 3 %. Sind die vorgenannten Tests (anatomisch oder funktionell mit Ausnahme des Belastungs-EKG) negativ und die linksventrikuläre Funktion beträgt > 50 %, besteht ein Risiko von < 1%. Sind die Tests positiv und zeigen ein großes (> 10 %) Ischämieareal, besteht in hohes Risiko. Auch das Vorliegen einer eingeschränkten linksventrikulären Pump-Funktion (Ejektionsfraktion [EF] < 50 %) ist ein Hinweis auf das Vorliegen eines hohen Risikos. Zeigt sich im CT oder in der invasiven Koronarangio- graphie eine Mehrgefäßerkrankung, eine Hauptstammstenose oder eine proximale LAD-Stenose (LAD = left anterior descending coronary artery, Ramus interventricularis anterior), liegt ebenfalls ein hohes Risiko vor (Tab. 3).
Tab. 3: Hohes kardiales Mortalitätsrisiko und pathologische Testergebnisse | |
Methode | Risikoparameter |
SPECT | Ischämieareal > 10 % |
Kardio-MRT | 2/16 Segmente mit Minderperfusion |
3/16 Segmente dysfunktional bei Dobutamin-Stress | |
Koronar-CT (CTA) oder invasive Korornarangiographie | 3 Gefäßerkrankung, Hauptstammstenose, proximale LAD |
Invasiver funktioneller Test | FFR < 0,8 |
4. Therapie
Mittlerweile liegt eine Vielzahl von Daten vor, die eine gute Einschätzung der unterschiedlichen therapeutischen Ansätze beim chronischen Koronarsyndrom ermöglicht. Neben den wichtigen Optionen der Lebensstiländerung besteht eine Reihe von medikamentösen Ansätzen zur Therapie des CCS. Die generellen Behandlungsziele sind eine Reduktion der Symptome Angina Pectoris und Dyspnoe sowie die Prävention vor kardialen Ereignissen. Folgende Medikamentengruppen kommen zum Einsatz:
- Antiischämische Therapie,
- die medikamentöse Therapie zur Reduktion von kardiovaskulären Ereignissen,
- die lipidsenkende Therapie,
- Renin-, Angiotensin-, Aldosteron-System-Inhibitoren insbesondere bei Einschränkung der linksventrikulären Funktion.
Einen sehr wichtigen weiteren Baustein der Behandlung für Patienten mit CCS sowohl hinsichtlich der Symptomminderung als auch unter prognostischen Aspekten stellt die Revaskularisationstherapie dar. Immer häufiger kommt die PCI zum Einsatz, dennoch hat auch die koronare Bypassoperation weiterhin ihren Stellenwert.
4.1. Lebensstil
Wie in den früheren Leitlinien hat die nichtmedikamentöse Reduktion des Risikofaktorenprofils einen wichtigen Stellenwert bei der Therapie des chronischen Koronarsyndroms. Neben der unbedingt notwendigen Nikotinkarenz gegebenenfalls mit psychologischer oder medikamentöser Hilfe stehen die regelmäßige körperliche Aktivität (empfohlen werden 30–60 Minuten moderates Training)1, ein optimierter BMI (< 25 kg/qm) und eine gesunde Ernährung im Vordergrund (großer Anteil von Gemüse und Obst). Der Anteil an gesättigten Fettsäuren sollte nicht mehr als 10 % betragen; Alkohol sollte auf 15 g/Tag oder 100 g/Woche reduziert bleiben.
1 Die ESC-Guidelines 2020 empfehlen hier Ausdauertraining 150–300 Minuten pro Woche mit moderater oder 75–150 Minuten pro Woche mit hoher Intensität verteilt auf drei bis sieben Einheiten. Krafttraining zusätzlich dreimal pro Woche [18].
4.2. Medikamentöse Therapie
Antiischämische Therapie
Diese Therapie reduziert Angina Pectoris-Anfälle und erhöht die Angina-freie Belastungsschwelle. Es werden einzeln oder in Kombination u. a. Betablocker, Calciumantagonisten, Nitrate, Molsidomin, Ivabradin und Ranolazin eingesetzt.
Die neue Leitlinie empfiehlt den Start mit einer Kombination aus Betablockern und Calciumantagonisten vom Dihydropyridintyp. Es handelt sich um eine symptomatische Therapie. In einer Metaanalyse mit mehr als 750.000 Patienten (CCS, nach PCI, kein Infarkt, keine Herzinsuffizienz) konnte durch Betablockertherapie kein Effekt auf das Überleben festgestellt werden [11]. Dies gilt auch für die Calciumantagonisten. Dennoch sind zur Symptomlinderung alle Typen der Calciumantagonisten (Calciumkanalblocker, CCB) geeignet, sowohl die Non-Dihydropyridine (Verapamil, Diltiazem – kein gleichzeitiger Einsatz mit Betablockern) als auch die Dihydropyridine (z. B. Amlodipin, Lercanidipin).
Nitrate sind ebenfalls sehr effektiv in der Symptombehandlung, aber auch durch diese Substanzgruppe kann keine Prognoseverbesserung erreicht werden. Es werden die kurzwirksamen und die langwirksamen Nitrate (Isosorbiddinitrate und Isosorbidmononitrate) unterschieden. Nitrate dürfen nicht mit Phosphodiesteraseinhibitoren (z. B. Sildenafil, Tadalafil) kombiniert werden.
Zusätzlich spielen die Substanzen Ivabradin und Ranolazin eine Rolle bei der symptomatischen medikamentösen Therapie bei CCS. Ivabradin kann eingesetzt werden, wenn die Sinusknotenfrequenz weiter reduziert werden soll. Ranolazin wirkt als Natriumkanalblocker, hat darüber auch Einfluss auf den myokardialen Calciumeinstrom und kann über eine myokardiale Relaxation eine Reduktion der Angina Pectoris-Symptomatik bewirken.
Medikamentöse Therapie zum Schutz vor weiteren Ereignissen (Myokardinfarkt, Tod)
Antithrombotische Therapie
Bei Patienten mit CCS kann sowohl eine Thrombozytenaggregationshemmung als Monotherapie oder als duale Plättchenhemmung (DAPT) indiziert sein. Besteht bei diesen Patienten zusätzlich ein Vorhofflimmern, wird die Therapie durch eine orale Antikoagulation ergänzt. Aus diesem Grunde unterscheiden die Autoren drei verschiedene Situationen:
- Antithrombotische Therapie bei CCS und Sinusrhythmus,
- nach PCI und bei Sinusrhythmus,
- bei CCS und Vorhofflimmern.
Antithrombotische Therapie bei CCS und Sinusrhythmus
Eine I A-Indikation besteht für ASS 100 bei diesen Patienten. Bei ASS-Unverträglichkeit kann alternativ Clopidogrel eingesetzt werden. Bei Patienten mit einem hohen Risiko für koronare Ereignisse und einem niedrigem Blutungsrisiko kann auf Dauer ein weiterer Plättchenhemmer hinzugegeben werden. Im Pegasus Trial wurde Patienten nach Infarkt, die bereits für ein Jahr eine duale Plättchenhemmung gut vertragen hatten, zusätzlich zu ASS 100 Ticagrelor 60 2x täglich gegeben, und eine Reduktion der ischämischen Ereignisse konnte nachgewiesen werden [12].
In der Compass-Studie konnte gezeigt werden, dass bei Patienten nach Infarkt oder bei einer Mehrgefäßerkrankung auch die zusätzliche Gabe des Faktor Xa-Inhibitors Rivaroxaban in einer Dosis von 2,5 mg 2x täglich zusätzlich zu ASS 100 eine Verringerung der ischämischen Ereignisse bewirkte [13]. Bei beiden Konzepten war allerdings ein niedriges Blutungsrisiko wesentlich, da sonst die Vorteile der antiischämischen Wirkung durch die Blutungskomplikationen neutralisiert wurden.
Antithrombotische Therapie nach PCI und bei Sinusrhythmus
Bei Patienten mit CCS ist nach einer Stentimplantation (heutzutage erfolgt obligat die Implantation von medikamentenbeschichteten Stents) die Gabe von ASS 100 auf Dauer und die Gabe von Clopidogrel für sechs Monate (DAPT) erforderlich und entspricht einer Klasse-I A-Empfehlung. Wenn ein erhöhtes Blutungsrisiko besteht, kann die Gabe von Clopidogrel auf drei Monate verkürzt werden. Bei Patienten mit einem sehr hohen Blutungsrisiko oder bei manifester Blutung kann die DAPT-Phase auf einen Monat reduziert werden. Dennoch ist immer auch eine individuelle Einschätzung erforderlich. Bei Patienten mit komplexer PCI (z. B. Hauptstamm- oder Bifurkationsintervention) sollte die Verkürzung der DAPT zurückhaltend erfolgen. Eine akute Stentthrombose ist mit einer hohen Sterblichkeit verbunden.
Antithrombotische Therapie bei CCS und Vorhofflimmern
Bei Patienten mit CCS und Vorhofflimmern ohne vorherige Stentimplantation entspricht die antithrombotische Therapie den Empfehlungen der Vorhofflimmerbehandlung. Bei nicht-valvulärem Vorhofflimmern und einem CHA2DS2- VASc-Score bei Frauen von drei oder mehr und bei Männern von zwei oder mehr wird die dauerhafte Einnahme einer direkten oralen Antikoagulation (DOAK) empfohlen [14].
Bei Patienten mit CCS und Vorhofflimmern und vorheriger Stentimplantation müssen die Konzepte zur Verhinderung von thrombembolischen Ereignissen wegen des Vorhofflimmerns (Antikoagulation) und der Prävention einer Stentthrombose (antithrombozytäre Therapie) verbunden werden. Ca. 12 % der Patienten mit PCI haben auch Vorhofflimmern [15]. Die Leitlinie betont, dass zur Antikoagulation in dieser Situation DOAK statt Vitamin K-Antagonisten (VKA) bei nicht-valvulärem Vorhofflimmern eingesetzt werden sollten.
In diesem Zusammenhang ist es wichtig zu betonen, dass die vorliegenden Studiendaten auch in der Kombination mit der antithrombozytären Medikation die nichtreduzierte Dosis empfehlen (Apixaban 2 x 5 mg, Rivaroxaban 1 x 20 mg, Edoxaban 1 x 60 mg, Dabigatran 2 x 150 mg). Wenn allerdings ein erhöhtes Blutungsrisiko vorliegt, können Rivaroxaban in der Dosis von 15 mg und Dabigatran in der Dosis von 2 x 110 mg gegeben werden. Die Kombination von antithrombozytärer Therapie und Antikoagulation wurde zunächst obligat als Tripeltherapie duchgeführt (DAPT und VKA). Sehr hohe Blutungskomplikationen führten dazu, dass in der Woest-Studie erstmals die duale Therapie (Clopidogrel und VKA) untersucht wurde. Es zeigte sich, dass bei gleicher Effektivität die Blutungsereignisse bedeutsam geringer waren als mit der Tripeltherapie. Mit dem Aufkommen der DOAK wurden diese als Komponente der dualen Therapie im Vergleich zu VKA gestet. Es zeigte sich eine nochmalige deutliche Senkung der Blutungsereignisse, und die ischämischen Ereignisse waren nicht vermehrt. Wenn auch die duale Therapie mit Clopidogrel und DOAK etabliert ist, so klärt die Datenlage bislang nicht vollständig, über welchen Zeitraum die ASS-Gabe erfolgen sollte. In der Leitlinie wird klar betont, dass periinterventionell nicht auf ASS verzichtet werden kann. Allerdings empfiehlt sie auch das Absetzen von ASS innerhalb der ersten Woche, um die Blutungsereignisse zu minimieren. Wenn jedoch ein hohes Risiko für eine Stentthrombose vorliegt (z. B. Hauptstamm- oder Bifurkationsintervention), kann es erforderlich werden, ASS länger zur dualen Therapie hinzuzugeben, beispielsweise einen Monat lang.
Medikamentöse Therapie zur Senkung des LDL-Spiegels
Die neue Leitlinie der ESC zusammen mit der European Atherosclerosis Society leitet aus der aktuellen Datenlage ab, dass bei Patienten mit CCS ein Zielwert von < 55 mg/dl LDL-Cholesterin erreicht werden soll. Liegt der LDL-Cholesterinspiegel ohne Therapie zwischen 70 und 135 mg/dl, sollte angestrebt werden, ≤ 50 % des Ausgangs-LDL zu erreichen. Die primäre Medikation ist ein Statin. Wenn das Therapieziel nicht erreicht werden kann, wird zusätzlich Ezetimib eingesetzt.
Bei Bestehen eines ausgeprägten Nebenwirkungsprofils bzw. bei Nicht-Erreichen der Zielwerte können PCSK9-Inhibitoren eingesetzt werden. Dies gilt insbesondere für Patienten mit einem hohem Risiko (Klasse-I A-Empfehlung).
Weitere medikamentöse Therapieansätze
Bei mehr als 60 % der Patienten mit einer Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) ist ein CCS die Ursache. Häufig ist in der Anamnese ein großer Infarkt aufgetreten. Die medikamentösen Bausteine der Herzinsuffizienztherapie (ACE-Hemmer, Betablocker, Aldosteronrezeptorantagonisten, Angiotensin-Rezeptor-Neprilysin-Inhibitoren) kommen in Abhängigkeit vom Schweregrad der Herzinsuffizienz zum Einsatz. Der Hormonersatztherapie kommt kein Stellenwert zu.
Diabetes mellitus ist ein wesentlicher Risikofaktor bei Patienten mit CCS. Mehrere Studien haben gezeigt, dass mit dem Einsatz von Sodium-Glukose-Co-Transporter-2-(SGLT2-)Inhibitoren (z. B. Empa-, Cana- oder Dapagliflozin) und Glucagon-like-peptide-1-(GLP-1-)-Rezeptoragonisten (z. B. Sema- oder Liraglutid) eine signifikante Reduktion kardiovaskulärer Ereignisse erreicht werden kann. In den Studien mit dem SGLT2-Inhibitor Empagliflozin und den GLP-1-Rezeptoragonisten Liraglutid oder Semaglutid schloss dies eine signifikante Verminderung der Sterblichkeit mit ein. Aufgrund dieser Datenlage empfehlen die aktuellen Leitlinien bei Patienten mit Diabetes mellitus den Einsatz von SGLT-2-Inhibitoren oder GLP-1-Rezeptoragonisten [16].
4.3. Revaskularisation (PCI, koronare Bypassoperation)
Die Ziele einer Revaskularisationstherapie sind die Linderung der Symptomatik und eine Verbesserung der Prognose. Im Gegensatz zur vorherigen Leitlinie von 2013 wird die Revaskularisationstherapie nicht mehr so restriktiv gesehen. Durch die intrakoronare Messung der FFR kann zuverlässiger als mit der Morphologie alleine eine hämodynamisch bedeutsame Stenose der epikardialen Koronargefäße diagnostiziert werden.
Neuere Daten zeigen, dass durch die FFR geführte interventionelle Koronartherapie (PCI) im Vergleich zur medikamentösen Therapie bessere Ergebnisse erzielt werden. Dies betrifft nicht nur eine ausgeprägtere Symptomfreiheit sondern auch eine Reduktion von Infarktereignissen und kardialem Tod.
Die Entscheidung zur Revaskularisation ist neben der Symptomatik auch abhängig vom Ausmaß der Ischämie. Es liegen Daten vor, die eine Prognoseverbesserung durch eine Revaskularisation bei Patienten mit einem Ischämieareal von mehr als 10 % des linksventrikulären Myokards zeigen. Die Indikation zur Revaskularisation ist individuell auf die Patienten abzustimmen.
Für die Entscheidungsfindung sind sowohl morphologische als auch funktionelle Parameter zu berücksichtigen. Morphologische Parameter, die für eine Revaskularisation sprechen, sind die höhergradige Hauptstammstenose der linken Koronar- arterie und hochgradige (> 90 %) Stenosen in den proximalen Koronargefäßabschnitten.
Funktionelle Parameter, die für eine Revaskularisation sprechen, sind eine FFR < 0.80 und ein großes Ischämieareal (> 10 %, z. B. dargestellt durch Myokard- szintigraphie oder Kardio-MRT). Die Revaskularisation kann durch eine PCI oder eine koronare Bypassoperation (CABG) erfolgen. Dank der modernen Katheterverfahren kann immer häufiger eine PCI durchgeführt werden, während die Bypassoperation ihren Stellenwert bei komplexer Hauptstammstenose und diffuser Dreigefäßerkrankung behält.
Zusammenfassung
Die Europäische Gesellschaft für Kardiologie hat mit der Leitlinie 2019 eine neue Betrachtungsweise der koronaren Herzerkrankung eingeführt [17]. Mit dem Terminus chronisches Koronarsyndrom wird sie dem häufig jahrzehntelangen Verlauf der Erkrankung gerecht. Die Leitlinie weist richtigerweise darauf hin, dass ein stabiler Verlauf der koronaren Herzerkrankung von Ereignissen mit einem akuten Koronarsyndrom unterbrochen sein kann. Die vorgeschlagene Diagnostik der koronaren Herzerkrankung wertet die koronare CT-Untersuchung auf. Für den Ein- oder Ausschluss einer koronaren Herzerkrankung wird das konventionelle Belastungs-EKG erheblich abgewertet.
Die Leitlinie beleuchtet intensiv den Stellenwert der medikamentösen Therapie. ASS hat in der Primärprävention nur noch einen deutlich reduzierten Stellenwert, gehört in der Sekundärprävention aber zur langfristigen Standardtherapie und kann bei Patienten mit sehr hohem Risiko durch die zusätzliche Gabe eines P2Y12-Inhibitors oder Rivaroxaban in niedriger Dosis ergänzt werden.
Der LDL-Cholesterinwert sollte bei Patienten mit CCS primär mittels Statinen und – wenn erforderlich – zusätzlich mit Ezetimib oder PCSK-9-Inhibitoren auf < 55 mg/dl eingestellt werden. Dies gilt insbesondere für Hochrisikopatienten.
Bei Patienten mit koronarer Herzerkrankung und Diabetes mellitus hat die Therapie mit einem SGLT-2-Inhibitor eine Klasse I-Empfehlung. Bei symptomatischen Patienten und/oder einer ausgeprägten Myokardischämie wird die Revaskularisation empfohlen. Überwiegend erfolgt die Revaskularisation mittels PCI, bei komplexen Hauptstammstenosen und koronarer Dreigefäßerkrankung behält die Bypassoperation ihren Stellenwert.
Abkürzungsverzeichnis | |
ACS | akutes Koronarsyndrom (acute coronary syndrome) |
ASS | Acetylsalicylsäure |
CABG | koronare Bypassoperation |
CCB | Calciumkanalblocker |
CCS | chronisches Koronarsyndrom (chronic coronary syndrome) |
CTA | CT-Angiographie |
DAPT | duale Thrombozytenaggregationshemmung |
DOAK | Direkte orale Antikoagulantien |
ESC | Europäischen Gesellschaft für Kardiologie – European Society of Cardiology |
EF | Ejektionsfraktion |
FFR | Fractional Flow Reserve – fraktionelle Flussreserve. Index zur Bestimmung des Blutdurchflusses in den Herzkranzgefäßen (ohne bzw. mit Stenosen). |
GLP-1-Rezeptoragonisten | blutzuckersenkende Arzneistoffe |
HFrEF | Herzinsuffizienz mit erniedrigter linksventrikulärer Ejektionsfraktion |
LAD | Ramus interventricularis anterior, kurz RIVA oder LAD, ist einer der beiden Hauptäste der Arteria coronaria sinistra |
PCI | perkutane Koronarintervention, koronare Bypassoperation |
SGLT-2- Inhibitoren | Arzneistoffe aus der Gruppe der Antidiabetika. SGLT2-Inhibitoren hemmen spezifisch den renalen, natriumabhängigen Glukosetransporter SGLT-2 (Sodium dependent glucose co-transporter 2) |
VKA | Vitamin K-Antagonisten |
Prof. Dr. med. Thomas Voigtländer, Prof. Dr. med. Holger Eggebrecht, Prof. Dr. med. Christoph Liebetrau, Prof. Dr. med. Bernd Nowak, Prof. Dr. med. Axel Schmermund
Korrespondenzadresse: Prof. Dr. Thomas Voigtländer, Cardioangiologisches Centrum Bethanien, Agaplesion Bethanien Krankenhaus, Im Prüfling 23, 60389 Frankfurt, E-Mail: t.voigtlaender@ccb.de
Die Literaturhinweise finden Sie am Ende dieser Seite unter „Artikel herunterladen“ in der PDF-Version dieses Artikels.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem -Artikel „Chronische koronare Herzerkrankung – Diagnose und Behandlung nach der Leitlinie der Europäischen Gesellschaft für Kardiologie“ von Prof. Dr. med. Thomas Voigtländer et al. finden Sie in der Printausgabe sowie am Ende dieser Seite unter „Artikel herunterladen“ in der PDF-Version dieses Artikels und im Mitglieder-Portal der Landesärztekammer Hessen (https://portal.laekh.de). Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Mitglieder-Portal vom 25. April 2021 bis 24. Oktober 2021 möglich. Die Fortbildung ist mit zwei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben.
Dieser Artikel hat ein Peer-Review- Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte.