VNR: 2760602021122640001
Christoph Dumke, Prof. Dr. med. Rita Engenhart-Cabillic
Einleitung
Das Prostatakarzinom ist mit 1.276.106 Neuerkrankungen im Jahr 2018 die zweithäufigste Tumorerkrankung bei Männern weltweit. Mit einem Anteil von 22,7 % aller neu diagnostizierten Krebsfälle ist es das häufigste Tumorleiden von Männern in Deutschland und mit 11,6 % die zweithäufigste Krebstodesursache.
Das weltweite Verteilungsmuster unterscheidet sich in Abhängigkeit vom Entwicklungsstand der Länder. Die Inzidenz in Nordeuropa liegt z.B. bei 85,7/100.000 Einwohner und in Nordafrika nur bei 13,2/100.000. Eine wesentliche Rolle für die höhere Inzidenz in den Industrienationen sowie einem Anstieg Anfang der 1990er Jahre spielt die flächendeckende Einführung des PSA-Screenings (PSA= Prostata Spezifisches Antigen) als Früherkennungsuntersuchung. [1–3]
Die überwiegende Mehrzahl der Prostatakarzinome sind azinäre Adenokarzinome (syn. Prostatakarzinom), die multifokal in der Außenzone der Prostata auftreten.
Neben dem ethnischen Hintergrund und einer positiven Familienanamnese ist vor allem das Alter einer der wichtigsten Risikofaktoren für das Auftreten eines Prostatakarzinoms [4]. Da das mittlere Erkrankungsalter in Deutschland bei 72 Jahren liegt, sind individualisierte Therapiekonzepte unter Berücksichtigung von Komorbiditäten, Lebenserwartung und Patientenwunsch gefordert. Die Entscheidung für eine Therapie sollte daher in interdisziplinären Tumorkonferenzen getroffen werden und eine Behandlung in zertifizierten Zentren erfolgen.
Diagnostik und Staging
Früherkennung
Die digital rektale Untersuchung (DRU) ist die diagnostische Methode der Wahl bei Verdacht auf ein Prostatakarzinom. Einem suspektem Tastbefund folgt eine Stanzbiopsie unabhängig vom PSA-Wert. Prostatakarzinome werden häufig im Rahmen von Früherkennungsuntersuchungen diagnostiziert, die aktuell für Männer ab 45 Jahren und bei familiärer Vorbelastung ab 40 Jahren angeboten werden. Zur Früherkennungsuntersuchung sollte auch eine PSA-Bestimmung gehören (derzeit werden die Kosten dafür von gesetzlichen Krankenversicherungen in der Regel noch nicht übernommen) in Kombination mit einer DRU. Bei unauffälligem Tastbefund, aber einem kontrollierten PSA-Wert von ≥ 4 ng/ml soll ebenfalls eine Prostatastanzbiospie durchgeführt werden [5–7].
Biopsie
Die Biopsie erfolgt in der Regel transrektal, sonografisch kontrolliert, unter Antibiotikaschutz. Entnommen werden insgesamt 10–12 Stanzzylinder aus unterschiedlichen Regionen der Prostata (Apex, Mitte und Basis) [6]. Ergänzend sollen auffällige Tastbefunde sowie malignitätsverdächtige Läsionen, die sich in bildgebenden Verfahren wie transrektalem Ultraschall (TRUS) und/oder MRT darstellen, gezielt biopsiert werden, um die Aussagesicherheit zu erhöhen. Besonders die multiparametrische MRT (mpMRT) hat in den vergangenen Jahren einen hohen Stellenwert bei der Diagnose und Detektion klinisch relevanter Tumor-areale zur gezielten Biopsie gewonnen [8, 9]. Bei der mpMRT werden Sequenzen akquiriert, die morphologische (T2 Sequenzen = hohe räumliche Auflösung) und funktionelle Informationen (DWI = diffusionsgewichtete Sequenzen; DCE = dynamische kontrast-verstärkte Sequenzen) erfassen, um die diagnostische Sicherheit zu erhöhen. Eine 2017 publizierte Studie mit 576 Patienten zeigte, dass durch die mpMRT bis zu 18 % mehr klinisch signifikante Tumore im Vergleich zur TRUS gesteuerten Biopsie detektiert werden konnten [8].
Staging
Bei der Stadieneinteilung (Tab. 1) unterscheidet man zwischen lokal begrenzten Tumoren (Stadium I und II), lokal fortgeschrittenen Tumoren (Stadium III), die die Prostatakapsel überschreiten, und metastasierten Tumoren (Stadium IV). In der DRU nicht tastbare und in der Bildgebung nicht sichtbare Tumore, die entweder inzidentell im OP-Präparat gefunden werden oder die in der Biopsie aufgrund eines erhöhten PSA-Wertes nachgewiesen werden, gehören in die Kategorie T1. Tastbare Tumore fallen in die Kategorie ≥ T2 [10].
Tab. 1: Stadieneinteilung des Prostatakarzinoms | |||
Stadium | T-Kategorie | N-Kategorie | M-Kategorie |
Stadium I | T1, T2a | N0 | M0 |
Stadium II | T2b, T2c | N0 | M0 |
Stadium III | T3, T4 | N0 | M0 |
Stadium IV | Jedes T | N1 | M0 |
Jedes T | Jedes N | M1 | |
Grading
Das Grading beim Prostatakarzinom erfolgt mittels Gleason Score (GS) der sich aus dem primären und sekundären Wachstumsmuster bzw. dem am schlechtesten differenzierten Tumoranteil zusammensetzt. Nach der ISUP Konsensuskonferenz von 2014 wird der GS allerdings zunehmend in sog. Grade Groups (1–5) übersetzt [11].
Risikogruppen
Prostatakarzinome im lokal begrenzten Stadium werden anhand des T-Stadiums, des GS und initialen PSA-Wertes prätherapeutisch in drei Risikogruppen unterteilt, welche das Risiko für einen PSA-Wiederanstieg (= biochemisches Rezidiv) nach kurativer Therapie angeben, siehe Tab. 2 [12]. Für diese Risikogruppen konnte in großen Validierungsstudien ebenfalls ein Zusammenhang mit dem krankheitsspezifischen und Gesamtüberleben nach kurativer Therapie festgestellt werden [13, 14].
Tab. 2: Risikogruppen des lokal begrenzten Prostatakarzinoms | |||||
Risikogruppe | T-Kategorie | PSA-Wert | Gleason Score | ||
Niedriges Risiko | cT1-T2a | und | ≤ 10 ng/ml | und | 6 |
Mittleres Risiko | cT2b | oder | > 10–20 ng/ml | oder | 7 |
Hohes Risiko | ≥ cT2c | oder | > 20 ng/ml | oder | 8–10 |
Therapieoptionen im nicht-metastasierten Stadium
Active Surveillance
Patienten mit niedrigem Risiko können statt einer radikalen Therapie engmaschig beobachtet werden (Active Surveillance = AS), wenn nicht mehr als zwei Stanzzylinder tumorbefallen sind und diese ≤ 50 % Tumorbefall zeigen. Dieses Vorgehen erlaubt es, die Nebenwirkungen der Tumortherapie bei klinisch indolenten Tumoren zu vermeiden, weist jedoch langfristig ein höheres Risiko für eine Krankheitsprogression auf [15].
Prostatektomie
Die radikale Prostatektomie (RPE) ist für lokal begrenzte Tumore sowie lokal fortgeschrittene Tumore eine primäre Therapieoption. Für Männer unter 65 Jahren mit lokal begrenzten Tumoren im UICC Stadium I-II und einem PSA-Wert ≤ 50 ng/ml wurde eine signifikante Verbesserung des tumorspezifischen und Gesamtüberlebens sowie der distanten Metastasierung zugunsten der RPE im Vergleich zur Observation festgestellt [16]. Dies galt hinsichtlich des tumorspezifischen Überlebens und distanter Metastasierung in einer Subgruppenanalyse ebenfalls für Niedrigrisiko-Patienten (T1-T2 N0 M0, GS 6, PSA ≤ 10 ng/ml) [16].
In einer aktuellen Auswertung der PIVOT-Studie konnte für lokal begrenzte Karzinome aller Risikogruppen zusammengenommen hingegen nur ein kleiner Effekt für ein verbessertes Gesamtüberleben nach median 18,6 Jahren Follow-Up zugunsten der RPE gesehen werden (im Mittel ein Lebensjahr), der noch kleiner für Niedrigrisiko-Patienten war [17]. Für lokal fortgeschrittene Tumore ist die Evidenz- lage aufgrund fehlender prospektiver Studien schlechter.
Bei der RPE werden sowohl Prostata als auch Samenblasen entfernt und eine vesikourethrale Anastomose hergestellt. Zudem wird simultan eine pelvine Lymphknotenentfernung zum weiteren Staging durchgeführt, auf die bei niedrigem Risikoprofil verzichtet werden kann. Technisch kann die RPE retropubisch, perineal, laparoskopisch oder roboter-assistiert laparoskopisch erfolgen.
Ca. 25–30 % der Patienten haben noch fünf Jahre nach RPE Kontinenzprobleme, wobei diese Zahl je nach Erfahrung des Operateurs variiert [18]. Bzgl. der Potenz liegt die Wahrscheinlichkeit für eine Erholung bei ca. 60 %, wenn ein bilaterales nervenschonendes Vorgehen möglich ist [19]. Nach EAU Guidelines ist ein solches Vorgehen bei Tumoren mit hohem Risiko für extrakapsuläres Wachstum auf der betreffenden Seite nicht empfohlen und der Potenzerhalt dementsprechend schlechter [20, 21]. Gegenüber den offen chirurgischen Techniken zeigten sich Vorteile für das laparoskopische Vorgehen hinsichtlich geringerem intraoperativen Blutverlust, kürzerer Krankenhausverweildauer und geringerem Schmerzmittelbedarf bei potenziellen Nachteilen für Kontinenz- und Potenzerhalt [22]. Eine Weiterentwicklung stellt die roboter-assistierte laparoskopische RPE (u. a. DaVinci) dar, die oben genannten Vorteile des laparoskopischen Vorgehens mit einem potenziell besseren Potenzerhalt vereint [23]. Beim Vergleich zwischen der offenen und roboter-assistierter laparoskopischen RPE konnten retrospektive Auswertungen und eine randomisierte Phase-3-Studie jedoch bisher keinen signifikanten Unterschied hinsichtlich funktioneller Ergebnisse und einen fraglichen Vorteil hinsichtlich onkologischer Ergebnisse feststellen [24, 25].
Perkutane Bestrahlung mit Photonen
Die perkutane Bestrahlung (External Beam Radiotherapy = EBRT) der Prostata ist eine kurative Therapieoption in den Stadien I-III und wird bei Hochrisikopatienten in der Regel mit einer Antihormontherapie kombiniert. Im lokal begrenzten Stadium ist die EBRT onkologisch gleichwertig zur RPE bei geringeren Raten an Inkontinenz und erektiler Dysfunktion. Die ProTecT-Studie (1999–2009) zeigte diesbezüglich eine Gleichwertigkeit zwischen Operation und Bestrahlung für die Endpunkte prostatakarzinomspezifisches Überleben, Metastasenfreiheit und Krankheitsprogression, aber einen signifikanten Unterschied bei der Benutzung von Vorlagen aufgrund von Inkontinenz sechs Jahre nach Therapie (ca. 20 % in der RPE Gruppe versus 4 % in der Radiotherapie Gruppe) [15, 26].
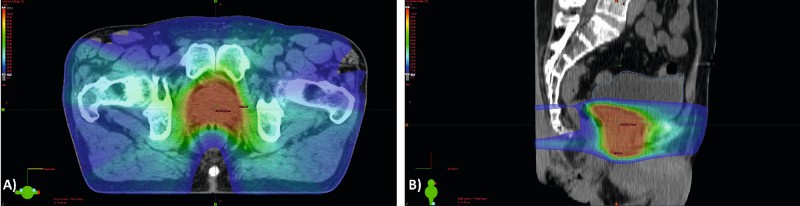
Für die erektile Dysfunktion zeigte sich, dass nach sechs Jahren noch 28–30 % der Männer, die eine Radiotherapie erhielten, potent waren, im Vergleich zu 15 % der Männer, die operiert wurden. Für die Radiotherapie wiederum wurde eine höhere Rate an irritativen Miktionsbeschwerden und gastrointestinalen Funktionsstörungen nach sechs Monaten festgestellt [15, 26]. Kritisch anzumerken ist, dass bei dieser Studie alte 3D-konformale Bestrahlungstechniken zum Einsatz kamen, die nicht mehr dem aktuellen Stand der Entwicklung entsprachen. Heute wird die Bestrahlung der Prostata als bildgeführte (Image Guided Radiotherapy = IGRT) Strahlentherapie in intensitätsmodulierter Technik (= IMRT/VMAT) mit hochenergetischen Photonen durchgeführt. Bei der modernen IGRT-IMRT wird die Dosis aus sehr vielen verschiedenen Winkeln eingestrahlt, um das Zielvolumen (Prostata und Samenblasenansatz) abzudecken, siehe Abb. 1.
Abb. 1: Bestrahlungsplan einer perkutanen Photonenbestrahlung für einen Patienten mit einem lokal begrenzten Prostatakarzinom der mittleren Risikogruppe in IMRT/VMAT-Technik., A) Axialer Schnitt des Bestrahlungsplanungs-CT mit Dosisverteilung., B) Sagittaler Schnitt des Bestrahlungsplanungs-CT mit Dosisverteilung. Rot = Hochdosisbereich (Prostata), blau = Niedrigdosisbereich.
Die daraus resultierende exaktere Anpassung des Hochdosisbereiches an das zu bestrahlende Gebiet in Kombination mit einer präziseren Dosisapplikation durch tägliche Lagekontrollen mittels Cone- Beam-CT führen zu einer besseren Schonung der Risikoorgane (Rektum und Harnblase) mit reduzierten Nebenwirkungsraten [27].
Die Ergebnisse der ProtecT-Studie konnten in der aktuellen Auswertung der CAESAR-Studie (2011–2012), bei der die Nebenwirkungen zeitgemäßer IMRT-IGRT-Radiotherapie mit denen moderner Operationstechniken verglichen wurden, hinsichtlich klinisch relevanter Vorteile für die EBRT bezüglich Inkontinenz und Erhalt der Sexualfunktion nochmals bestätigt werden [28]. Zusätzlich ergab sich in dieser Studie beim Vergleich EBRT versus AS (Observation) für Patienten mit günstigem Risikoprofil zu keinem Zeitpunkt ein Unterschied hinsichtlich Harnwegs-, Sexual- und gastrointestinaler Funktion über einen Zeitraum von fünf Jahren, was die gute Verträglichkeit der EBRT unterstreicht. Zur kurativen Behandlung des Prostatakarzinoms wird aktuell eine Dosis von 74–80 Gy empfohlen (historisch wurden 64–70 Gy verabreicht), da eine Dosis- eskalation mit einer signifikanten Verbesserung der lokalen Kontrolle und geringerer Rate an biochemischen Rezidiven einherging [29]. Diese Dosis wird in der Regel in 37–40 Fraktionen mit einer Einzeldosis von 2 Gy appliziert. Eine hypofraktionierte Bestrahlung mit höheren Einzeldosen zugunsten einer kürzeren Gesamtbehandlungszeit wird aufgrund fehlender Langzeitdaten in der aktuellen Leitlinie (noch) nicht empfohlen [7].
Protonentherapie
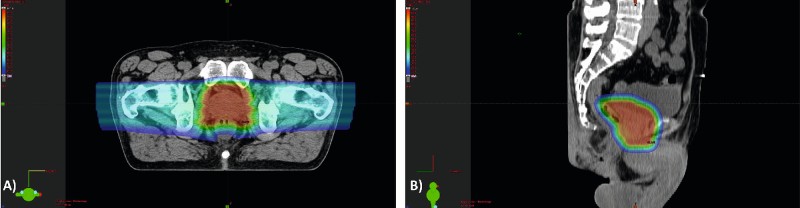
Der Vorteil der Protonen liegt darin, dass sie den Großteil ihrer Energie in einer spezifischen Gewebetiefe abgeben (Bragg-peak) bei geringer Eingangs- und Ausgangsdosis. Dadurch kann, im Gegensatz zur IMRT, die gesamte Dosis über wenige Einstrahlrichtungen im Gewebe deponiert werden (Abb. 2). Über einen steilen Dosisgradienten wird eine Schonung des Rektums und der Harnblase mit geringen Toxizitätsraten [34, 35] bei reduzierter Integraldosis aufgrund eines reduzierten Niedrigdosisbereiches erreicht (Vergleich IMRT mit Verteilung des Niedrigdosisbereiches über das ganze Becken (Abb. 1) vs. Protonenbestrahlung mit zwei Einstrahlrichtungen über die Hüften (Abb. 2).
Eine randomisierte Studie zeigte für eine kombinierte dosiseskalierte Photonen- und Protonentherapie (79,2 Gy) eine signifikant bessere langfristige Tumorkontrolle bei gleicher niedriger Toxizität im Vergleich zur kombinierten Therapie mit 70,2 Gy [36]. Randomisierte Studien zum Vergleich IMRT versus alleiniger Protonentherapie mit IGRT stehen aktuell noch aus. Hier müssen Daten generiert werden, um einen möglichen Vorteil durch die Protonentherapie weiter zu untersuchen.
Abb. 2: Bestrahlungsplan einer perkutanen Protonenbestrahlung für den in Abb. 1 dargestellten Patienten. A) Axialer Schnitt des Bestrahlungsplanungs-CT mit Dosisverteilung. B) Sagittaler Schnitt des Bestrahlungsplanungs-CT mit Dosisverteilung. Rot = Hochdosisbereich (Prostata), blau = Niedrigdosisbereich.
HDR-Brachytherapie
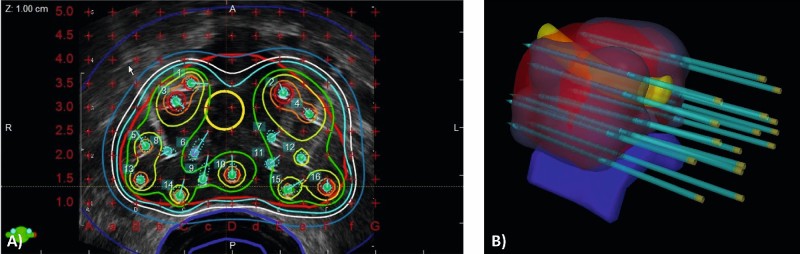
Die Brachytherapie (griech. brachy = kurz, nah) hat den Vorteil, dass die Strahlenquelle unmittelbar in oder an dem Tumor liegt, wodurch die Applikation einer hohen Strahlendosis unter Schonung der umgebenden Risikoorgane möglich wird. Zu diesem Zweck werden Hohlnadeln transperineal unter Ultraschallkontrolle und Narkose temporär in die Prostata eingebracht, in die anschließend im Nachladeverfahren (Afterloading) eine Strahlenquelle computergesteuert für wenige Sekunden bis Minuten eingeführt wird. Die applizierte Dosis und das Strahlenfeld ergeben sich aus der Position der Nadeln und der Haltezeiten der Strahlenquelle in den einzelnen Nadeln (Abb. 3). Als Strahlenquelle werden Radionuklide (γ-Strahler) mit hoher Dosisleistung (High-Dose-Rate = HDR) verwendet, wobei Iridium-192 die gebräuchlichste ist. Die HDR-Brachytherapie (z. B. 2x9 Gy) wird standardmäßig als Kombinationskonzept zusammen mit einer EBRT (z. B. 25x2 Gy) angewendet. Diese Form der Dosiseskalation zeigte mit einer krankheitsspezifischen Fünfjahres-Überlebensrate von 94 % ausgezeichnete onkologische Ergebnisse bei niedrigen Raten an Nebenwirkungen ≥ III° (2,5 %) und wird daher in der Leitlinie [7] für lokal begrenzte Karzinome des mittleren und hohen Risikos sowie für lokal fortgeschrittene Tumore empfohlen [37, 38]. Weniger verbreitet ist die HDR-Brachytherapie als Monotherapie, die bei lokal begrenzten Tumoren aller Risikogruppen ebenfalls eine hohe Tumorkontrolle und geringe Toxizität gezeigt hat [39, 40].
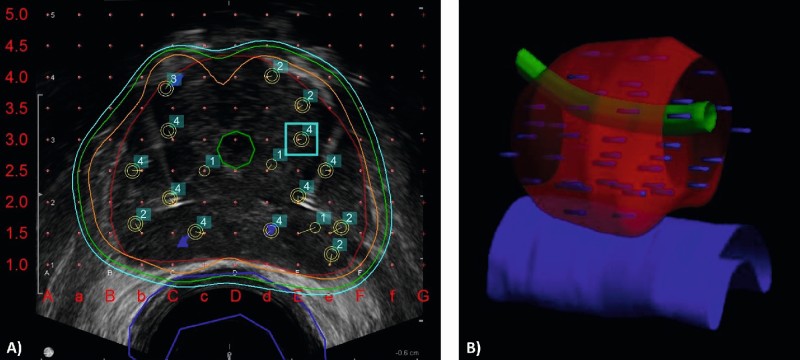
Abb. 3: Bestrahlungsplan einer HDR-Brachytherapie bei einem Patienten mit lokal begrenzten Prostatakarzinom der mittleren Risikogruppe. Rote Kontur = Prostata, blaue Kontur = Rektum(-schleimhaut), gelbe Kontur Urethra. A) Axialer Schnitt der Prostata in der transrektalen Sonografie mit Nadelpositionen (1–16) und Isodosenlinien. Weiße Linie = 90 % Isodose, die das Zielvolum (Rote Kontur = Prostata) umschließt. B) Dreidimensionale Darstellung des Bestrahlungsplanes, der Anatomie und der in die Prostata eingebrachten Nadeln.
LDR-Brachytherapie
Bei der LDR (Low-Dose-Rate)-Brachytherapie werden Strahlenquellen mit geringer Dosisleistung dauerhaft in die Prostata eingebracht. Am gebräuchlichsten sind hier sogenannte Jod-125-Seeds, Metallstücke mit einer Länge von 4 mm und Breite von 1 mm, die über Kunststoffstücke zu Ketten verbunden sind. Die Implantation geschieht ebenfalls transperineal ultraschallkontrolliert in Vollnarkose oder Spinalanästhesie über dünne Hohlnadeln, die zuvor mit den Jod-Seeds bestückt werden. Die Verschreibungsdosis für Jod-Seeds beträgt 145 Gray (Gy) und die Bestrahlungsplanung erfolgt intraoperativ, wobei sich die Dosisverteilung über die Anzahl und Positionierung der Seeds ergibt (Abb. 4).
Ein Vorteil dieses Verfahrens ist, dass nur ein einmaliger Eingriff nötig ist und die Seeds aufgrund der geringen Halbwertszeit von Jod-125 ein Leben lang im Patienten verbleiben können. Empfohlen wird die Therapie aktuell nur für lokal begrenzte Karzinome mit niedrigem Risiko, da nur für diese Patienten die gleiche biochemische Kontrolle wie nach EBRT oder RPE erreicht werden konnte [12]. Für die Niedrigrisikogruppe zeigte sich auch in der Langzeitnachbeobachtung eine exzellente Tumorkontrolle mit einem 15-Jahres biochemisch- rezidivfreien Überleben von 85,9 % [41].
Ein Nachteil des Verfahrens sind stärkere irritative Miktionsbeschwerden gegenüber der EBRT kurz nach der Therapie (sechs Monate) [28], weswegen sich vor allem Patienten ohne Obstruktion mit einem Prostatavolumen von ≤ 60 ml und einem IPSS (International-Prostate-Symptom-Score) von ≤ 12 für die Therapie eignen.
Abb. 4: Bestrahlungsplan einer Seeds-Brachytherapie (Jod-125) bei einem Patienten mit einem lokal begrenzten Prostatakarzinom der niedrigen Risikogruppe. Rote Kontur = Prostata, blaue Kontur = Rektum(-schleimhaut), grüne Kontur Urethra. A) Axialer Schnitt der Prostata in der transrektalen Sonografie mit Seedspositionen (Zahlen = Anzahl der Seeds pro Nadel) und Isodosenlinien. Grune Linie = 100 % Isodose, die das Zielvolum (Rote Kontur = Prostata) umschließt. B) Dreidimensionale Darstellung des Bestrahlungsplanes und der Anatomie. Blaue Zylinder = Anzahl und Lage der Seeds in der Prostata.
EBRT postoperativ
Auch in der postoperativen Situation hat die perkutane Bestrahlung mit Photonen (EBRT) einen hohen Stellenwert. Hier wird die Prostataloge unter Einschluss der vesikourethralen Anastomose mit 66 Gy bestrahlt. Unterschieden wird dabei zwischen einer adjuvanten Radiotherapie bei Patienten mit postoperativem Abfall des PSA-Wertes in den Nullbereich und vorliegenden Risikofaktoren (pT3-Stadium mit R1-Resektion und/oder Samenblaseninfiltration) und der Salvage-Radiotherapie bei Patienten mit einem postoperativen PSA-Wiederanstieg aus dem Nullbereich (biochemisches Rezidiv) oder mit PSA-Persistenz nach Operation [7].
Drei große randomisierte Studien (ARO 96–2, EORTC 22911 und SWOG), die eine adjuvante Radiotherapie bei vorliegenden Risikofaktoren mit Observation verglichen, konnten ein signifikant besseres biochemisch rezidivfreies Überleben zugunsten der Radiotherapie nachweisen [30, 31, 50].
Eine der Studien (SWOG) zeigte zudem ein signifikant besseres metastasenfreies und Gesamtüberleben [30]. Anzumerken ist, dass der Effekt bei vorliegender R1-Resektion am größten war und dementsprechend die Empfehlung zur adjuvanten Radiotherapie bei pT3-Tumoren mit R1-Resektion in der aktuellen S3-Leitlinie am stärksten ist [7].
Nichtsdestotrotz ist die adjuvante Radiotherapie auch mit gastrointestinalen und urogenitalen Nebenwirkungen verbunden wie die Verschlechterung einer postoperativ bestehenden Inkontinenz. Viele Patienten entwickeln auch bei vorliegenden Risikofaktoren kein biochemisches Rezidiv (54 % der Patienten im Observationsarm der ARO 96–02-Studie hatten nach 4,7 Jahren kein Rezidiv) [7, 50].
In der gültigen Fassung der S3-Leitline von 2019 wird daher bereits darauf hingewiesen, den Patienten über die Alternative einer Observation mit Salvage-Radiotherapie bei erneutem PSA-Anstieg aufzuklären [7]. Diese sollte dann möglichst frühzeitig bei PSA-Werten < 0,5 ng/ml begonnen werden [7, 51].
Zwei kürzlich publizierte randomisierte Studien (RAVES, RADICALS-RT) verglichen die adjuvante Radiotherapie mit einer PSA-getriggerten Salvage-Radiotherapie bei Hochrisikopatienten [32, 33]. Bestrahlt wurde nur bei einem postoperativem PSA-Wiederanstieg auf ≥ 0,2 ng/ml (RAVES) oder ≥ 0,1 ng/ml (RADICALS-RT). In den Salvage-Gruppen konnte bei mindestens der Hälfte der Patienten die Logenbestrahlung vermieden werden und es zeigten sich geringere urogenitale Nebenwirkungen (Inkontinenz und Urethrastrikturen) im Vergleich zu den Patientengruppen, die eine adjuvante Radiotherapie erhielten. Zudem konnte kein signifikanter Unterschied im biochemisch rezidivfreien Überleben nach einer allerdings relativ kurzen Nachbeobachtungszeit von median fünf und sechs Jahren gefunden werden.
Die engmaschige Beobachtung mit regelmäßigen PSA-Bestimmungen und Salvage-Radiotherapie im Falle eines postoperativen PSA-Anstiegs kann dementsprechend eine gute Alternative für ältere Patienten sein, während für junge Patienten mit entsprechenden Risikofaktoren weiterhin die adjuvante Radiotherapie der Standard sein sollte.
Radiotherapietechniken beim Prostatakarzinom | |
EBRT | External Beam Radiotherapy = perkutane Bestrahlung mit Photonen. |
3D-konformale Radiotherapie | EBRT, bei der durch geometrische Formung der Strahlenfelder die Dosisverteilung möglichst exakt an das Zielgebiet (Tumor) angepasst wird. |
IMRT/VMAT | Spezielle Form der 3D-konformalen Radiotherapie, bei der zur Anpassung der Dosisverteilung an das Zielgebiet über die geometrische Formung hinaus die Fluenzen der Strahlungsfelder moduliert werden* (modernste Form der EBRT), siehe Abb. 1. |
IGRT | Image Guided Radiotherapy = bildgeführte Strahlentherapie (Lagekontrolle des Patienten mittels Röntgen oder Cone-Beam-CT). |
Protonentherapie | Perkutane Bestrahlung mit geladenen Wasserstoffkernen, siehe Abb. 2. |
Brachytherapie | Kurzdistanztherapie mit umschlossenen Strahlenquellen, die in oder nahe an den Tumor gebracht werden. |
HDR-Brachytherapie | High Dose Rate = Brachytherapie mit Strahlenquellen, die eine hohe Dosisleistung haben (Beispiel Iridium-192, siehe Abb. 3). |
LDR-Brachytherapie | Low Dose Rate = Brachytherapie mit Strahlenquellen, die eine geringe Dosisleistung haben (Beispiel Jod-125-Seeds, siehe Abb. 4). |
SABR | Stereotactic Ablative Radiotherapy = stereotaktische Radiochirurgie mit Photonen (einmalige, oder wenige hochpräzise Bestrahlungen mit hohen Einzeldosen). |
* Leitlinie zur Strahlentherapie mit fluenzmodulierten Feldern (IMRT), DEGRO 2018. | |
Therapieoptionen im metastasierten Stadium
Medikamentöse Therapie
Bedeutend für die Auswahl der Therapie des metastasierten Prostatakarzinoms ist die Unterscheidung zwischen einer hormonsensitiven Erkrankung und einer Kastrationsresistenz. Nach den Ergebnissen der STAMPEDE- und CHAARTED-Studien ist bei Erstdiagnose eines metastasierten hormonsensitiven Prostatakarzinoms die Kombination aus Chemotherapie (Docetaxel) und einer Antihormontherapie mit einem signifikanten Überlebensvorteil verbunden [42, 43] und wird daher leitliniengerecht empfohlen.
Auch die Kombination aus Antihormontherapie und Abirateron (einem Hemmstoff der endogenen Androgenproduktion) zeigte in der LATITUDE-Studie einen signifikanten Überlebensvorteil und wird daher als Alternative zum Docetaxel in der Erstlinientherapie eingesetzt [44]. Patienten, die sich nicht für eine Kombinationstherapie eignen, erhalten eine alleinige Antihormontherapie.
Häufig entwickelt sich erst nach Jahren eine Kastrationsresistenz, die zu einer weiteren Krankheitsprogression unter antihormoneller Therapie führt. Vor allem bei symptomatischem Progress wird dann eine Behandlung mit Docetaxel, Abirateron oder Enzalutamid eingeleitet. In der Zweitlinie kann zudem nach Ausschöpfen der oben genannten Therapieoptionen eine nuklearmedizinische Radioligandentherapie erfolgen.
Palliative Radiotherapie
Die perkutane Strahlentherapie hat auch in der palliativen Situation einen hohen Stellenwert, vor allem bei der Behandlung von ossären Metastasen, da hier eine Schmerzlinderung und Stabilisierung der befallenen Stellen durch Rekalzifizierung erreicht werden kann. Kommt es aufgrund von Wirbelsäulenmetastasen zu einer Instabilität, wird interdisziplinär entschieden, ob vor der Radiotherapie eine stabilisierende Operation sinnvoll ist. Bei begleitenden neurologischen Symptomen (Lähmungen) ist eine frühe Intervention wichtig. So ist eine operative Dekompression des Myelons gefolgt von einer Bestrahlung der alleinigen Radiotherapie hinsichtlich funktioneller Ergebnisse überlegen [45].
Sonderfall oligometastasiertes Prostatakarzinom
Bereits 1995 stellten Hellmann und Weichselbaum die Theorie einer Stufenweise verlaufenden Metastasierung auf, wonach ein intermediäres Stadium der Oligometastasierung zwischen lokalisierter Erkrankung und ausgedehnter Fernmetastasierung existiert [46]. Je nach Definition handelt es sich bei einer Oligometastasierung um das Vorliegen von bis zu drei oder bis zu fünf Metastasen. Diese Patienten könnten von einer radikalen Lokaltherapie aller Metastasen, also einer metastasenspezifischen Therapie (Metastasis Directed Therapy = MDT) profitieren. Geeignet ist hierfür vor allem eine stereotaktisch ablative Radiotherapie (= SABR), bei der mit hohen Einzeldosen in wenigen Fraktionen das Zielgebiet hochpräzise eradiziert wird. Die randomisierte SABR-COMET-Studie konnte diesbezüglich für verschiedene Tumorentitäten einen medianen Überlebensvorteil von 22 Monaten bei Patienten mit bis zu fünf Metastasen zeigen, wenn diese zusätzlich zur palliativen Systemtherapie eine SABR erhielten [47]. Für das Prostatakarzinom liegen aktuell zwei randomisierte Studien vor, die den Nutzen einer MDT für oligometastasierte Patienten untersucht haben. In der STOMP-Studie von 2018 wurden Patienten mit drei oder weniger Metastasen eingeschlossen, die mit MDT (SABR oder OP) behandelt wurden. Verglichen wurde gegen Beobachtung und der primäre Endpunkt war die Zeit bis zur Einleitung einer antihormonellen Therapie [48]. Für die Patienten, die eine MDT erhielten, ergab sich ein median acht Monate längeres hormontherapiefreies Überleben bei gleicher Lebensqualität im Vergleich zur Beobachtungsgruppe. Die gezielte Lokaltherapie von Metastasen kann somit den Beginn einer palliativen Systemtherapie und deren Nebenwirkungen effektiv hinauszögern.
Die kürzlich publizierten Ergebnisse der ORIOLE-Studie, in der ebenfalls Männer mit bis zu drei Metastasen eingeschlossen waren, zeigten ein verbessertes progressionsfreies Überleben durch MDT mittels SABR im Vergleich zur Observation (Progression nach sechs Monaten im SABR-Arm 19 % versus 61 % im Kontrollarm, p=0.005) bei geringer therapieassoziierter Toxizität [49]. Zudem konnte die Induktion einer Immunantwort im SABR-Arm nachgewiesen werden, was neben der lokalen Tumorkontrolle durch die Bestrahlung (98,9 %) auch einen systemischen Effekt vermuten lässt. Die MDT mittels perkutaner stereotaktischer Radiotherapie ist dementsprechend ein vielversprechendes Therapiekonzept für Prostatakarzinompatienten mit wenigen Metastasen und kontrolliertem Primarius.
Zusammenfassung
Das Prostatakarzinom ist eine komplexe und sehr heterogene Erkrankung mit einer großen prognostischen Variabilität. Es existiert eine Vielzahl an Behandlungsoptionen für unterschiedliche Stadien, die hinsichtlich des Nutzens und des Risikos für den einzelnen Patienten in interdisziplinären Fallkonferenzen abgewogen werden müssen. Hierbei sollten vor allem die Wünsche und Lebensumstände des Patienten im Mittelpunkt stehen.
Abkürzungsverzeichnis | |
AS | Active Surveillance, engmaschige Überwachung |
DRU | Digitale rektale Untersuchung |
DCE | MRT-Sequenz, dynamisch kontrastverstärkend |
DWI | MRT-Sequenz, diffusion weighted imaging, diffusionsgewichtete Sequenzen |
EAU | European Association of Urology |
EBRT | External Beam Radiotherapy |
GS | Gleason-Score. Histologische Beurteilung der Drüsenbeschaffenheit im Prostatagewebe. Prognosewert beim Prostatakrebs. Je höher der Wert, desto höher ist der Grad der Entdifferenzierung und desto schlechter ist die Prognose. |
Gy | Gray, Maßeinheit zur Angabe der angewendeten Strahlungsdosis |
HDR/LDR | High-Dosis-Rate/Low-Dosis-Rate |
IGRT | Image Guided Radiotherapy |
IMRT | Intensity Modulated Radiotherapy, damit kann die Dosis in angrenzenden Risikoorganen ohne Dosiseinbußen im Zielvolumen reduziert werden. |
IPSS | International-Prostate-Symptom-Score |
MDT | Metastasis Directed Therapy |
p-Wert | Signifikanzwert, Evidenzmaß für die Glaubwürdigkeit der Nullhypothese |
PSA | prostataspezifisches Antigen, Enzym |
RP, RPE | radikale Prostatektomie |
SABR | stereotaktisch ablative Radiotherapie, millimetergenaue Bestrahlung von Tumoren |
TNM-System | T = Größe und Ausdehnung des Tumors; N = Beteiligung der Lymphknoten; M = Vorhandensein von Metastasen |
T2-Sequenz | MRT-Sequenz, kontrastbildend. Geeignet zur Darstellung von Ödemen und Ergussbildungen; zur Unterscheidung von Zysten und soliden Tumoren. |
TRUS | Transrektaler Ultraschall |
UICC-Stadium | Stadien der Krebserkrankung nach der Union internationale contre le cancer (UICC), für die einzelnen Tumoren unterschiedlich. |
Christoph Dumke, Arzt in Weiterbildung
Prof. Dr. med. Rita Engenhart-Cabillic, Ärztliche Direktorin
beide: Klinik für Strahlentherapie und Radioonkologie, Universitätsklinikum Gießen und Marburg, Standort Marburg, E-Mail: engenhar@med.uni-marburg.de
Die Literaturhinweise finden Sie am Ende dieser Seite unter „Artikel herunterladen“ in der PDF-Version dieses Artikels.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Die Strahlentherapie, eine sehr gute Option beim Prostatakarzinom“ von Christoph Dumke und Prof. Dr. med. Rita Engenhart-Cabillic finden Sie nachfolgend abgedruckt und im Mitglieder-Portal der Landesärztekammer Hessen (https://portal.laekh.de) sowie auf den Online-Seiten des Hessischen Ärzteblattes (www.laekh.de). Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Mitglieder-Portal vom 25. März 2021 bis 24. September 2021 möglich. Die Fortbildung ist mit zwei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben.
Dieser Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte.
Laufzeit geändert: Alle CME-Fortbildungen sind jetzt nur noch sechs Monate lang zu bearbeiten.