VNR: 2760602020234370002
Prof. Dr. med. Richard Schulz, Prof. Dr. med. Tim O. Hirche, Prof. Dr. med. Boris A. Stuck
Einleitung
Schlafbezogene Atmungsstörungen (SBAS) gehören zu den häufigsten Schlafstörungen. Vor allem die obstruktive Schlafapnoe (OSA) besitzt quasi den Charakter einer Volkskrankheit. Die Prävalenz der OSA steigt in den entwickelten Ländern stetig weiter an – bedingt durch die zunehmende Häufigkeit der Adipositas, die Überalterung der Bevölkerung und den verbreiteten Einsatz diagnostischer Methoden wie der Polygraphie. Daten zur Prävalenz der OSA liegen mittlerweile auch für Deutschland (Mecklenburg-Vorpommern) vor [1]. Demnach leiden ca. 40 % der deutschen Bevölkerung an einer OSA mit einem Apnoe-Hypopnoe-Index (AHI) > 5/h. Ein OSA-Syndrom, d. h. eine OSA mit gleichzeitig vorhandener Tagesschläfrigkeit, findet sich bei ca. 5 %. Die Erkrankung ist häufiger bei Männern und älteren Menschen (> 60 Jahre).
SBAS besitzen eine große klinische Bedeutung. Insbesondere die OSA kann mit einer ausgeprägten Tagesmüdigkeit oder -schläfrigkeit verbunden sein, was u. a. eine erhöhte Unfallgefahr bewirkt. Weiterhin sind Einschränkungen der kognitiven Funktion möglich. Schließlich können kardiovaskuläre Folgeerkrankungen auftreten wie zum Beispiel eine arterielle Hypertonie bei der OSA oder eine pulmonale Hypertonie bei der schlafbezogenen Hypoventilation.
Klassifikation von SBAS
Die SBAS werden nach der „International Classification of Sleep Disorders“ (ICSD-3) in vier große Gruppen unterteilt [2]:
- obstruktive Schlafapnoe (OSA)
- zentrale Schlafapnoe (ZSA)
- schlafbezogene Hypoxämie
- schlafbezogene Hypoventilation
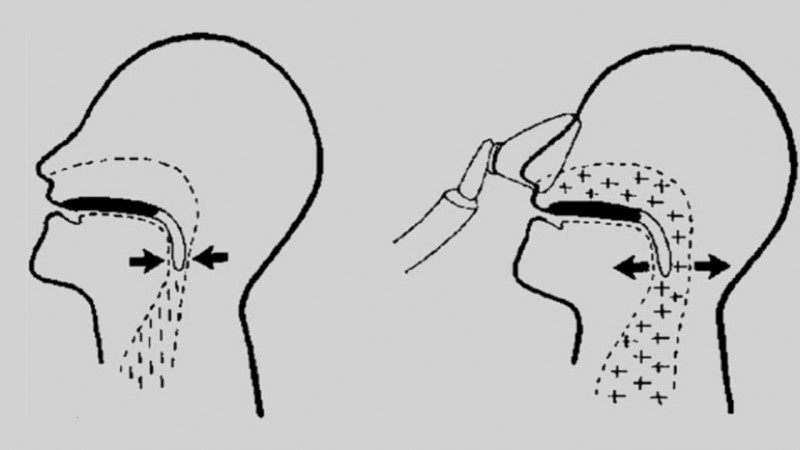
Die OSA wird durch den repetitiven Kollaps der oberen Atemwege im Schlaf verursacht. Gehäuft tritt dies im Tief- und REM (rapid eye movement)-Schlaf auf, da in diesen Schlafphasen der Muskeltonus am niedrigsten ist. Während den Atempausen besteht eine erhöhte Atemanstrengung, die betroffenen Patienten atmen gleichsam gegen den verschlossenen Pharynx an. Die Apnoen werden durch sog. Arousals, das heißt zentralnervöse Weckreaktionen, terminiert. Die Wiedereröffnung des Pharynx wird in der Regel von lautem, unregelmäßigen Schnarchen begleitet.
Bei zentralen Apnoen fehlt hingegen die Atemanstrengung aufgrund einer Störung der Atemregulation. Bei der schlafbezogenen Hypoxämie und Hypoventilation finden sich keine Atempausen, sondern länger anhaltende Verminderungen der Atmungsaktivität mit Betonung im REM-Schlaf.
Unmittelbare Folgen der SBAS sind eine Störung der normalen Schlafarchitektur (Fragmentation des Schlafes durch Arousals, Reduktion von Tief- und REM-Schlaf) sowie nächtliche Entsättigungen. Letztere treten bei der Schlafapnoe typischerweise intermittierend auf, man spricht auch von zyklischer Hypoxie. Dies ist zugleich die wesentliche pathophysiologische Grundlage der kardiovaskulären Folgeerkrankungen der OSA, es kommt zum Beispiel zu einer Sympathikusaktivierung mit Anstieg des Blutdrucks. Bei der schlafbezogenen Hypoxämie und Hypoventilation halten die Entsättigungen länger an, das heißt es tritt minutenlang keine Normalisierung der O2-Sättigung ein. Im Falle der schlafbezogenen Hypoventilation, nicht aber der schlafbezogenen Hypoxämie, werden diese Desaturationen von spiegelbildlichen Anstiegen des pCO2, das heißt einer Hyperkapnie, begleitet.
Diagnostik bei Verdacht auf SBAS
Die Diagnostik von SBAS folgt nach der kürzlich teilaktualisierten S3-Leitlinie „Nicht erholsamer Schlaf“ der Deutschen Gesellschaft für Schlafforschung und Schlafmedizin einer Art Stufenplan und wird zudem durch die „BUB-Richtlinien“ der kassenärztlichen Bundesvereinigung vorgegeben [3, 4].
Typische Symptome von SBAS sind nächtliche Atempausen, Schnarchen und Tagesmüdigkeit oder -schläfrigkeit. Oftmals ist dies den betroffenen Patienten aber selbst nicht bewusst bzw. sie negieren es, sodass fremdanamnestischen Angaben eine nicht zu unterschätzende Bedeutung zukommt. Weiterhin treten gehäuft insomnische Beschwerden, Nykturie, Nachtschweiß oder Erwachen mit Dyspnoe auf. Andererseits gibt es durchaus asymptomatische oder „minimal symptomatische“ OSA-Patienten. Zur Erfassung der klinischen Symptomatik können Fragebögen verwendet werden, zum Beispiel dient die Epworth Sleepiness Scale zur Beurteilung der subjektiven Tagesschläfrigkeit. Die körperliche Untersuchung richtet sich nach dem klinischen Beschwerdebild und den bestehenden Komorbiditäten und beinhaltet u. a. eine klinische Untersuchung des oberen Atemweges, zum Beispiel zur Erfassung einer Tonsillenhyperplasie oder skelettaler Fehlbildungen.
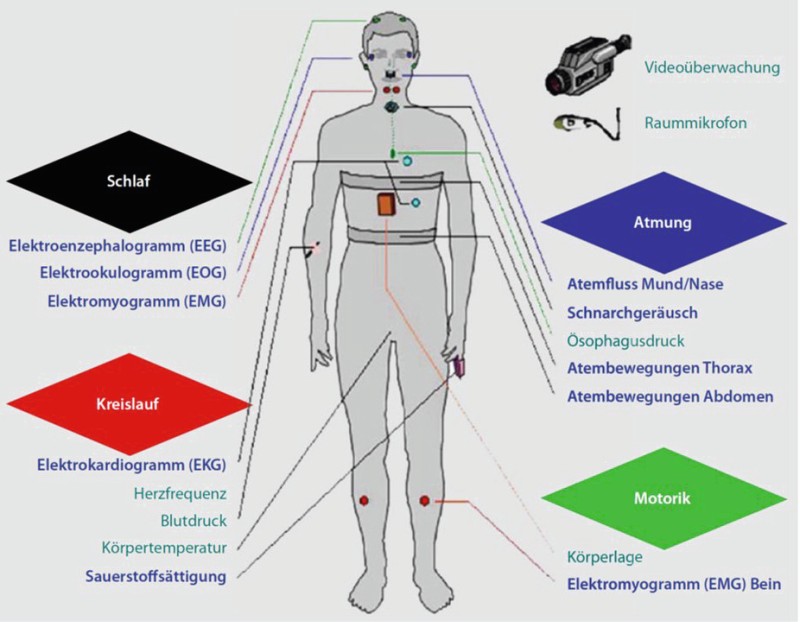
Es schließt sich dann die apparative Diagnostik mittels Polygraphie (PG) und Polysomnographie (PSG) an. Bei der PG wird ein portables Messgerät angelegt, das den nasalen Atemfluss, die Atemexkursionen von Thorax und Abdomen, Schnarchen und die Sauerstoffsättigung misst und auch die Körperlage bestimmt. Ist auf Basis dieser meistens ambulant durchgeführten Untersuchung keine Therapieentscheidung möglich oder besteht trotz unauffälliger Polygraphie weiterhin der Verdacht auf eine SBAS, wird eine PSG im Schlaflabor empfohlen [5, Abb. 1]. Hier wird unter Überwachungsbedingungen auch der Schlaf selbst gemessen, wozu Elektroencephalogramm, Elektrookulogramm und Elektromyogramm dienen. Bei Verdacht auf eine schlafbezogene Hypoventilation erfolgt eine Kapnometrie, das heißt eine meist transkutan vorgenommene Messung der pCO2-Werte. Die Lungenfunktionsprüfung inklusive Blutgasanalyse deckt zugrunde liegende Ventilationsstörungen auf.
Abb. 1: Polysomnographie. Monitoring der Atmung und des Schlafes unter Überwachungsbedingungen
Nächtliche Atempausen werden in Apnoen und Hypopnoen differenziert. Beide haben per definitionem eine Dauer von > 10 Sekunden und entsprechen unterschiedlich starken Limitationen des Atemflusses (komplett bei der Apnoe, inkomplett bei der Hypopnoe). Der AHI beschreibt die Summe der Apnoen und Hypopnoen pro Stunde Schlafzeit, als pathologisch wird ein Wert von > 5/h angesehen. Bei der schlafbezogenen Hypoxämie und Hypoventilation wird ein gewisses Ausmaß von Blutgasveränderungen überschritten, welches über die physiologischen Abfälle des pO2 bzw. Anstiege des pCO2 im Schlaf hinausgeht.
Die heute gemäß dem Manual der American Academy of Sleep Medicine gültigen diagnostischen Kriterien von SBAS sind in Tab. 1 zusammengefasst [6].
Tab. 1: Diagnostische Kriterien von SBAS nach dem Manual der „American Academy of Sleep Medicine“ | |
Apnoe | Verminderung des Atemflusses um ≥ 90%, Dauer ≥ 10 sec. |
Hypopnoe | Verminderung des Atemflusses um ≥ 30%, Dauer ≥ 10 sec. und SpO2-Abfall um ≥ 3% oder Arousal |
obstruktive Apnoe/Hypopnoe | Atemanstrengung während der Atempause erhalten |
zentrale Apnoe/Hypopnoe | keine Atemanstrengung während der Atempause |
Cheyne-Stokes-Atmung | ≥ 3 konsekutive zentrale Apnoen/Hypopnoen, typisches Crescendo/Decrescendo-Muster der Hyperventilationsphasen, Zyklusdauer ≥ 40 sec. |
Schlafbezogene Hypoxämie | SpO2 < 88% über ≥ 5 min. und Fehlen einer schlafbezogenen Hypoventilation |
Schlafbezogene Hypoventilation | pCO2 > 55 mmHg über ≥ 10 min. oder pCO2-Anstieg von ≥ 10 mmHg im Vergleich zum Wachzustand auf > 50 mmHg über ≥ 10 min. |
Obstruktive Schlafapnoe (OSA)
Kategorisierung
Traditionell wird der Schweregrad der OSA anhand des Apnoe-Hypopnoe-Index (AHI) festgelegt (leichtgradig: 5–15/h, mittelgradig: 15–30/h, schwer: > 30/h). Andere polysomnographische Parameter finden aber auch zunehmend Beachtung wie das Ausmaß der nächtlichen Hypoxie (sog. Hypoxie-Last) oder die Abhängigkeit der nächtlichen Atempausen von Körperlage und Schlafstadium. So werden Sub-Entitäten der OSA wie die Rückenlage- oder REM-Schlaf-abhängige OSA definiert, was zum Beispiel auch unter klinischen und therapeutischen Aspekten von Bedeutung ist (siehe unten).
Darüber hinaus sollten in der Abschätzung der Schwere des Krankheitsbildes (also nicht nur der Atmungsstörung) auch klinische Aspekte wie das Ausmaß der Tagessymptomatik und bestehende Komorbiditäten Berücksichtigung finden. Dies kann zum Beispiel durch Zuordnung der Patienten zu bestimmten Phänotypen erfolgen, welche durch Clusteranalysen erkannt wurden. Hier haben sich drei Gruppen herauskristallisiert: Patienten mit exzessiver Tagesschläfrigkeit, mit insomnischen Beschwerden und „minimal symptomatische“ Patienten [7]. Auch dies hat klinische und therapeutische Konsequenzen (siehe unten).
Schließlich kann die OSA nach dem vorherrschenden pathophysiologischen Mechanismus kategorisiert werden. Am häufigsten ist in diesem Zusammenhang sicherlich die Adipositas mit daraus resultierender Einengung der oberen Atem- wege.
Gleiches kann auch durch vergrößerte Tonsillen oder Kieferfehlstellungen verursacht sein. Schließlich spielen nicht-anatomische Faktoren wie eine Schwäche der den Pharynx dilatierenden Muskeln (M. genioglossus) oder der sogen. „fluid shift“ eine Rolle [8]. Letzterer ist vor allem bei der Entstehung der OSA bei hydropisch dekompensierten Patienten mit Herz- oder Niereninsuffizienz bedeutsam. In der schlafenden bzw. liegenden Position verschiebt sich Flüssigkeit von der unteren in die obere Körperhälfte, das heißt von den Beinen in den Pharynx. Hierdurch wird dann ein pharyngealer Kollaps begünstigt, das heißt es kommt zu obstruktiven Apnoen/Hypopnoen.
Unfallrisiko
Das Unfallrisiko von Patienten mit unbehandelter OSA ist deutlich erhöht. Dies hat natürlich besondere Bedeutung, wenn beruflich bedingt Steuer-/Überwachungstätigkeiten ausgeübt werden müssen (Busfahrer, Zugführer usw.). Es ist gesetzlich bisher nicht vorgeschrieben, solche Risikogruppen auf das Vorliegen einer OSA hin zu untersuchen. Ist eine OSA bekannt und verweigert der Patient die Therapie, sollte von ärztlicher Seite von einer weiteren Fahrtätigkeit abgeraten werden. Empfohlen wird eine Aufklärung über das erhöhte Unfallrisiko und eine schriftliche Fixierung des Sachverhaltes inkl. Unterschrift des Patienten, eine ärztliche Meldepflicht bei der Führerscheinbehörde oder Polizei besteht jedoch nicht.
Kardiovaskuläres Risiko
Das kardiovaskuläre (CV)-Risiko ist bei der OSA unabhängig von anderen Faktoren wie zum Beispiel Übergewicht, Diabetes mellitus und Rauchen erhöht [9]. Dies betrifft vor allem die Entwicklung einer arteriellen Hypertonie mit fehlender RR-Absenkung in der Nacht („non-dipping“), morgendlich erhöhten Blutdruckwerten und Therapierefraktärität gegenüber Antihypertensiva. Davon betroffen sind vor allem Patienten mit schwerer OSA (AHI > 30/h und/oder ausgeprägte Entsättigungen) und solche mit REM-Abhängigkeit der Atempausen [10].
Der klinische Phänotyp spielt in diesem Kontext ebenfalls eine Rolle. Insbesondere Patienten mit exzessiver Tagesschläfrigkeit haben ein erhöhtes CV-Risiko [11]. Alter und Geschlecht sind für die Entstehung der kardiovaskulären Folgeerkrankungen der OSA weniger bedeutsam. So wurde festgestellt, dass auch ältere Menschen und Frauen hiervon betroffen sind und nicht nur „klassische“ Schlaflabor-Patienten mit OSA, das heißt Männer im mittleren Lebensalter [12, 13].
Neben der arteriellen Hypertonie sind weitere mit der OSA assoziierte CV-Erkrankungen Herzrhythmusstörungen (zum Beispiel Vorhofflimmern), Herzinsuffizienz, Myokardinfarkt, Schlaganfall, Aneurysmen der Aorta, die erektile Dysfunktion und die Lungenembolie [14–20].
Metabolisches Risiko
Patienten mit OSA leiden überdurchschnittlich häufig an einem metabolischen Syndrom, das heißt dem Zusammentreffen von Adipositas, Hypertonie, Diabetes mellitus und Hyperlipidämie. Zwischen der OSA und den einzelnen Komponenten des metabolischen Syndroms bestehen wechselseitige Beziehungen [21]. So ist die Adipositas der Hauptrisikofaktor der OSA, andererseits ist die OSA die häufigste Ursache der sekundären arteriellen Hypertonie. Weiterhin nimmt man an, dass die OSA über eine Erhöhung der Insulinresistenz eine diabetische Stoffwechsellage begünstigen bzw. aggravieren kann. Eine negative Beeinflussung des Lipidstoffwechsels durch die OSA wird ebenfalls schon längere Zeit diskutiert.
Krebsrisiko
Epidemiologische Studien haben gezeigt, dass Inzidenz und Mortalität von Krebserkrankungen mit zunehmendem Schweregrad der OSA ansteigen [22, 23]. Eine Analyse von mehr als 5 Mio. US-Krankenversicherten ergab, dass insbesondere die hazard ratios für das Nierenzell- und Pankreas-Karzinom als auch für das maligne Melanom erhöht sind [24]. Für das maligne Melanom konnte sogar gezeigt werden, dass dessen Aggressivität mit dem Schweregrad der OSA korreliert [25].
Es existieren bereits Hypothesen, über welche zellulären Stoffwechselwege die OSA-assoziierte Hypoxie kanzerogen wirken könnte, es ist aber angesichts der aktuellen Datenlage noch nicht gerechtfertigt, die OSA als gesicherten kausalen Faktor für Krebserkrankungen anzusehen.
CPAP-Therapie
Der Goldstandard der Therapie der OSA ist seit nunmehr fast 40 Jahren die „positive airway pressure“ (PAP)-Therapie, das heißt eine pneumatische Schienung der oberen Atemwege durch eine nächtliche Überdruckbeatmung, in der Regel als „continuous positive airway pressure“ (CPAP)-Therapie [26, Abb. 2].
Die PAP-Therapie ist in erster Linie bei symptomatischer und/oder schwerer OSA (AHI > 30/h) indiziert. Sie erfolgt über eine Nasen- oder Vollgesichtsmaske und wird standardmäßig im Schlaflabor unter Überwachungsbedingungen individuell eintitriert. Durch die CPAP-Therapie werden das Schnarchen, die nächtlichen Atempausen und die Hypoxie im Schlaf weitgehend eliminiert. Durch eine Besserung der Schlafarchitektur wird zudem ein Rückgang der Tagessymptomatik erreicht.
Auch das Herz-Kreislauf-System wird durch die CPAP-Therapie günstig beeinflusst, zum Beispiel wird die Endothelfunktion verbessert und der 24 Stunden-Blutdruck gesenkt [27, 28]. Es gibt bisher nur eine randomisiert-kontrollierte Studie, die untersuchte, ob es unter CPAP zu einer Reduktion harter kardiovaskulärer Endpunkte wie Tod an Herzinfarkt oder Schlaganfall kommt. Diese sogenannte SAVE-Studie kam zu einem negativen Ergebnis, jedoch wurde die CPAP-Therapie von den untersuchten Patienten im Durchschnitt nur etwas mehr als drei Stunden pro Nacht genutzt, auch wurden keine Patienten mit exzessiver Tagesschläfrigkeit eingeschlossen [29]. Insofern bleibt die genannte Frage noch offen.
Die Nebenwirkungen der CPAP-Therapie wie Druckstellen, Leckagen und trockene Schleimhäute können den Therapieerfolg gefährden, durch Maskenoptimierung und Einsatz eines Befeuchters können sie aber zumindest abgemildert werden. Die Therapieadhärenz beträgt im Langzeitverlauf letztendlich 60–70 %, das heißt aber auch, dass ca. ein Drittel der Patienten eine alternative Therapie benötigt.
Therapie der OSA „jenseits“ von CPAP
Generell reduzieren die alternativen Therapien der OSA die nächtlichen Atmungsstörungen weniger effektiv als die CPAP-Therapie. Dieser Nachteil kann aber unter Umständen durch eine im Vergleich zur CPAP-Therapie bessere Compliance aufgewogen werden. Die besten Erfolge werden damit bei Patienten mit milder bis moderater OSA und Normalgewicht oder nur geringem Übergewicht erreicht.
Ein wichtiger Baustein in der Therapie sind Unterkieferprotrusionsschienen (UPS) [30]. Nach aktueller Leitlinie werden diese bei geeigneten Patienten mit leichter und moderater OSA als gleichwertig zur CPAP-Therapie angesehen, während sie bei schwerer OSA in den meisten Fällen nur bei CPAP-Intoleranz eingesetzt werden. Die UPS werden in der Regel individuell angepasst, Voraussetzungen sind u. a. das Vorhandensein eines ausreichenden Zahnstatus, eine ausreichende Möglichkeit zur Unterkieferprotrusion und das Fehlen von Erkrankungen im Bereich des Kiefergelenkes. Durch Vorverlagerung des Unterkiefers wird der Oropharynx erweitert, was einen Rückgang von Apnoen und Schnarchen bewirkt. Unerwünschte Nebenwirkungen können Beschwerden im Bereich des Kiefergelenks sein.
Zu achten ist natürlich auch auf Gewichtsreduktion sowie Alkohol- und Sedativa-Karenz. Bei lageabhängiger OSA können verschiedene passive Hilfsmittel getragen werden, die als „tennis-ball-technique“ bezeichnet werden und meist aus tragbaren Westen bestehen, bei denen auf dem Rücken ein Halbzylinder oder ähnliches eingebracht ist, der ein Liegen auf dem Rücken verhindert.
Darüber hinaus existieren auch aktive Hilfsmittel zur Rückenlageverhinderung, die über die Auslösung eines Vibrationsalarms eine Verhinderung der Rückenlage bewirken sollen. Einzelne Systeme sind inzwischen ausreichend validiert und werden entsprechend auch nach Leitlinie empfohlen. Ist ein „fluid shift“ von wesentlicher Bedeutung bei der Entstehung der OSA, können entwässernde Maßnahmen evtl. eine Besserung bewirken. So weiß man zum Beispiel, dass bei niereninsuffizienten Patienten mit einer OSA eine intensivere und/oder zeitversetzte (= nächtliche) Dialyse den AHI senken kann [31].
Als weitere therapeutische Alternative stehen eine Reihe operativer Verfahren zur Verfügung, die vor dem Hintergrund der Schwere der SBAS, der individuellen Anatomie und möglicher bestehender Begleiterkrankungen oder Kontraindikationen eingesetzt werden können. In der aktuellen Leitlinie wird hier insbesondere die Tonsillektomie mit Uvulopalatopharyngoplastik (TE-UPPP), das maxillomandibuläre Advancement und die Stimulation des N. hypoglossus empfohlen.
Operative Verfahren kommen insbesondere bei einer Intoleranz gegenüber der CPAP-Therapie in Betracht, bei der Stimulationstherapie des N. hypoglossus ist sie Voraussetzung hierfür. Für die drei genannten Verfahren liegen zunehmend randomisierte klinische Studien vor, zahlreiche weitere chirurgische Verfahren werden je nach klinischem Befund zum Einsatz gebracht, sind jedoch häufig nicht in dieser Weise evaluiert.
Für die TE-UPPP konnte auch mittels randomisierter Studien sowie einer systematischen Übersichtsarbeit eine Wirksamkeit in Bezug auf die Reduktion der respiratorischen Ereignisse und der Tagesschläfrigkeit nachgewiesen werden. Das Verfahren ist besonders wirksam bei Patienten mit einer Tonsillenhyperplasie bzw. oropharyngealen Obstruktion [32].
Bei geeigneten Patienten ist darüber hinaus die Vorverlagerung von Ober- und Unterkiefer (maxillomandibuläres Advancement) in hohem Maße effektiv. Hiermit lässt sich eine relevante Erweiterung des „posterior airway space“ erzielen.
Diese Behandlung ist bei Patienten mit skelettalen Dysmorphien, einer Retrognathie oder einer Dysgnathie besonders geeignet, jedoch nicht auf dieses Kollektiv beschränkt. Neben der nicht unerheblichen Invasivität müssen die daraus resultierenden kosmetischen Veränderungen bei der Indikationsstellung Berücksichtigung finden.
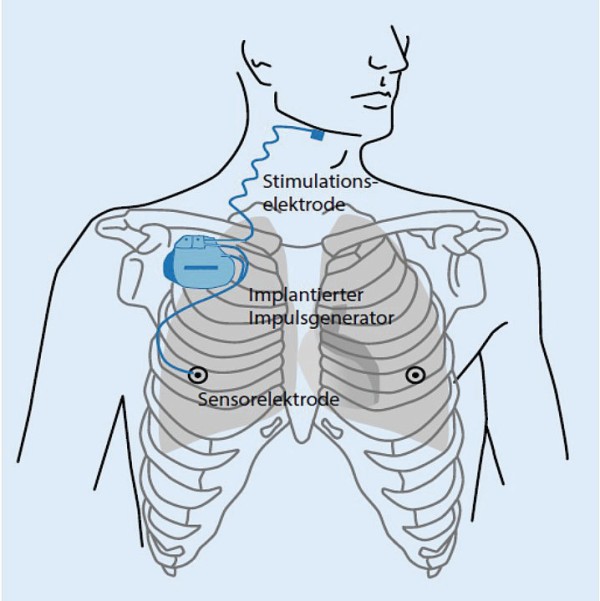
Die Hypoglossus-Stimulation (englisch: hypoglossal nerve stimulation, HGNS) bietet einen weiteren Ansatz zur Therapie der OSA [33, Abb. 3].
Man versteht hierunter die Stimulation des N. hypoglossus (und damit des M. genioglossus) über eine Schrittmacherelektrode, die in der Regel am distalen Nervenende platziert wird. Das bisher am besten evaluierte System führt die Stimulation unilateral und atmungsgetriggert durch. Zur Erkennung der Atmung wird eine zweite Elektrode in einem Interkostalraum platziert. Das Schrittmacher-Aggregat wird ähnlich wie bei Herzschrittmachern unter der Clavicula implantiert. Die HGNS ist zugelassen für Patienten mit einem AHI von 15–65/h und einem body mass index (BMI) < 35 kg/m2. Sie sollte nur bei Unverträglichkeit von CPAP erwogen werden. Bei der atmungsgesteuerten Stimulation muss präoperativ durch eine medikamentös induzierte „Schlafendoskopie“ sichergestellt werden, dass der Kollaps der oberen Atemwege auf dem Niveau des Oropharynx und in antero-posteriorer Richtung stattfindet. Mittlerweile gibt es Studien, die positive Langzeiteffekte der HGNS belegen.
Eine Pharmakotherapie der OSA steht zur Zeit nicht zur Verfügung. Die früher teilweise praktizierte Einnahme von Theophyllin ist als obsolet anzusehen. Eine neue Entwicklung stellen Medikamente dar, die den Tonus des M. genioglossus erhöhen. In einer randomisierten, Placebo-kontrollierten Studie mit einer kleinen Zahl von OSA-Patienten (n=20) wurde die Kombination des selektiven Noradrenalin-Reuptake-Inhibitors Atomoxetin und des Anticholinergikums Oxybutinin untersucht. Der AHI konnte hierdurch bereits nach einer Nacht bei fast allen Patienten signifikant reduziert werden, u. a. sind aber der Langzeiteffekt auf den AHI und die Wirkung auf die Schlafarchitektur noch unklar [34].
Müdigkeit trotz CPAP
Besteht unter der CPAP-Therapie noch Tagesmüdigkeit oder -schläfrigkeit, kann dies an einer mangelnden Therapieadhärenz oder einer insuffizienten Einstellung des CPAP-Gerätes liegen. Eine unzureichende Schlafhygiene und begleitende psychiatrische, neurologische oder internistische Erkrankungen können ebenfalls hierfür verantwortlich sein. Oftmals ist in solchen Situationen eine Reevaluation der Therapie im Schlaflabor notwendig, evtl. muss eine Umstellung auf alternative PAP-Modi wie zum Beispiel Bilevel-PAP (BiPAP) oder adaptive Servoventilation (ASV) erfolgen. Persistiert immer noch eine Tagesschläfrigkeit, können gegebenenfalls analeptisch wirksame Medikamente versucht werden. Früher kam in diesem Kontext Modafinil zum Einsatz, das aber für diese Indikation nicht mehr zugelassen ist. Neuerdings wird stattdessen Solriamfetol verwendet [35, siehe auch Artikel von G. Mayer in dieser Ausgabe].
Zentrale Schlafapnoe (ZSA)
Subtypen
Die ZSA kann ohne erkennbare Ursache auftreten (sogenannte primäre bzw. idiopathische ZSA). Anatomische Läsionen des Atemzentrums in Medulla oblongata und Pons zum Beispiel durch Infarkte, Blutungen oder Tumoren können eine ZSA hervorrufen. Die periodische Höhenatmung ist eine weitere Form der ZSA, welche durch schnellen Aufstieg in große Höhen verursacht wird. Iatrogen induziert ist die ZSA bei Einnahme von atemdepressiv wirkenden Opiaten und auch diejenige, die während der CPAP-Titration bei OSA beobachtet werden kann (früherer Begriff: komplexe Schlafapnoe; englisch: treatment-emergent central sleep apnea).
Der häufigste Subtyp der ZSA ist schließlich die Cheyne-Stokes-Atmung (englisch: Cheyne-Stokes respiration, CSR) bei Patienten mit Herzinsuffizienz. Bevorzugt ist der Leichtschlaf betroffen, charakteristisch ist ein monotoner Wechsel von zentralen Apnoen/Hypopnoen und spindelförmigen, Crescendo/Decrescendo-artigen Hyperventilationsphasen.
Pathophysiologisch steht eine pulmonale Stauung infolge der Herzinsuffizienz, das heißt ein fluid shift in die Lunge, im Vordergrund, wodurch es reflektorisch zu einer Hyperventilation kommt. Dies bewirkt ein Absinken des pCO2 unter die Apnoeschwelle. Risikofaktoren der CSR sind ähnlich wie bei der OSA männliches Geschlecht und höheres Alter, weiterhin das Vorliegen einer Hypokapnie und von Vorhofflimmern [36]. Die Mortalität von Herzinsuffizienz-Patienten mit CSR ist gegenüber solchen ohne SBAS erhöht, vermutlich bedingt durch maligne Herzrhythmusstörungen, die durch die nächtlichen Atempausen mit konsekutiver Hypoxie und Sympathikusaktivierung hervorgerufen werden [37].
Therapie der CSR
Die Indikation zur Therapie der CSR ist weniger klar etabliert als bei der OSA. Hinzu kommt, dass die verfügbaren Behandlungsmöglichkeiten oft nur begrenzt effektiv sind und unter Umständen sogar negative Effekte auftreten können.
In jedem Falle sollte zunächst versucht werden, die medikamentöse Therapie der Herzinsuffizienz zu optimieren. Das potenziell wirksame Theophyllin kommt wegen seiner proarrhythmischen Effekte kaum zum Einsatz. Die Gabe von Sauerstoff kann durch eine Suppression des hypoxischen Atemantriebs einen Anstieg des pCO2 und damit eine Besserung der CSR bewirken. Effektiver sind die verschiedenen Formen der PAP-Therapie, angefangen von CPAP über BiPAP bis hin zur ASV.
Bei der ASV handelt es sich um eine „intelligente“, automatisch arbeitende Bilevel-Therapie mit einem zum Atemmuster der CSR antizyklisch modulierten Inspirationsdruck. Diese Therapie sollte jedoch nur noch bei Patienten mit einer linksventrikulären Ejektionsfraktion (LVEF) ≥ 45 % angewendet werden.
So war in der sogenannten SERVE-HF- Studie die Mortalität von Patienten mit Herzinsuffizienz und einer LVEF < 45 %, die an einer zumindest moderaten Schlafapnoe mit prädominanter CSR litten, unter ASV erhöht [38]. Insofern wird gefordert, dass vor jeder Einleitung einer ASV-Therapie eine Echokardiographie zur Bestimmung der LVEF durchgeführt wird.
Ein neues, bisher kaum verbreitetes Verfahren zur Therapie der CSR ist schließlich die transvenöse Phrenikusstimulation [39]. Die Atmung wird hierbei über eine in der V. azygos implantierte Elektrode detektiert, die Stimulation des N. phrenicus erfolgt über eine zweite Elektrode, welche in der V. pericardiophrenica zum Liegen kommt. Der Schrittmacher selbst ist wie bei der HGNS subkutan präpektoral lokalisiert.
Schlafbezogene Hypoxämie und Hypoventilation
Subtypen
Sowohl bei der schlafbezogenen Hypoxämie als auch bei der schlafbezogenen Hypoventilation liegt eine Ventilationsstörung vor, die zu einer Überlastung der Atempumpe mit konsekutiver Erschöpfung der Atemmuskulatur führt. Diese manifestiert sich primär im Schlaf, kann später aber auch schon am Tage evident sein. Ursachen sind zum Beispiel die COPD (chronic obstructive pulmonary disease), Thoraxdeformitäten und neuromuskuläre Erkrankungen wie Muskeldystrophien oder die amyotrophe Lateralsklerose.
Abgegrenzt von diesen Erkrankungen wird das sogenannte Adipositas-Hypoventilationssyndrom (englisch: obesity hypoventilation syndrome, OHS). Per definitionem liegt hierbei ein BMI > 30 kg/m2 sowie eine Tageshyperkapnie mit einem pCO2 > 45 mmHg vor. Häufig besteht zusätzlich eine OSA. Kompliziert wird der Erkrankungsverlauf zudem oft von einer hypoxisch getriggerten pulmonalen Hypertonie.
Patienten mit schlafbezogener Hypoventilation können ähnlich wie solche mit Schlafapnoe an Tagesmüdigkeit oder -schläfrigkeit leiden, wobei die Ursache hierfür die Hyperkapnie ist. Durch die CO2-Akkumulation kommt es auch gehäuft zu vasomotorischem Kopfschmerz oder Schwindel.
Therapie
Die Therapie der Grunderkrankung stellt natürlich die Basis der Therapie der schlafbezogenen Hypoxämie und Hypoventilation dar, also zum Beispiel die inhalative Medikation der COPD oder der Versuch einer Gewichtsabnahme beim OHS.
Die schlafbezogene Hypoxämie kann durch O2-Gabe behandelt werden. Es ist hierbei jedoch zu beachten, dass sich durch Suppression des hypoxischen Atemantriebs eine Hyperkapnie entwickeln kann. Hiervon betroffen sind vor allem COPD-Patienten.
Im Zentrum der Therapie der schlafbezogenen Hypoventilation steht die sogenannte nichtinvasive Heimbeatmung (englisch: non-invasive ventilation, NIV), die meistens in einem assistiert/kontrollierten BiPAP-Modus durchgeführt wird. Dies führt zu einer Entlastung der Atempumpe und im Idealfall zu einer Normalisierung der Blutgase. Die klinische Symptomatik bessert sich hierunter ebenfalls und es wird letztendlich die Überlebenszeit verlängert. Letzteres gilt auch für Patienten mit COPD, wobei hier die Anwendung einer sogen. „high intensity“ NIV-Therapie mit hohen Inspirationsdrucken und back-up Atemfrequenzen sowie ggf. rein kontrolliertem Beatmungsmodus entscheidend ist [40]. Neben einer NIV-Therapie müssen die betroffenen Patienten oftmals auch mit einer Langzeitsauerstofftherapie versorgt werden.
Zu bemerken ist, dass ein relevanter Anteil der Patienten mit schlafbezogener Hypoventilation die verordnete Therapie nicht konsequent genug durchführt. So wird das NIV-Gerät nur tagsüber bzw. nur während eines Teils der Nacht genutzt oder die O2-Gabe erfolgt wesentlich kürzer als empfohlen (mindestens 16 Stunden täglich). Dies hat zur Folge, dass sich die positiven Effekte der NIV- und O2-Therapie nicht in vollem Umfang entfalten können. Insofern kommt der engmaschigen Betreuung der betroffenen Patienten mit dem Ziel einer fortwährenden Optimierung der NIV-Therapie eine besondere Bedeutung zu.
Fazit und Ausblick
SBAS sind häufige und klinisch bedeutsame Erkrankungen. Sie können zu Tagesmüdigkeit oder sogar Tagesschläfrigkeit führen, was mit kognitiver Dysfunktion und erhöhter Unfallgefahr verbunden ist. Die Überlebensrate von Patienten mit SBAS ist reduziert, vor allem durch eine Erhöhung des CV-Risikos. Die Therapie von SBAS kann nicht nur zu einer Besserung der klinischen Symptomatik führen, sondern auch günstige Effekte auf das „survival“ der betroffenen Patienten haben, wobei dies noch nicht für alle Formen der SBAS auf gleich hohem Evidenzniveau gezeigt werden konnte.
In Zukunft wird es darauf ankommen, mehr Patienten mit SBAS in einem frühen Krankheitsstadium zu identifizieren, bevor es zu möglicherweise irreversiblen Folgeschäden am zentralnervösen und kardiovaskulären System kommt. Neben einer verstärkten Aufklärung der Allgemeinbevölkerung ist ein Weg dahin sicherlich die intensivierte Zusammenarbeit zwischen Allgemein- und Schlafmedizinern.
Ein weiteres Ziel ist es, die für Patienten mit SBAS oftmals „unbequeme“ PAP- bzw. NIV-Therapie weiter zu optimieren und alternative Behandlungsmöglichkeiten zu entwickeln. Dies beinhaltet perspektivisch auch die Anwendung einer personalisierten, auf den Patienten individuell zugeschnittenen Therapie, die sich zum Beispiel an dem im Einzelfall vorherrschenden pathophysiologischen Mechanismus der SBAS orientiert.
Offen ist noch, wie Patienten mit milder Ausprägung der SBAS, weitgehend fehlender klinischer Symptomatik sowie hohem Alter am besten behandelt werden sollten. Bei einigen dieser Patienten kann wahrscheinlich auf eine PAP-Therapie verzichtet werden und eine Verlaufsbeobachtung erfolgen, vor allem falls keine koexistenten CV-Erkrankungen vorliegen. Dies muss aber noch durch Studien auf höherem Evidenzniveau geklärt werden.
Abkürzungen im Text: | |
AHI | Apnoe-Hypopnoe-Index |
ASV | adaptive Servoventilation |
BiPAP | bilevel positive airway pressure |
BMI | body mass index |
COPD | chronic obstructive pulmonary disease |
CPAP | continuous positive airway pressure |
CSR | Cheyne Stokes respiration |
CV | kardiovaskulär |
HGNS | hypoglossal nerve stimulation |
LVEF | linksventrikuläre Ejektionsfraktion |
NIV | non-invasive ventilation |
OHS | obesity hypoventilation syndrome |
OSA | obstruktive Schlafapnoe |
PAP | positive airway pressure |
pCO2 | Kohlendioxid-Partialdruck |
PG | Polygraphie |
pO2 | Sauerstoff-Partialdruck |
PSG | Polysomnographie |
REM | rapid eye movement |
SBAS | schlafbezogene Atmungsstörungen |
TE-UPPP | Tonsillektomie mit Uvulopalato- pharyngoplastik |
UPS | Unterkieferprotrusionsschienen |
ZSA | zentrale Schlafapnoe |
Interessenkonflikte
Prof. Dr. med. Richard Schulz: keine.
Prof. Dr. med. Tim O. Hirche: keine.
Prof. Dr. med. Boris A. Stuck hat finanzielle Unterstützung für Forschungsarbeiten, Berater- und Referentenhonorare von folgenden Firmen erhalten: Sutter Medizintechnik, Fisher & Paykel Healthcare, Neuwirth Medical Products, Philips Healthcare, Itamar Medical, Inspire Medical, Atos Medical, SnooZeal Ltd., G. Pohl-Boskamp GmbH&Co.KG und R. Cegla GmbH & Co.KG. Er hat darüber hinaus finanzielle Unterstützung (Sponsoring) für Veranstaltungen der Klinik für Hals-, Nasen- und Ohrenheilkunde Marburg erhalten von: ALK Abello, Andreas Fahl Medizintechnik, Löwenstein Medical,Medtronic GmbH, Karl Storz GmbH, Carl Zeiss Medic, Cochlear Deutschland, MedEl,Advanced Bionics, Phonak, Spiggle & Theis Medizintechnik, bess medizintechnikund Shire. Er ist als Berater für die Firma Itamar Medical tätig.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu den beiden Artikeln „Schlafbezogene Atmungsstörungen“ von Prof. Dr. med. Richard Schulz et al. und „Hypersomnie und Insomnie“ von Dipl.-Psych. Markus B. Specht et al. finden Sie im Mitglieder-Portal der Landesärztekammer Hessen (https://portal.laekh.de) sowie in der Online-pdf des Hessischen Ärzteblattes (https://www.laekh.de/fileadmin/user_upload/Heftarchiv/PDFs_ganze_Hefte/2020/HAEBL_10_2020.pdf). Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Mitglieder-Portal vom 25. September 2020 bis 24. September 2021 möglich.
Jede Fortbildung ist mit zwei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie diese CME-Module nicht bereits an anderer Stelle absolviert haben. Diese Artikel haben ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte, siehe dazu auch den Kasten auf der nächsten Seite.
Prof. Dr. med. Richard Schulz, MHBA, E-Mail: Richard.Schulz@helios-gesundheit.de
Prof. Dr. med. Tim O. Hirche
beide: Lungenzentrum Wiesbaden, Helios Dr. Horst Schmidt Kliniken, Akademisches Lehrkrankenhaus der Johannes Gutenberg Universität Mainz, Medizinische Klinik V/Pneumologie, Wiesbaden
Prof. Dr. med. Boris A. Stuck, Klinik für Hals-, Nasen-und Ohrenheilkunde, Universitätsklinikum Gießen und Marburg GmbH, Standort Marburg, Philipps-Universität Marburg