Ansatzpunkte für neue Therapieansätze
VNR: 2760602020254070003
Prof. Dr. med. Ulf Müller-Ladner, Prof. Dr. med. Kirsten de Groot
Einleitung
Die meisten der chronisch-entzündlichen Erkrankungen beruhen auf Fehlfunktionen des Immunsystems. Dessen normale Funktionen der Erkennung und Eliminierung von Infektionserregen und überalterten, infizierten oder neoplastisch transformierten Zellen werden durch vielfältige innere und äußere Einflüsse so verändert, dass körpereigene Strukturen als fremd erkannt und angegriffen werden. Dies kann sowohl durch das mehr zellbasierte angeborene als auch das mehr (auto-)antikörperbasierte erworbene Immunsystem geschehen.
Ein wichtiger Faktor hierbei ist die sogenannte molekulare Mimikry [1, 2], da viele Bausteine menschlicher Zellen von Viren und Bakterien abstammen und somit strukturelle Übereinstimmungen zu aktuellen Erregern haben. Externe Einflüsse können zudem Oberflächenstrukturen in antigenreichere Varianten umwandeln, z. B. werden in der Lunge durch Rauchen enzymatisch Citrullinierungsprozesse gesteigert, die die Dichte der citrullinierten Oberflächenmoleküle als Trigger zur Bildung der Anti-Citrullin-Antikörper (ACPA) bei der rheumatoiden Arthritis konstant unterhalten [3].
In der Regel werden diese Autoimmunreaktionen zusätzlich durch zahlreiche zelluläre und humorale Entzündungsprozesse begleitet, so dass sich hieraus die chronisch-entzündliche Erkrankung ableitet, da sowohl die treibenden Faktoren des Immunsystems als auch die als fremd erkannten körpereigenen Oberflächenstrukturen dauerhaft vorhanden sind.
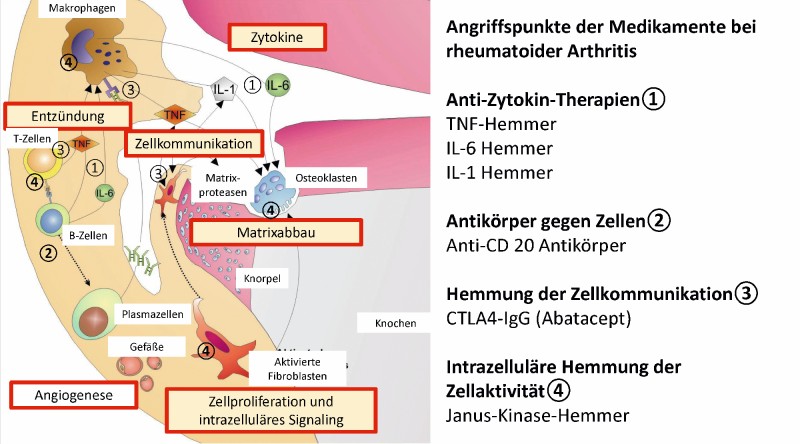
Da das Immunsystem gleichzeitig schnell und flexibel reagieren muss, ist es nicht immer präzise, so dass Autoimmunphänomene, wie z. B. die Bildung von Rheumafaktoren nach einer EBV-Infektion, ebenfalls regelhaft auftreten. Um die Gefahr einer hieraus resultierenden Immunerkrankung zu minimieren, existieren verschiedene protektive Gegenregulationsmechanismen wie regulatorische T-Zellen und hemmende Zytokine wie Interleukin-10. Greifen diese zu spät oder zu gering ausgeprägt ins Geschehen ein, kommt es zur chronisch-entzündlichen Erkrankung, die selbst bei Dominanz eines betroffenen Organs stets als systemisch zu sehen ist [4, 5, 6]. Die Angriffspunkte moderner Medikamente bei der rheumatoiden Arthritis basierend auf den wichtigsten pathophysiologischen Mechanismen zeigt Abb. 1.
Abb. 1: Schematische Darstellung (vereinfacht) aktueller Angriffspunkte moderner Medikamente bei der rheumatoiden Arthritis basierend auf den wichtigsten pathophysiologischen MechanismenFoto: Prof. Dr. med. Ulf Müller-Ladner
Fallkonstellation Bindegewebe
Eine junge, sportliche Medizinstudentin bemerkt nach einer längeren Klettertour im Hochgebirge an den sonnenexponierten Hautstellen trotz „ausreichendem“ Sonnenschutz Exantheme, verbunden mit einem über die folgenden Wochen zunehmenden Leistungsverlust, mit Belastungsdyspnoe und Beinödemen. Die klinische Durchuntersuchung ergibt hohe Entzündungszeichen, Anämie, ansteigende Retentionswerte, Hypalbuminämie sowie Pleuraergüsse. Immunologisch finden sich hochtitrige antinukleäre und Doppelstrang-DNS-Antikörper. Die Nierenpunktion ergibt eine typische Histologie für eine aktive Immunkomplex-Glomerulonephritis bei systemischem Lupus erythematodes.
Pathophysiologie
Der systemische Lupus erythematodes (SLE) ist eine chronische Autoimmunerkrankung, bei der Zellen und Gewebe durch Autoantikörper, Immunkomplexe und die hierdurch induzierten Entzündungsprozesse z.T. irreversibel geschädigt werden [7]. Der SLE zählt zu den sogenannten „Kollagenosen“. Ursprünglich wurde dieser Begriff von Klemperer für chronisch-rheumatische Krankheiten benutzt, die sämtlich fibrinoide Nekrosen im entzündeten Gewebe aufweisen. Klinisch ist der SLE eher gekennzeichnet durch vaskulitischen Multiorganbefall, wobei polymorphe Exantheme, Arthritis, Nephritis, Polyserositis, ZNS-Beteiligung und Zytopenien im Vordergrund stehen [7].
Wie bei vielen chronisch-entzündlichen Autoimmunerkrankungen liegt der Entstehung eine (sehr variable) genetische Prädisposition zugrunde, zur Manifestation kommt diese aber erst durch Einwirkung von externen Einflüssen wie Sonnenlicht oder Infektionen. Autoantikörper können im Serum Gesunder nachgewiesen werden, die entweder nie oder erst viele Jahre später Krankheitssymptome entwickeln. Funktionell aktive pathogene Autoantikörper spielen häufig eine Rolle für die Ausprägung der Organschädigungen, weshalb B-Zellen und Plasmazellen von zentraler Bedeutung auch als therapeutische Targets sind [7,8].
Pathophysiologisch führen die verschiedenen externen Stimuli zur Lyse von Zellen und Anfall vermehrt apoptotischen Materials. Nukleosomen, die solche Abbauprodukte und bakterielle Peptide beinhalten, aktivieren sogenannten Danger-Rezeptoren und nachfolgend dendritische und B-Zellen, verbunden mit einer gesteigerten Synthese von Interferonen und Autoantikörpern. Oberflächenrezeptoren wie der B-Zell-Rezeptor und Fcγ-Rezeptoren führen über eine gesteigerte Endozytose von Nukleinsäuren und Immunkomplexen via Effektormolekülen des angeborenen Immunsystems (Toll-Like-Rezeptoren) zu einer weiteren Aktivierung von Immunzellen. Nachfolgend wird die normale Immuntoleranz durchbrochen und in einem Circulus viciosus werden weitere Autoantikörper und Immunkomplexe generiert, die dann über eine lokale oder generalisierte Vaskulitis zur Gewebeschädigung und Leistungsminderung führen. T-Zellen können diese Entwicklung über weitere Oberflächenrezeptor-Interaktionen (z. B. CD40L/CD40) und Zytokine (z. B. IL-21 und den B-Zell-aktivierenden Faktor BLyS) zusätzlich steigern [7, 9].
Insbesondere BLyS, ein löslicher Ligand der TNF-Zytokinfamilie, ist einer der wichtigsten Faktoren in der B-Zell-Differenzierung und -Aktivierung. BLyS verhindert auch die B-Zell-Apoptose Autoantikörper-produzierender B-Zellen. Aufgrund der hiermit verbundenen zentralen Funktion bei der Aktivierung des SLE ist BLyS auch ein Zielmolekül neu eingeführter Therapiestrategien wie der Anti-BLyS-Antikörper Belimumab, aber auch Atacicept oder des B-Zell-Hemmers Rituximab. Belimumab konnte in klinischen Studien vor allem die Frequenz von Schüben reduzieren und zeigte einen gewissen Glukokortikoid-sparenden Effekt, wobei das klinische Ansprechen zum Teil länger dauert als bei anderen Biologika [10].
Fallkonstellation kleine Gefäße
Ein 39-jähriger Busfahrer mit bekanntem, aber mildem Asthma stellt sich beim Hausarzt vor, da seine Asthmasprays trotz regelmäßigen Gebrauchs in der diesjährigen Saison nicht mehr ausreichen und in der jüngeren Zeit immer wieder auch etwas Blut und Borken beim Schneuzen dabei sind. Zusätzlich bekommt er beim Fußballspielen mit seinen Kindern immer schneller Atemnot bei Belastung. Beim Checkup des Hausarztes fallen sehr hohe Entzündungswerte ohne pathologische Organwerte auf. Die rheumatologische Untersuchung ergibt zusätzlich hochtitrige Anti-Neutrophile Zytoplasmatische Antikörper (ANCA) mit Subspezifität Proteinase 3 (PR3). Das HRCT weist bilaterale inhomogen verteilte Infiltrate auf, und die Histologie aus der Nasenschleimhaut ist vereinbar mit einer Kleingefäßvaskulitis vom Typ Granulomatose mit Polyangiitis.
Pathophysiologie
Unter Vaskulitiden versteht man Krankheitsbilder, die durch charakteristische Entzündungsprozesse in den Gefäßwänden unterschiedlicher Blutgefäße klinisch und morphologisch geprägt werden. Die Klassifikation primär systemischer Vaskulitiden kleiner Gefäße erfolgt nach den Definitionen und der Nomenklatur der Chapel Hill Consensus (CHC) Konferenz. Gemäß dieser Übereinkunft werden die Vaskulitiden entsprechend der Größe der befallenen Gefäße in Vaskulitiden kleiner, mittelgroßer und großer Gefäße und aufgrund immunpathologischer Merkmale in granulomatöse Arteriitiden, nekrotisierende pauci-immune und Immunkomplex-Vaskulitiden eingeteilt [11].
Die Granulomatose mit Polyangiitis (GPA), die eosinophile Granulomatose mit Polyangiitis (EGPA) und die mikroskopische Polyangiitis (MPA) werden aufgrund ihrer Assoziation mit ANCA und klinischer und pathologischer Gemeinsamkeiten zusammenfassend als ANCA-assoziierte Vaskulitiden (AAV) bezeichnet [12]. Die ANCA-Zielantigene und die Pathophysiologie unterscheiden sich bei den drei Varianten, es handelt sich daher um drei verschiedene Entitäten mit Übereinstimmungen in bestimmten pathologischen Merkmalen. Gemeinsames Kennzeichen ist aber eine nekrotisierende Vaskulitis hauptsächlich kleiner Gefäße, d. h. von Arteriolen, Kapillaren und Venolen. Aufgrund weitgehend fehlender Immunkomplexablagerungen in den Gefäßwänden werden AAV deshalb auch als pauci-immun bezeichnet. Die Pathophysiologie beginnt in der Regel am Gefäßendothel mit Schwellungen, Nekrosen und Ablösung der Endothelzellen.
Beim in der nördlichen Hemisphäre häufigsten Vertreter der Kleingefäßvaskulitiden, der GPA, finden sich die ersten Läsionen im oberen und unteren Respirationstrakt. Diese weisen fibrinoide Kollagennekrosen und infiltrierende, zum Teil palisadenförmig angeordnete Histiozyten sowie neutrophile Granulozyten auf. Daneben besteht eine Barrierestörung mit veränderter Zusammensetzung des Mikrobioms und führender abnormer Staphylococcus-aureus-Besiedlung. Der intialen fibrinoiden Nekrose sowie der Histiozyten- und Neutrophileninfiltration folgt eine Rekrutierung von T- und B-Zellen. Im Vollbild der chronischen Entzündung zeigt sich dann ein pleomorphes Bild mit Makrophagen, Epitheloidzellen, Riesenzellen, eosinophilen Granulozyten, Fibroblasten und Mikroabszessen. Um diesen Vaskulitis-Granulom-Komplex bilden sich ektope lymphatische Strukturen mit B- und T-Zellen, Plasmazellen und dendritischen Zellen – ähnlich wie in sekundären lymphatischen Organen (z. B. Lymphknoten) [12].
Die Aktivität der B-Zellen aus dem Granulom weist auf eine Staphylococcus-aureus-induzierte Zellexpansion hin, sodass in initialen oder regionalen Verlaufsformen Cotrimoxazol als Basistherapeutikum eingesetzt werden kann. Die bei diesen Mechanismen freigesetzten Zytokine induzieren auch eine Translokation der primär intrazellulär in Neutrophilen- und Monozytengranula gelegenen ANCA-Zielantigenen PR3 und MPO auf die Zelloberfläche und stimulieren die Expression von Adhäsionsmolekülen auf Neutrophilen. Die durch diese Mechanismen an die Endothelzellen adhärierenden Neutrophilen werden dann durch die Bindung zirkulierender ANCA an die auf der Zellmembran exprimierte PR3 bzw. MPO aktiviert, gefolgt von einer intravasalen Degranulation der Neutrophilen mit Freisetzung toxischer Sauerstoffradikale und lysosomaler Enzyme.
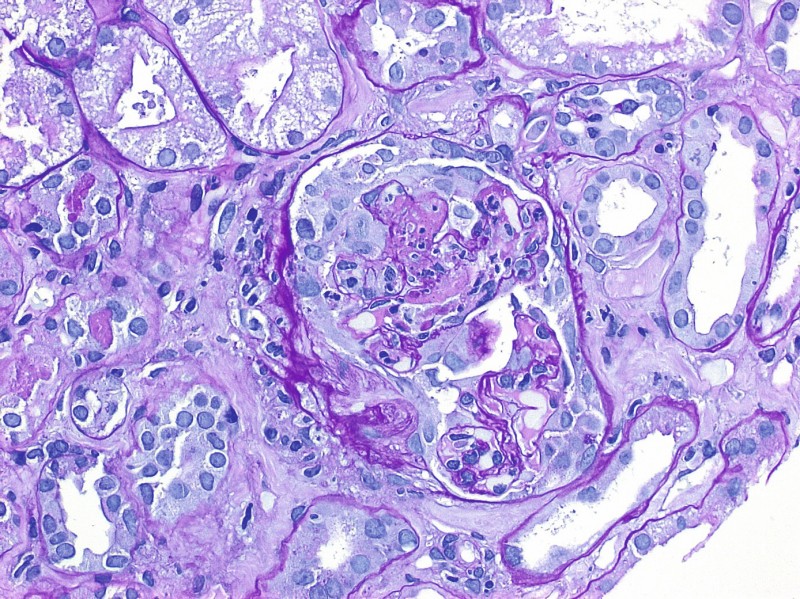
ANCA sind funktionell aktiv und induzieren eine Aktivierung und Degranulation zytokinstimulierter neutrophiler Granulozyten mit konsekutiver Endothelschädigung. Der gesamte Vorgang wird als „ANCA-Zytokin-Sequenz-Mechanismus“ bezeichnet [13] und rekrutiert dann weitere Leukozyten in die Gefäßwandläsion und das angrenzende Gewebe sowie die Bildung der typischen perivaskulären Granulome und Nekrosen. Dieser chronisch-granulomatösen Entzündung kommt bei der eigentlichen Gewebsdestruktion (z. B. Nasenknorpel, Orbitadestruktion) eine zentrale Bedeutung zu. In der Niere führt die Degranulation neutrophiler Granulozyten zusätzlich zur Thrombose von glomerulären Kapillaren, segmentalen Nekrosen und der Ruptur der Basalmembran mit konsekutiver intra- oder extrakapillärer Halbmondbildung, d. h. myelo-monozytäre Zellen inner- und/oder außerhalb des Bowmannschen Kapselraumes, halbmondförmig um das glomeruläre Schlingenkonvolut angeordnet (Abb. 2).
Fallkonstellation große Gefäße
Eine 68-jährige Seniorchefin eines Gartenbaubetriebes fühlt sich jede Woche abgeschlagener und verliert wöchentlich 1–2 kg Gewicht, andere körperliche Symptome bestehen außer einzelnen Nachtschweißattacken nicht. Das Routinelabor ergibt ein ausgeprägt hohes CRP und BSG. Eine ausführliche Tumorsuche mittels Stamm-CT, Gastro- und Koloskopie, gynäkologischer und dermatologischer Untersuchung ergibt keine Pathologika. Die Immunparameter sind ebenfalls komplett unauffällig. Nach einem Schwächeanfall bei der 100-jährigen Betriebsfeier wird ein PET-CT durchgeführt, welches eine entzündliche Aktivität der kompletten Aorta anzeigt.
Pathophysiologie
Zu den zugrundeliegenden Großgefäßvaskulitiden zählen zwei unterschiedliche Entitäten, die Riesenzellarteriitis (RZA) mit der benigneren Variante Polymyalgia rheumatica, und die Takayasu Arteriitis (TAK). Die RZA tritt in der Regel erst nach dem 50. Lebensjahr auf, die TAK meistens bis zum 40. Lebensjahr. Beide genetisch unterschiedlich im Haupthistokompatibilitätskomplex kodierten Entitäten betreffen als granulomatöse Arteriitiden hauptsächlich die Aorta und von ihr abgehende Arterienäste. Aufgrund der schwierigen histologischen Zugänglichkeit konnten viele pathophysiologische Mechanismen [14] erst post mortem oder zufällig aus Operationspräparaten gewonnen werden.
Hierbei spielt vor allem die Aktivierung von dendritischen Zellen in der Adventitia eine Rolle. Sie induziert eine Chemokin- und Zytokin-vermittelte Rekrutierung und Reifung von T-Helfer- und Th17-Zellen sowie von Zytokin-, Wachstumsfaktor- und Matrixmetalloproteinase-produzierenden Makrophagen. Diese entzündliche Infiltration mit T-Zellen und Makrophagen sowie die Aktivierung von Myofibroblasten und glatten muskulären Zellen führen zu vaskulären Umbauvorgängen mit Intimahyperplasie und entzündlicher Infiltration und Destruktion der Media. Eine fokale B-Zell- und Plasmazell-Aggregation wurde ebenfalls beschrieben. Der chronisch-entzündliche Gefäßumbau ist histologisch vor allem durch eine fortschreitende Arterienwand-Fibrose, Gefäßstenosierung und luminale Obstruktion gekennzeichnet [14].
Autoantikörper entstehen hierbei interessanterweise keine, dafür eine Prädominanz des proinflammatorischen Zytokins IL-6. Dieses Zytokin fördert zusammen mit Interferonen die Fusion von Makrophagen zu Riesenzellen, dem namensgebenden histologischen Merkmal, und ist auch für die RZA-typischen systemischen Krankheitszeichen wie Fieber, Anämie und die Gewichtsabnahme mitverantwortlich.
Fallkonstellation periphere Gelenke
Eine 37-jährige Tanzlehrerin bemerkt über einige Wochen zunehmende Schmerzen in den Füßen, die sich von den üblichen Schmerzen nach Turnieren dadurch unterscheiden, dass sie zunehmend morgens unabhängig von körperlicher Belastung auftreten. Nach sechs Wochen sind die Füße ebenfalls geschwollen und auch die Handgelenke beidseits fühlen sich morgens für eine Stunde steif an. Ibuprofen in zunehmender Dosierung und eine intensivierte Physiotherapie zeigen nur anfangs einen Effekt. Die versuchsweise Gabe von 20 mg Prednisolon für ein Wochenende mit mehreren Abschlussbällen erzeugt dahingegen eine kurzzeitige Beschwerdefreiheit. Der dann hinzugezogene Rheumatologe stellt neben positiven Rheumafaktoren und ACPA sonographisch eine ausgeprägte Synovialitis mehrerer Carpal- und Metatarsalgelenke fest und initiiert für die zugrundeliegende rheumatoide Arthritis eine Basistherapie.
Pathophysiologie
Die rheumatoide Arthritis (RA) ist eine chronische, progredient verlaufende systemische Autoimmunerkrankung, die sich vor allem durch destruierende Veränderungen in den Gelenken manifestiert. Der Beginn der Erkrankung ist klinisch meist durch Entzündungen der Gelenkinnenhaut (Synovitiden) der Hand- und Fingergelenke charakterisiert [5, 6, 15]. Eine Hypothese der Entstehung geht davon aus, dass die Initiierung durch T-Zell-Reaktionen auf ein oder mehrere unbekannte Antigene erfolgt. Diese werden von antigenpräsentierenden Zellen via HLA-Klasse-II-Komplex an T-Zellen in der Synovialmembran präsentiert, wobei die genetische Varianz der betroffenen Patienten sehr unterschiedlich ist und sich bisher kein „RA-Gen“ identifizieren ließ.
Die nachfolgenden Entzündungsreaktionen im Synovium führen dann zum Einstrom von weiteren Entzündungszellen aus der Peripherie sowie zur Aktivierung lokaler Zellen. Freigesetzte Wachstumsfaktoren, Chemokine und insbesondere Zytokine, wie TNF-α, IL-1, IL-6 und IL-17, nehmen hierbei eine Schlüsselrolle ein. Eine weitere Hypothese geht davon aus, dass neben den T- und B-Zellen ortsständige Zellen wie neutrophile Granulozyten, Makrophagen und transformierte Fibroblasten aktiviert werden und hauptsächlich zur Entzündung und Gewebeschädigung beitragen (Abb. 3).
Im Gegensatz zu den Kollagenosen ist vor allem die entzündliche Destruktion von Knorpel und Knochensubstanz charakteristisch, die vor allem durch gewebeständige Zellen wie den synovialen Fibroblasten und Osteoklasten verursacht wird. Letztendlich tragen die lokalen entzündlichen und destruktiven Prozesse sowie die systemischen Entzündungsfaktoren zur langfristigen Schädigung der Gelenke sowie des Kapsel-, Band-, und Sehnenapparates bei. Alle zellulären und immunologischen Prozesse bei der RA sind stets eng miteinander verflochten und haben auch systemische Auswirkungen für den Organismus wie Fieberschübe und Blutbildveränderungen, gelegentlich auch Haut- und Lungenveränderungen [5, 6].
Therapeutisch wird daher vor allem die Hemmung der multifunktionalen Entzündungszytokine TNF-α oder IL-6 bzw. der B-Zellen und die Kommunikation zwischen den Entzündungszellen genutzt. In jüngerer Zeit wurde auch die Hemmung intrazellulärer Kinasen mittels spezifischer Inhibitoren, sogenannter small molecules der Januskinase-Hemmer-Klasse, die die entzündlich-destruktiven Prozesse reduzieren oder sogar komplett zum Stillstand bringen können, in das therapeutische Portfolio eingeführt [16].
Fallkonstellation Wirbelsäule
Ein 28-jähriger Innenarchitekt, der neben seinem Beruf in der Landesliga Judo betreibt, berichtet dem Hausarzt über langsam zunehmende Rückenschmerzen. Die Einnahme von 120 mg Etoricoxib vor Wettkämpfen würde war gut helfen, inzwischen würde er aber auch im Urlaub mit nicht wirbelsäulenbelastenden Sportarten wie Schwimmen und Yoga schon morgens um 4 Uhr mit tiefsitzenden Rückenschmerzen aufwachen. Das vom Hausarzt durchgeführte Labor zeigt keinerlei Auffälligkeiten, auch die Rheumafaktoren und ANA sind negativ, eine Röntgenaufnahme der LWS wird ebenfalls nicht als pathologisch befundet und ein nachfolgendes MRT der LWS nur einen kleinen Bandscheibenvorfall ohne Tangierung der Nerven. Nach weiteren vier Wochen tritt ohne wesentliche Belastung eine bilaterale Schwellung der Achillessehnen auf. Nach Bestimmung des HLA-B27 (positiv) und Durchführung eines MRT der Iliosakralgelenke kann die Diagnose eines HLA-B27-positiven entzündlichen Rückenschmerzes mit peripherer Beteiligung als Frühstadium einer chronisch-entzündlichen Wirbelsäulenerkrankung gestellt werden.
Pathophysiologie
Spondyloarthritiden (SpA) werden je nach der dominanten klinischen Präsentation in eine axiale und periphere SpA eingeteilt, eine Überlappung ist allerdings häufig. Bei der axialen Form wird in jüngerer Zeit je nach Ausmaß der Entzündung an den Sakroiliakalgelenken und der Wirbelsäule zwischen nicht-radiologischer (also nur im MRT darstellbarer) und radiologischer Form unterschieden. Letztere entspricht im Vollbild der ankylosierenden Spondylitis (AS) bzw. dem bekannteren Morbus Bechterew. Die dominanten klinischen Symptome bei der AS sind Schmerzen und Steifigkeit in der Wirbelsäule, aufgrund des zirkadianen Rhythmus der körpereigenen Steroidproduktion vor allem in den frühen Morgenstunden; langfristig droht durch das Übergreifen der Entzündung die – heutzutage verhinderbare – vollständige Versteifung der kompletten Wirbelsäule. Als dennoch systemisch-entzündliche Erkrankung ist eine periphere Beteiligung mit Arthritiden, Enthesitiden, Uveitiden, Perikarditiden etc. stets möglich, dazu auch häufige Überlappungen zur Psoriasisarthritis und chronisch-entzündlichen Darmerkrankungen.
HLA-B27 als antigenbindender und stimulierender Rezeptor des angeborenen Immunsystems mit dem umgebenden Mikrobiom spielt in der Pathogenese eine entscheidende Rolle, wobei bisher hieraus noch keine therapeutische Strategie abgeleitet werden konnte [17, 18]. Eine Idee hierzu ist die Assoziation des HLA-B27 mit der Endoplasmatisches-Retikulum-Aminopeptidase (ERAP1), welche die Spaltung von Proteinen in Peptide im Zytoplasma steuert, da durch ERAP1 prozessierte arthritogene Peptide über HLA-B27 gegenüber T-Zellen präsentiert werden können. Eine weitere Hypothese ist, dass geschädigte Darmmukosa mit konsekutiver Durchlässigkeit für das Mikrobiom eine ähnliche ursächliche aktivierende Rolle im Sinne einer aberranten Antigenexposition der HLA-B27-positiven Zellen spielen könnte.
Interessant ist, dass durch diese Prozesse sekundär bestimmte proinflammatorische Zytokine, die bei primär peripheren entzündlichen Gelenkerkrankungen wie der rheumatoiden Arthritis nur eine geringe Rolle spielen, hochreguliert werden. Hierzu gehören die Zytokine Interleukin-12, -17 und -23, welche inzwischen alle durch therapeutische Antikörper gehemmt werden können und die bewährte Hemmung durch TNF-Hemmer ergänzen. Für letztere war vor allem der Nachweis von TNF-α-exprimierenden Zellen in Biopsien aus dem regelhaft führenden Sakroiliakalgelenk eine entscheidende Erkenntnis für die Zulassung, wohingegen die IL-6- und B-Zell-Blockade nahezu keinen Effekt auf die entzündliche Aktivität an der Wirbelsäule hat.
IL-17 selbst wird vorwiegend von T-Helferzellen produziert. Diese Th17 genannten Zellen differenzieren sich unter Einfluss von Zytokinen wie IL-1, IL-6 und TGF-ß und werden dann durch IL-23 stabilisiert [19, 20, 21]. Aus diesem Wissen heraus wurden mehrere monoklonale therapeutische Antikörper entwickelt. Hierzu gehört Ustekinumab, welcher gegen das p40-Protein von IL-23 und damit gleichzeitig auch gegen das Zytokin IL-12 gerichtet ist.
In der Zukunft noch zu erklären ist die Diskrepanz der Wirkung der IL-17 und IL-12/23-Inhibitoren in der Therapie der SpA. Wie bei TNF und IL-6 könnte die unterschiedliche Verteilung der entsprechend produzierenden Zellen eine Rolle spielen. IL-23 wird z. B. vorwiegend von dendritischen Zellen und Monozyten produziert, die bis jetzt eher außerhalb der Wirbelsäule nachgewiesen wurden und insbesondere bei der Psoriasis eine Rolle spielen, während im subchondralen Knochenmark, dem primären Ort der Entzündung bei axSpA, die IL-17-Synthese durch direkten Kontakt von lokalen Mesenchymalzellen mit T-Zellen ohne Vermittlung von IL-23 dominiert. Ähnlich zu sehen ist, dass die bei entzündlichen Wirbelsäulenerkrankungen Enthesitiden gut auf eine Therapie mit TNF-Blockern und IL-17-Inhibitoren ansprechen [21].
Abkürzungsverzeichnis | |
ACPA | anti-citrullinierte Protein-Antikörper, hoch sensitive Seromarker für die rheumatoide Arthritis. |
ANCA | anti-Neutrophilen-Zytoplasma-Antikörper: Autoantikörper, eine wertvolle diagnostische Hilfe. |
ANA | antinuekleäre Antikörper |
Atacicept | Rekombinant hergestelltes Fusionsprotein. Es bindet die entzündungsauslösenden Zytokine BlyS & APRIL. |
axSPA | axiale Spondarthritis |
Biologika | biotechnologisch hergestellte Eiweiße, meist Antikörper gegen Zytokine oder bestimmte Immunzellen. |
BlyS | soluble human Blymphocyte Stimulator protein |
CD 40/ CD40L | Membranprotein, primär von T-Helfer-Zellen Typ 2 exprimiert. Ligand für das CD40-Protein von Antigen-präsentierenden Zellen. Dies führt zur Aktivierung von B-Zellen. |
ds DNS | Doppelstrang DNS-Antikörper |
EBV | Ebstein Barr-Virus |
EGPA* | eosinophile Granulomatose mit Polyangiitis |
GPA* | Granulomatose mit Polyangiitis |
Fcg- Rezeptor | membranständige Rezeptoren auf Immunzellen für das Fc-terminale Ende eines Immunglobulin G- Moleküls |
IL | Interleukine: Botenstoffe |
SLE | systemischer Lupus erythematodes |
Rituximab | therapeutischer Antikörper |
TNFa | Tumor Necrose Faktor alpha, pro-inflammatorisches Zytokin. Es stellt das Target der bei der rheumatoiden Arthritis eingesetzten therapeutischen TNFa-Antikörper dar. |
* nekrotisierende, ANCA-assoziierte Kleingefäßvaskulitiden | |
Zusammenfassung
Auch wenn sich die zahlreichen immunologischen und proentzündlichen Stoffwechselwege, Signalmoleküle und Effektorzellen bei den einzelnen Krankheitsentitäten überlappen bzw. synergistisch auf die Pathophysiologie wirken, so ergeben sich doch für jede der oben genannten Erkrankungen Spezifika, die sich in der entsprechend maßgeschneiderten Medikation (siehe Tab. 1) widerspiegeln [22].
Tab. 1: Entzündlich rheumatische Erkrankungen mit bekannten pathophysiologischen Mechanismen, die therapeutische Targets darstellen (Auswahl) | ||||
Krankheitsgruppe | Entität | Subentität | Therapeutisches Target | Therapeutikum |
Vaskulitiden | ANCA-assoziierte Kleingefäßvaskulitiden | GPA GPA, MPA, EGPA | Staph. aureus endonasal B-Zellen | Cotrimoxazol Rituximab |
Großgefäßvaskulitiden | Riesenzellarteriitis | Interleukin 6 | Tocilizumab | |
Kollagenosen | systemischer Lupus erythematodes | B-Zellen BLyS | Ritxuimab Belimumab | |
systemische Sklerose | Endothelin | Bosentan | ||
Entzündliche Gelenkerkrankungen | Rheumatoide Arthritis | TNF-α | TNF-α-Antikörper, löslicher TNF-α-Rezeptor | |
Interleukin 6 | Tocilizumab, Sarilumab | |||
Kostimulatorische Moleküle | Abatacept | |||
Januskinasen | JAK-Hemmer | |||
B-Zellen | Rituximab | |||
Gicht | Interleukin 1 | Canakinumab, Anakinra | ||
Spondyloarthritiden (SpA) | Spondylitis ankylosans (M Bechterew), Psoriasisarthritis | TNF-α | TNF-α-Antikörper, löslicher TNF-α-Rezeptor, Antikörper | |
Interleukin 17 | Secukinumab Ixekizumab | |||
Interleukin 12/23 | Ustekinumab | |||
Psoriasisarthritis | PDE-4-Hemmer | Apremilast | ||
IgG4-assoziierte Erkrankungen | B-Zellen | Rituximab | ||
Prof. Dr. med. Ulf Müller-Ladner, Justus-Liebig-Universität Gießen, Professur für Innere Medizin mit Schwerpunkt Rheumatologie, Ärztlicher Direktor der Abteilung für Rheumatologie und Klinische Immunologie Campus Kerckhoff, Bad Nauheim, E-Mail: rheumatologie@kerckhoff-klinik.de
Prof. Dr. med. Kirsten de Groot, Fachärztin für Innere Medizin, Nephrologie, Hypertensiologie und Rheumatologie, Chefärztin der Medizinischen Klinik III am Klinikum Offenbach, Ärztliche Leitung KfH-Nierenzentrum Offenbach
Die Literaturhinweise finden Sie am Ende dieser Seite unter „Artikel herunterladen“ in der PDF-Version dieses Artikels.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Pathophysiologie von chronisch-entzündlichen Erkrankungen – Ansatzpunkte für neue Therapieansätze“ von Prof. Dr. med. Ulf Müller-Ladner und Prof. Dr. med. Kirsten de Groot finden Sie im Mitglieder-Portal der Landesärztekammer Hessen sowie in der PDF-Ausgabe des Hessischen Ärzteblattes. Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Mitglieder-Portal vom 25. Oktober 2020 bis 24. Oktober 2021 möglich. Die Fortbildung ist mit zwei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben.
Diese Artikel haben ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte.