VNR: 2760602020162220005
Das Ösophaguskarzinom liegt mit 456.000 Neuerkrankungen im Jahr auf Platz acht aller Krebserkrankungen weltweit. Das weltweite Verbreitungsmuster ist jedoch sehr heterogen. So liegt die Inzidenz in industrialisierten Ländern wie z. B. in Europa bei 5,8/100.000 (Männer) und 1,2/100.000 (Frauen), während die Inzidenz in weniger industrialisierten Ländern bei 10,1/100.000 für Männer und 4,1/100.000 für Frauen liegt [9]. Auf die Plattenepithelkarzinome (PLK)*, meist im mittleren Ösophagus lokalisiert, entfallen 50–60 % , wobei der Anteil an Adenokarzinomen (AC)*, welche fast ausschließlich im distalen Ösophagus lokalisiert sind, stetig wächst. Beide Entitäten entwickeln sich histologisch über eine niedriggradige intraepitheliale Neoplasie (LGIN) zu einer hochgradigen intraepithelialen Neoplasie (HGIN) und schließlich zu einem Karzinom. Dabei bildet sich das Adenokarzinom* aus einer präkanzerösen Vorstufe, dem sogenannten Barrettepithel. Als Risikofaktoren für PLK wurden vor allem Alkohol und Nikotinabusus identifiziert. Für AC sind die wichtigsten Risikofaktoren der gastroösophageale Reflux, männliches Geschlecht, Nikotin, Adipositas und genetische Faktoren [26].
Primärdiagnostik und Staging
Endoskopie:
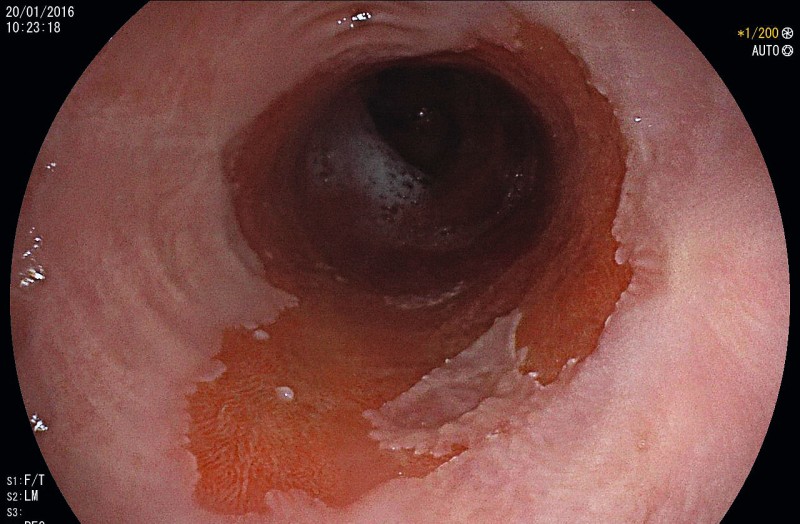
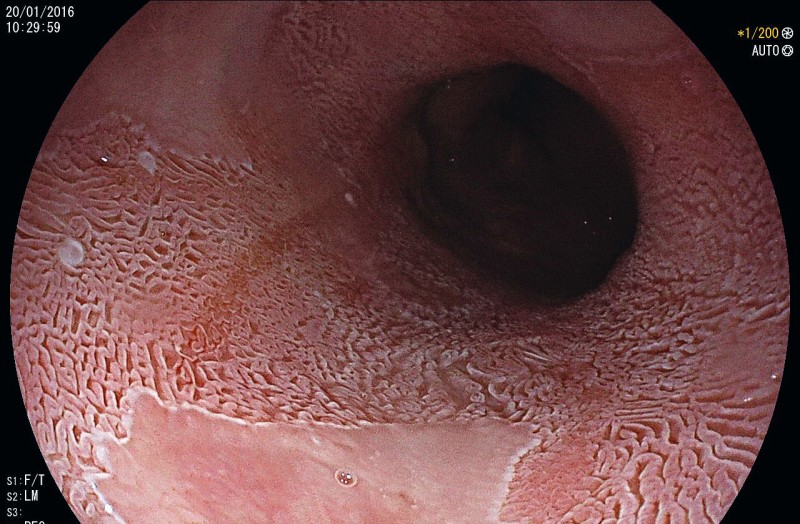
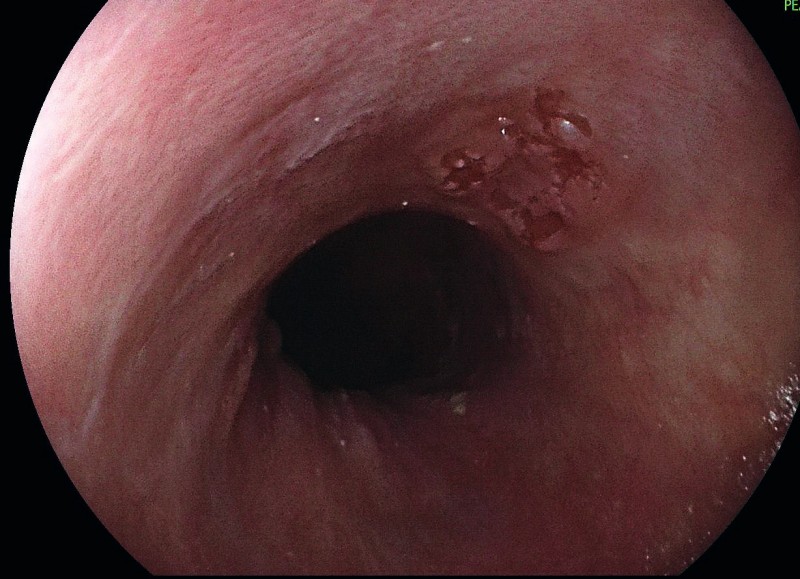
Die frühzeitige Diagnose von Ösophaguskarzinomen ist von prognostisch entscheidender Bedeutung, da die sogenannten Frühkarzinome zumeist endoskopisch-kurativ behandelt werden können. Die Fünf-Jahres-Überlebensrate von PLK oder AC im UICC-Stadium 0 liegt bei > 95 % und im Stadium I immer noch bei 50–80 %. Bei weiter fortgeschrittenen Karzinomen sinkt die Fünf-Jahres-Überlebensrate drastisch ab (Tab. 1). Deshalb sollten alle Patienten mit Warnsymptomen wie z. B. Sodbrennen, Dysphagie, Gewichtsverlust, Inappetenz oder gastrointestinalen Blutungen einer zeitnahen Endoskopie zugeführt werden [25]. Durch die Entwicklung hochauflösender Endoskope (high-definition-Auflösung, Vergrößerungsendoskopie und Chromoendoskopie) konnte die Detektionsrate früher Neoplasien im Ösophagus deutlich gesteigert werden. Die Erfahrung und die Untersuchungszeit bleiben jedoch weiterhin der wichtigste Faktor, um maligne Läsionen zu erkennen [11]. Zusätzlich sollten Biopsien aus allen suspekten Läsionen entnommen und getrennt asserviert werden; beim Barrettösophagus (Bild 1) zudem 4-Quadrantenbiopsien alle 1–2 cm (Seattle Protokoll). Eine Mindestanzahl an Biopsien aus der Läsion ist jedoch nicht definiert. In der histopathologischen Aufarbeitung müssen die Art der neoplastischen Veränderung (low-grade Intraepitheliale Neoplasie, high-grade Intraepitheliale Neoplasie/Karzinom), der histologische Typ (PLK oder AC) und das Grading (G1–3) erfasst sein [24].
Tab. 1: Stadiengruppierung der TNM-Klassifikation der Ösophaguskarzinome, eingeschlossen Karzinome des ösophagogastralen Übergangs [41] | |||
Stadium | T-Kategorie | N-Kategorie | M-Kategorie |
Stadium o | Tis | N0 | M0 |
Stadium IA | T1 | N0 | M0 |
Stadium IB | T2 | N0 | M0 |
Stadium IIA | T3 | N0 | M0 |
Stadium IIB | T1, T2 | N1 | M0 |
Stadium IIIA | T4a | N0 | M0 |
T3 | N1 | M0 | |
T1, T2 | N2 | M0 | |
Stadium IIIB | T3 | N2 | M0 |
Stadium IIIC | T4a | N1, N2 | M0 |
T4b | Jedes N | M0 | |
Jedes T | N3 | M0 | |
Stadium IV | Jedes T | Jedes N | M1 |
Chromoendoskopie:
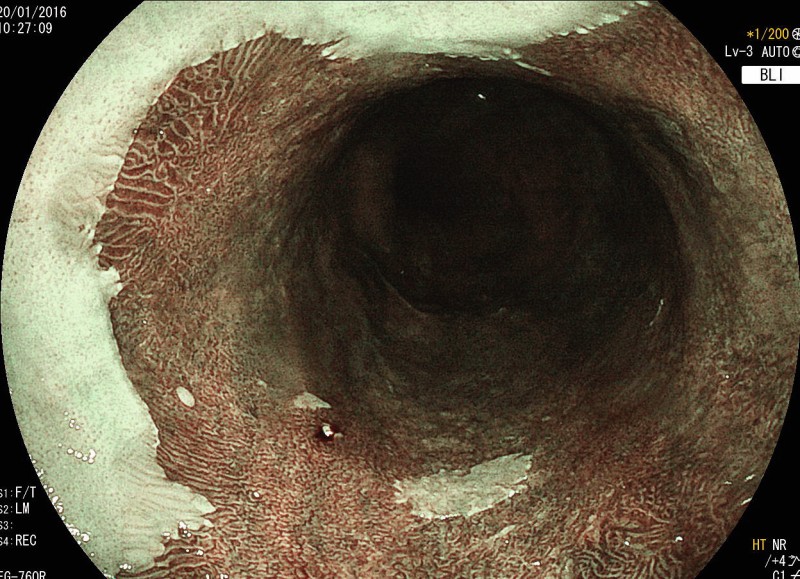
Die Chromoendoskopie eignet sich vor allem zur Detektion früher Neoplasien. Die aktuellen Videoendoskope besitzen alle Filterverfahren für die sogenannte virtuelle Chromoendoskopie (Bild 3), die auf Knopfdruck zugeschaltet werden können. Die Chromoendoskopie beruht auf der Änderung des Farbspektrums in Richtung grün und blau, was die Tiefenpenetration des Lichtes vermindert.
Durch die Anwendung von Chromoendoskopie kann die diagnostische Ausbeute im Vergleich zur Weißlichtendoskopie um bis zu 34 % erhöht werden [5, 35].
Endomikroskopie:
Neue endoskopische Verfahren wie die Endomikroskopie oder die Endozytoskopie, welche über eine sehr hohe Auflösung verfügen, vergleichbar mit der konvenionellen Histologie, haben ihren Wert unter wissenschaftlichen Aspekten. Aufgrund der fehlenden Eignung als Screeningverfahren, der Kosten und limitierten Datenlage, haben sich diese Verfahren in der täglichen Routine nicht etablieren können.
Endosonographie:
Da die Prognose des Ösophaguskarzinoms mit der Infiltrationstiefe (T-Stadium) und dem Grad der lymphatischen Ausbreitung (N-Stadium) korreliert, ist das prätherapeutische Staging extrem wichtig. Die Endosonographie (EUS) liefert aufgrund der hohen Ortsauflösung die beste Treffsicherheit. Für das T-Stadium liegt die Sensitivität bei 91–92 % und die Spezifität bei 94–99 % . Allerdings muss den Untersuchern bewusst sein, dass die T-Kategorie häufiger über- als unterschätzt wird. Insbesondere bei T2-Karzinomen liegt das Overstaging aufgrund peritumoraler Prozesse bei bis zu 12,5 % . Für das lokale N-Staging liegt die Sensitivität und Spezifität der EUS bei 85 % . Diese kann jedoch mittels EUS-gesteuerter Feinnadelpunktion auf bis zu 97 % bzw. 96 % erhöht werden [34].
Neue Techniken wie Kontrastmittel-EUS oder Elastographie ergänzen die diagnostischen Möglichkeiten, um potenziell maligne Lymphknoten besser zu identifizieren. Bei bereits stenosierenden Prozessen kann auf eine EUS verzichtet werden, da nicht passierbare Tumore fast immer fortgeschritten (≥ T3) sind. Beim Staging bezüglich der Frühkarzinome liegt der Wert der EUS in der Beurteilung der Lymphknoten. Hinsichtlich des T-Stadiums ist das geschulte Auge der Endoskopiker entscheidend [22]. Beim Adenokarzinom des gastroösophagealen Übergangs ist die Beurteilung beim Vorliegen einer axialen Hiatushernie deutlich erschwert.
Abdomensonographie:
Eine Abdomensonographie ist risikofrei, nicht invasiv und breit verfügbar. Daher sollte sie immer im Rahmen des Stagings zur Beurteilung von Fern-, insbesondere Lebermetastasen, eingesetzt werden. Durch den zusätzlichen Einsatz von Kontrastmittel kann sowohl die Sensitivität als auch die Spezifität deutlich gesteigert werden [7], so dass die Abgrenzung von Metastasen gegenüber primären Lebertumoren mit einer im Vergleich zur Computertomographie (CT) oder Magnetresonanztomographie (MRT) identischen Genauigkeit von mehr als 90 % möglich ist. Zusätzlich sollten bei hochsitzenden Ösophaguskarzinomen mittels Halssonographie (ggf. CT Hals) die cervikalen Lymphknoten beurteilt werden.
Radiologische Bildgebung:
Eine Schnittbildgebung des Thorax ist zum Staging und somit zur weiteren Therapieplanung insbesondere bei lokal fortgeschrittenen Karzinomen obligat [3]. Die diagnostische Qualität kann durch die orale Gabe von negativem Kontrastmittel (idealerweise Wasser) in Kombination mit intravenösem Kontrastmittel noch erhöht werden. Da pelvine Metastasen eine Rarität darstellen, kann auf eine Bildgebung in diesem Bereich verzichtet werden. Die Minimalanforderungen für die CT-Scanner liegen bei mindestens 16 Zeilen. Das MRT kann ebenfalls eingesetzt werden. Es liefert hinsichtlich des TNM-Stadiums vergleichbare Ergebnisse, allerdings ist es für pulmonale Läsionen weniger gut geeignet [16]. Eine Positronenemissionstomographie kann in Ausnahmefällen im Rahmen des Stagings erwogen werden, kommt jedoch nicht routinemäßig zum Einsatz. Auf eine Röntgen-Thorax oder Breischluckuntersuchung sollte aufgrund der deutlichen Überlegenheit der anderen diagnostischen Möglichkeiten verzichtet werden.
Additive Verfahren:
Bei fortgeschrittenen Tumoren kommen unter bestimmten Voraussetzungen auch eine Bronchoskopie oder eine diagnostische Laparoskopie zum Einsatz. Eine Bronchoskopie ist bei Tumoren des proximalen und v. a. mittleren Ösophagus empfehlenswert, um eine Infiltration in das Tracheobronchialsystem auszuschließen oder nachzuweisen. Bei der diagnostischen Laparoskopie kann gelegentlich bei tiefsitzenden Tumoren die Irresektabilität festgestellt werden. Zudem bietet sie die Möglichkeit bei Risikopatienten (z. B. Nachweis von Aszitespfützen in der EUS), eine Peritonealkarzinose zu detektieren.
Zur Primärdiagnose und Verlaufskontrolle des Ösophaguskarzinoms haben Tumormarker keinen diagnostischen Zugewinn.
Eine Auflistung der Stagingmaßnahmen mit entsprechendem Empfehlungsgrad siehe Tab. 2.
Tab. 2: Apparative Diagnostik zum Staging des Ösophaguskarzinoms [24] | |
Methode | Empfehlungsgrad |
Abdomensonographie (ggf. mit Kontrastmittel) | Soll |
Halssonographie | Kann |
Endosonographie | Soll |
CT Thorax/Abdomen | Soll |
CT Hals | Soll |
Positronenemmissionstomographie | kann (keine Routine) |
Laparoskopie | kann (fortgeschrittene Stadien) |
Bronchoskopie | T3/4 (proximaler/mittlerer Ösophagus) |
Breischluck | nicht geeignet |
Tumormarker | nicht geeignet |
Kurative Therapie
Endoskopische Therapie:
Die endoskopische Therapie ist für frühe Karzinome, die sich auf die Mukosa beschränken, bereits etabliert. Hierbei kommen als resezierende Verfahren die endoskopische Resektion (ER) und die endoskopische Submukosadissektion (ESD) zum Einsatz. In zahlreichen Studien konnte belegt werden, dass die ER sicher und effektiv ist und im Vergleich zur Ösophagusresektion bei gleicher Heilungsrate eine wesentlich geringere Mortalität und Morbidität aufweist [8, 21]. Die histologische bzw. mikroskopische Unterteilung der Mukosa erfolgt für Adenokarzinome* in Deutschland in vier Schichten (m1-m4) (und in anderen Ländern teils nur in drei Schichten (m1-m3); wogegen die Unterteilung der Plattenepithelkarzinome* generell in drei Schichten erfolgt (m1-m3). Die Submukosa wird für beide Entitäten analog in drei Schichten (sm1-sm3) eingeteilt.
Durch die endoskopische Therapie konnte bei mukosalen Barrettkarzinomen in einer aktuellen Studie eine Langzeitremission in fast 94 % der Fälle erzielt werden. Die tumorassoziierte Mortalität lag dabei gerade einmal bei 0,2 % [29]. Grundsätzlich sollten alle mukosalen AC ohne Risikofaktoren, sogenannte low-risk (LR)-Karzinome (pT1m, G1/2, keine Lymphgefäßinvasion, keine Blutgefäßinvasion und eine R0-Resektion nach basal) einer kurativen endoskopischen Therapie zugeführt werden. Für AC mit submukosaler Invasion steigt das Lymphknotenmetastasierungsrisiko in Abhängigkeit von der Infiltrationstiefe stetig an [17]. Bei Patienten mit nur geringer Submukosainfiltration (sm1) und LR-Kriterien ist die ER mit strikter Nachsorge die Alternative zur Operation bzw. zeigt sich dieser überlegen, weil die Lymphknotenmetastasierungsrate unter der Letalität der Ösophagusresektion liegt [18]. Das gilt in der Regel nur für „High-volume“-Zentren [17, 28]. Für Plattenepithelkarzinome* liegt das Risiko einer Lymphknotenbeteiligung allerdings höher. So steigt das Lymphknotenrisiko ab einer tiefen mukosalen Infiltration (m3) bereits signifikant an [10, 33].
Eine Überlegenheit der ESD bezüglich Rezidiven aufgrund ihrer en-bloc-Resektionsmöglichkeit bei Läsionen > 15mm gegenüber der piece-meal-Resektion konnte für AC bisher nicht gezeigt werden [38]. Zwar ist die höhere en-bloc-Resektionsrate der entscheidende Vorteil, schlägt aber mit einer höheren Komplikationsrate, deutlich höherem Zeitaufwand, höheren Kosten und Intubationspflichtigkeit zu Buche. Aufgrund des oft multifokalen landkartenartigen Wachstums mit Mischung aus LGIN, HGIN und Karzinom ist eine laterale R0-Resektion deutlich schwerer zu erreichen als z. B. beim Plattenepithelkarzinom. So konnte für die ESD von mukosalen Plattenepithelkarzinomen* (m1-m2) > 15mm bei R0-en-bloc-Resektion eine höhere kurative Resektionsrate bei gleichzeitig niedrigerer Rezidivrate gezeigt werden [4, 14]. Bei der Wahl der Resektionstechnik bestimmen Aetas und Komorbiditäten, welche Resektionstechnik der Patientin bzw. dem Patienten sinnvoll zugemutet werden kann. Wegen des Gesamtaufwandes eignet sich die ESD nicht als diagnostische Maßnahme bei makroskopisch für eine kurative endoskopische Therapie grenzwertigen Befunden.
Bei mukosalen Karzinomen und Nachweis von Karzinomresten im lateralen Resektionsrand kann die endoskopische Therapie weiter fortgeführt werden. Erst eine R1-Resektion nach basal oder die fehlende Resektionsmöglichkeit nach Narbenbildung kann zu einem alternativen Therapiekonzept führen.
Nach Resektion aller neoplastischen Areale im Barrettösophagus ist eine Ablationstherapie (Argon-Plasma-Koagulation (APC), Hybrid-APC- oder Radiofrequenzablation) der nicht neoplastischen Barrettschleimhaut zwingend erforderlich, da hiermit die Rate an metachronen Läsionen und Rezidiven um bis zu 34 % bzw. auf etwa 1 % gesenkt werden kann [19, 20, 32]. Neuere Verfahren wie die Kryoablation befinden sich derzeit noch in der Evaluationsphase.
Primär chirurgische Therapie:
Die chirurgische Ösophagusresektion war lange Jahre der Goldstandard in der Therapie bei potenziell resektablen Ösophaguskarzinomen im mittleren bis distalen Drittel. Mittlerweile ist das Feld der primären (also ohne Vortherapie) Ösophagusresektion auf Tumore mit tiefer Submukosainfiltration, T2-Karzinome und endoskopisch nicht resektable Tumore (z. B. multiple Vortherapien, schlechte Abheilung etc.) eingegrenzt. In der Regel wird, um eine R0-Resektion anzustreben, ein Sicherheitsabstand nach proximal und distal von 2–4 cm eingehalten. Zur Festlegung der Wahl des OP-Verfahrens dient die AEG-Klassifikation [36]. Das Standardverfahren für Tumore des mittleren und distalen Ösophagusdrittels sowie des gastroösophagealen Überganges ist die Ivor-Lewis-Resektion mit Zweifeld-Lymphadenektomie [12, 13]. Prinzipiell gelten Tumore, auch wenn die en-bloc-Resektion auf das Perikard oder einen infiltrierten Lungenlappen ausgedehnt werden muss, noch als resektabel. Ein alternatives Resektionsverfahren kann eine transhiatale Ösophagusresektion mit hoher cervicaler Anastomose sein. Dabei sind jedoch zwei Nachteile zu beachten. Zum einen ist die Rate an Anastomoseninsuffizienzen höher. Zum anderen ist die Lymphadenektomie weit weniger radikal. Zwar wird für eine pN0-Klassifikation lediglich die histologische Untersuchung von sieben Lymphknoten gefordert. Es zeigte sich in Studien jedoch, dass eine geringere Anzahl an Lymphknoten mit einem signifikant schlechteren Überlebensvorteil vergesellschaftet ist [23, 31]. Standard für die Lymphadenektomie ist die thorakale und die abdominelle Ausräumung. Dabei werden in der Regel zwischen 20–33 Lymphknoten entfernt. Bei cervikalen Karzinomen sollte das dritte (cervicale) Kompartiment ebenfalls reseziert werden. Allerdings ist bei sehr hochsitzenden Ösophaguskarzinomen aufgrund der hohen Rate an Anastomoseninsuffizienzen, Einschluckstörungen und Aspirationen auch eine definitive Radio-Chemotherapie zu erwägen. Als Rekonstruktionsverfahren der Wahl ist der Magenhochzug anzusehen. Eine Koloninterposition oder ein Jejunuminterponat kommen meist nur bei Voroperationen am Magen in Betracht.
Bezüglich der Resektionstechnik, ob total minimal invasiv, offener Ösophagusresektion oder Hybrid-Technik (Kombination aus beiden) gibt es keine eindeutige Richtlinie. Die Hybrid-Technik mit laparoskopischer Gastrolyse in Kombination mit offener transthorakaler Ösophagusresektion hat sich jedoch aufgrund der geringeren Rate an pulmonalen Komplikationen, kürzerem Intensiv- und Krankenhausaufenthalt derzeit als Standardoperationstechnik etabliert [28, 42].
Multimodale Therapiekonzepte:
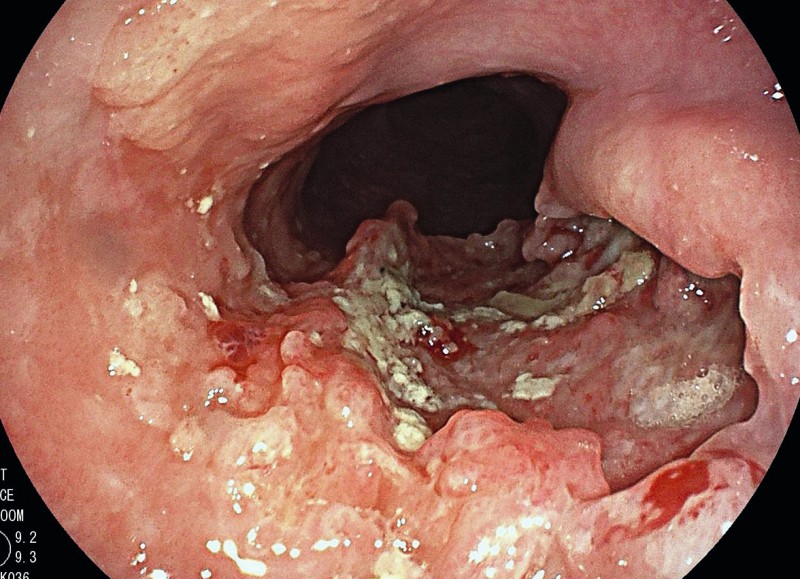
Die Prognose für lokal fortgeschrittene oder Lymphknoten-positive Ösophaguskarzinome ist schlecht. Die Fünf-Jahres-Überlebensraten liegen im Stadium IIa bei 30–40 % (Bild 4), im Stadium IIb bei 10–30 % und im Stadium III bei 10–15 % .
So können AC sowohl mit neoadjuvanter Radio-Chemotherapie als auch mit perioperativer Chemotherapie alleine therapiert werden. In Deutschland hat in Anlehnung an die Therapie von Magenkarzinomen das FLOT-Schema (Docetaxel 50 mg/m², 5 FU 2600 mg/m², Leucovorin 200mg/m², Oxaliplatin 85 mg/m², Wiederholung alle zwei Wochen, vier Zyklen präoperativ und vier Zyklen postoperativ) eine weite Verbreitung gefunden. Ein Vergleich zwischen FLOT- und CROSS-Protokoll für AC wird aktuell im Rahmen der ESOPEC-Studie durchgeführt. Falls der Tumor nicht resektabel ist oder Patienten funktionell nicht operabel sind, besteht durchaus die Möglichkeit, in den Stadien II-III eine definitive Radio-Chemotherapie durchzuführen, wobei Fünf-Jahres-Überlebensraten von bis zu 35 % erzielt werden konnten [15]. Beim PLK des cervicalen Ösophagus wird aufgrund der schwierigereren Anastomosensituation und der damit verbundenen gehäuften dysphagischen Beschwerden eine definitive Radio-Chemotherapie sogar empfohlen.
Palliative Therapie
Radio-Chemotherapie:
Eine palliative Chemotherapie kann Patienten im Stadium IV oder nicht kurativ behandelbaren Ösophaguskarzinomen angeboten werden. Dies gilt für beide Entitäten, allerdings ist ein Überlebensvorteil für Patienten mit PLK nicht belegt. Wichtig ist es, möglichst frühzeitig einen HER2-Status bei Patienten mit AC zu bestimmen. Patienten mit einem negativen Status sollten eine Platin- und Fluoropyrimidin basierte Kombinationstherapie erhalten [40]. Der Einsatz des monklonalen Antikörpers Trastuzumab wird beim AC mit Überexpression des HER2-Status additiv zur palliativen Chemotherapie empfohlen [1]. Mit Ramucirumab steht zusätzlich ein weiterer Antikörper zur Verfügung, bei welchem sich eine Verbesserung des Gesamtüberlebens abzeichnet. Von strahlentherapeutischer Seite kann in ausgewählten Fällen eine intraluminale Brachytherapie durchaus eine Therapieoption sein.
Endoskopie:
Ein limitierender Faktor bei fortgeschrittenen Karzinomen des Ösophagus ist die Dysphagie bedingt durch das teilweise stenosierende Wachstum. Daher liegt das Ziel der Therapie im Erhalt der Passage durch den Ösophagus. Dafür stehen verschiedene endoskopische Techniken zur Verfügung. Einerseits können Bougierungen oder bei exophytischem Wachstum thermische Verfahren zur Tumorverkleinerung eingesetzt werden. Zusätzlich können auch selbstexpandierende Metallstents (SEMS) eingesetzt werden [2]. Bei voll-gecoverten SEMS ist die Gefahr der Stentmigration nach distal relativ hoch, wogegen ungecoverte Stents zwar ein geringeres Risiko der Stentmigration zeigen, jedoch der Tumor relativ schnell durch die Maschen wachsen kann und es erneut zu dysphagischen Beschwerden kommt. Hier bieten teilgecoverte SEMS die wohl beste Alternative. Neuere Daten belegen allerdings auch den Einsatz der voll-gecoverten Stents in dieser Situation [30]. Bei der Nutzung von SEMS sollte jedoch auch beachtet werden, dass es, falls der gastroösophageale Übergang überbrückt wird, zu einem deutlichen Volumenreflux kommen kann, der die Lebensqualität der Patienten einschränkt.
Dr. med. Jens Wetzka, Leitender Oberarzt, E-Mail: j.wetzka@asklepios.com
Prof. Dr. med. Andrea May, Chefärztin
Beide sind Fachärzte für Innere Medizin und Gastroenterologie der Klinik für Gastroenterologie, Hämatologie/Onkologie und Pneumologie an der Asklepios Paulinen Klinik Wiesbaden.
* Zwei Diagramme zu Adenokarzinomen und Plattenepithelkarzinomen des Ösophagus sowie die CME-Fragen und Literaturhinweise finden Sie in der PDF-Version der aktuellen Ausgabe auf unserer Website unter https://www.laekh.de/heftarchiv/ausgabe/2020/mai-2020