Prof. Dr. med. Gunnar Henrik Heine1, 2, 3, PD Dr. med. Kyrill Sebastian Rogacev2, 4
Einleitung
In Deutschland leben laut Schätzung aus der bundesweiten „Studie zur Gesundheit Erwachsener in Deutschland 2008–2011“ (DEGS1) mehr als 10 Millionen Menschen mit chronischer Nierenerkrankung [1]. Davon weisen mindestens zwei Millionen eine eingeschränkte exkretorische Nierenfunktion auf, definiert als glomeruläre Filtrationsrate (GFR) < 60 ml/min/ 1,73 m² [1]. Die meisten Patienten mit chronischer Nierenerkrankung sind nicht durch renale Ereignisse wie einer Progredienz bis zur Dialysepflichtigkeit, sondern durch extrarenale Komorbiditäten gefährdet, von denen kardiovaskuläre Erkrankungen eine besondere Bedeutung aufweisen.
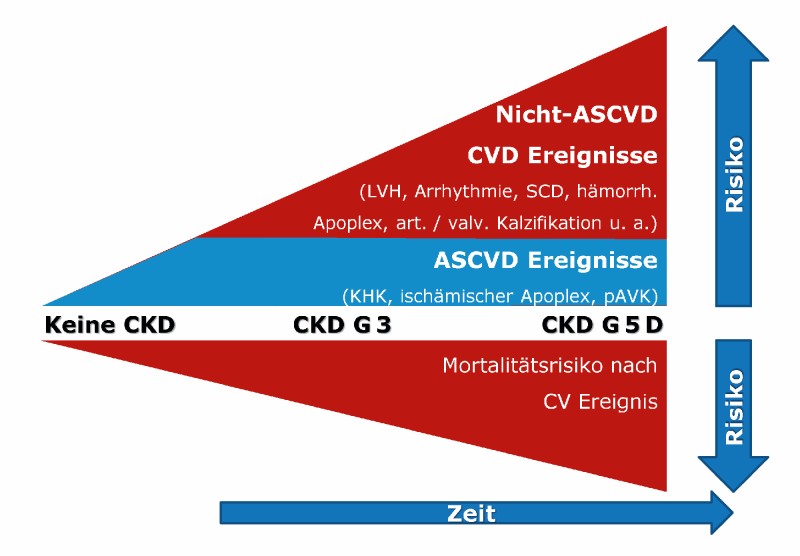
Anders als in der nierengesunden Allgemeinbevölkerungen, bei welcher atherosklerotische Gefäßerkrankungen (atherosclerotic cardiovascular disease; ASCVD) als dominierendes kardiovaskuläres Erkrankungsbild erscheinen, rücken bei Patienten mit chronischer Nierenerkrankung (chronic kidney disease; CKD) nicht-atherosklerotische kardiovaskuläre Erkrankungen in den Vordergrund (Abb. 1).
Abb. 1: Kardiovaskuläre Ereignisse im Spektrum der chronischen Nierenerkrankung („chronic kidney disease“; CKD). Mit voranschreitender CKD nehmen insbesondere nicht-atherosklerotische kardiovaskuläre Ereignisse gegenüber atherosklerotischen kardiovaskulären Ereignissen zu. Abkürzungen: art./valv.: arteriell/valvulär; ASCVD: atherosklerotische kardiovaskuläre Erkrankung (atherosclerotic cardiovascular disease); CV: kardiovaskulär; CVD: kardiovaskuläre Erkrankung (cardiovascular disease); KHK: koronare Herzerkrankung; LVH: linksventrikuläre Hypertrophie; pAVK: periphere arterielle Verschlusserkrankung; SCD: plötzlicher Herztod (sudden cardiac death).
Daher erreichen Therapiestrategien, die vor allem auf die Prävention und Therapie von ASCVD zielen, zumindest bei weit fortgeschrittener CKD einen geringeren relativen Benefit; als klassisches Beispiel hierfür gelten Statine, die mit weiter fortgeschrittener CKD eine geringere relative Risikoreduktion für ASCVD als bei nierengesunden Menschen erlauben [2]. Trotz der relativen Verschiebung zu nicht-atherosklerotischen kardiovaskulären Erkrankungen weisen Patienten mit fortschreitender CKD gegenüber nierengesunden Menschen jedoch in absoluten Zahlen ein erhöhtes Risiko auch für ASCVD auf, weshalb aktuelle Leitlinien bewusst mit Blick auf die absolute Risikoreduktion für die Mehrzahl der Patienten mit fortgeschrittener CKD ebenso eine Statintherapie empfehlen [3].
Im Fokus der nicht-atherosklerotischen kardiovaskulären Erkrankungen steht initial eine linksventrikuläre Hypertrophie, die pathophysiologisch zum nachfolgenden Auftreten einer chronischen Herzinsuffizienz und maligner Arrhythmien prädisponiert. Mehr als ein Viertel aller CKD-Patienten hat eine eingeschränkte systolische linksventrikuläre Funktion [4]. Typische Komplikationen der HFrEF – terminales Herzversagen und maligne Arrhythmien – stellen daher die häufigste Todesursache von Patienten mit fortgeschrittener CKD dar [5]. Hierbei ist eine CKD nicht zwingend Ursache, sondern häufig auch Folge einer Herzinsuffizienz, welche hämodynamisch durch verminderte kardiale Ejektionsleistung, erhöhte kardiale Vorlast mit renaler Kongestion und Aktivierung endokriner Signalkaskaden eine Nierenfunktionseinschränkung auslösen kann. So zeigt etwa jeder zweite Patient mit Herzinsuffizienz mit reduzierter Ejektionsfraktion (heart failure with reduced ejection fraction; HFrEF) eine eingeschränkte glomeruläre Filtrationsrate und weist somit definitionsgemäß eine chronische Nierenerkrankung auf (siehe www.herzinsuffizienz.versorgungsleitlinien.de).
Trotz der hohen medizinischen und gesundheitsökonomischen Bedeutung der HFrEF bei CKD-Patienten liegen leider nur wenige spezifische Daten zur evidenzbasierten Therapie dieser Patienten vor. Große kardiologische Interventionsstudien haben in der Vergangenheit und Gegenwart Patienten mit fortgeschrittener CKD (insbesondere in den CKD-Stadien G 4–5, also mit einer glomerulären Filtrationsrate < 30 ml/min/1,73 m²) zumeist ausgeschlossen. Auch für Patienten mit mäßiggradiger Nierenfunktionseinschränkung (CKD G 3, GFR 30–59 ml/min/1,73 m²) liegen kaum eigenständige (CKD-spezifische) Interventionsstudien vor. Allerdings waren diese Patienten zumeist in große Herzinsuffizienzstudien eingeschlossen worden, so dass aus diesem Studien zumeist Subgruppenanalysen für CKD G 3-Patienten vorliegen. Diese Subgruppenanalysen zeigen zusammenfassend, dass Patienten mit CKD G 3 und HFrEF mindestens genauso von medikamentösen Interventionen profitieren wie herzinsuffiziente Patienten mit erhaltener glomerulärer Filtrationsrate.
Allerdings können diese Daten nicht unkritisch auf CKD G 4–5-Patienten übertragen werden:
- Die Mehrzahl der traditionellen prognoseverbessernden Herzinsuffizienzmedikamente hemmt direkt (ACE-Hemmer, Angiotensin-Rezeptor-Blocker [ARB] und Mineralocorticoid-Rezeptor-Antagonisten [MRA]) oder indirekt (Betablocker) das Renin-Aldosteron-System (RAAS). Typische Komplikationen einer RAAS-Hemmung wie eine Hyperkaliämie und eine Nierenfunktionsverschlechterung treten bei fortgeschrittener CKD häufiger auf.
- Manche Medikamente akkumulieren bei fortgeschrittener chronischer Nierenerkrankung, insbesondere einzelne kardiospezifische Betablocker und wirksame Metabolite von Sacubitril.
- Die pharmakodynamischen Effekte mancher Wirksubstanzen – insbesondere von Hemmern des „Sodium-dependent glucose transporters“ (SGLT-2-Inhibitoren) – setzen wahrscheinlich eine ausreichende Nierenfunktion voraus, obgleich zunehmend auch direkte kardiovaskuläre Effekte von SGLT-2-Inhibitoren diskutiert werden.
- Die Wirkung von Sacubitril umfasst insbesondere auch eine Akkumulation von natriuretischen Peptiden, welche bei fortgeschrittener CKD bereits ohne medikamentöse Intervention massiv erhöht sind. Inwieweit eine weitere, pharmakologisch bedingte Akkumulation von natriuretischen Peptiden vorteilhaft ist, bleibt unklar.
Diese Erwägungen und die fehlende Evidenz aus randomisierten Studien bedingen leider einen therapeutischen Neglect: Zwar gelten Patienten mit fortgeschrittener CKD und HFrEF als kardiovaskuläre Hochrisikopatienten, erhalten aber dennoch sehr viel seltener kardioprotektive Medikamente als HFrEF-Patienten mit normaler oder geringgradig eingeschränkter Nierenfunktion. Epidemiologische Studien suggerieren, dass dieser Neglect die Patienten schädigt. So erweist sich die Nicht-Verordnung kardioprotektiver Medikamente neben der chronischen Nierenerkrankung per se als eigenständiger und unabhängiger negativer Prognosefaktor bei herzinsuffizienten Menschen [6].
Inzwischen erkennen Leitlinien (siehe erneut www.herzinsuffizienz.versorgungsleitlinien.de) zunehmend an, dass ein solcher therapeutischer Neglect Patienten mit fortgeschrittener CKD und HFrEF eher gefährdet als schützt, und raten auch in Abwesenheit von klarer Evidenz zum Einsatz kardioprotektiver Pharmaka – allerdings unter recht engmaschiger klinischer und laborchemischer Kontrolle der betroffenen Patienten.
Im Folgenden sollen Pharmaka, die in der HFrEF-Therapie mit dem Ziel einer Prognoseverbesserung eingesetzt werden, im Kontext der CKD kurz skizziert werden. Der Einsatz dieser Substanzen wird klassischerweise begleitet von nicht-pharmakologischen Maßnahmen (Flüssigkeits- und Kochsalzrestriktion, regelmäßige körperliche Aktivität), von Pharmaka, die vor allem zur Symptomkontrolle erforderlich sind – insbesondere Schleifen- und Thiazid(-ähnliche) Diuretika, aber auch Digitalispräparate –, und von Interventionen wie der Implantation von Defibrillatoren und kardialen Resynchronisationstherapien (Cardiac Resynchronization Therapy, CRT). Leider gilt auch für die meisten dieser nicht-pharmakologischen, symptomfokussierten pharmakologischen und interventionellen Maßnahmen, dass kaum Evidenz für Patienten mit fortgeschrittener CKD vorliegt: So wird insbesondere das Ausmaß der Kochsalzrestriktion bei HFrEF kontrovers diskutiert.
Etablierte Therapiestrategien
ACE-Hemmer und Angiotensin-Rezeptorblocker
Basis der HFrEF-Therapie sind neben kardioselektiven Betablockern ACE-Hemmer und ARB. Beide Substanzgruppen verhinderten in großen randomisierten Interventionsstudien stationäre Aufnahmen wegen Herzinsuffizienz und kardiale Todesfälle: Dies gilt auch für Subgruppenanalysen von Patienten mit leichtgradig eingeschränkter Nierenfunktion (CKD 3a–3b), während Patienten mit Herzinsuffizienz und fortgeschrittener CKD (CKD 4–5) in den großen Interventionsstudien zumeist ausgeschlossen waren. Da ACE-Hemmer und ARB jedoch Basis der antihypertensiven Therapie sind und zumindest bei Patienten mit höhergradiger Albuminurie nephroprotektive Effekte aufweisen, ergibt sich für die meisten Patienten mit fortgeschrittener CKD bereits unabhängig von der Herzinsuffizienz eine Indikation zur Therapie mit diesen Wirksubstanzen. Eine Kombination von ACE-Hemmern und ARB ist obsolet, da diese in keiner bislang untersuchten Indikation einen eindeutigen prognostischen Benefit aufweist, während die Nebenwirkungsgefahr (erhöhte Hyperkaliämieraten und Verschlechterungen der Nierenfunktion) gegenüber einer Monotherapie aus ACE-Hemmer oder ARB ansteigt.
Die Initiierung von ACE-Hemmern oder ARB bei CKD-Patienten kann aufgrund Vasodilatation der Vasa efferentia mit glomerulärer Druckreduktion in einer hämodynamisch bedingten diskreten Verminderung der glomerulären Filtration mit ebenfalls diskretem Kreatininanstieg münden. Dieser sollte nicht als „Nephrotoxizität“ interpretiert werden; vielmehr ist diese glomeruläre Druckreduktion langfristig eher nephroprotektiv als nephrotoxisch. Daher sollte auch bei mäßigem Kreatininanstieg eine (kardioprotektive) Auftitrierung von ACE-Hemmern oder ARB erfolgen, anstelle die RAAS-Inhibition abzusetzen. Es wird vorgeschlagen, eine hämodynamisch bedingte Verminderung der GFR nach Initiierung von ACE-Hemmern oder ARB als „Verschlechterung der Nierenfunktion“ (Worsening of Renal Function; WRF) und nicht als „akute Nierenschädigung“ zu bezeichnen. Auch eine moderate Hyperkaliämie sollte nicht direkt zur Beendigung der RAAS-Inhibition führen.
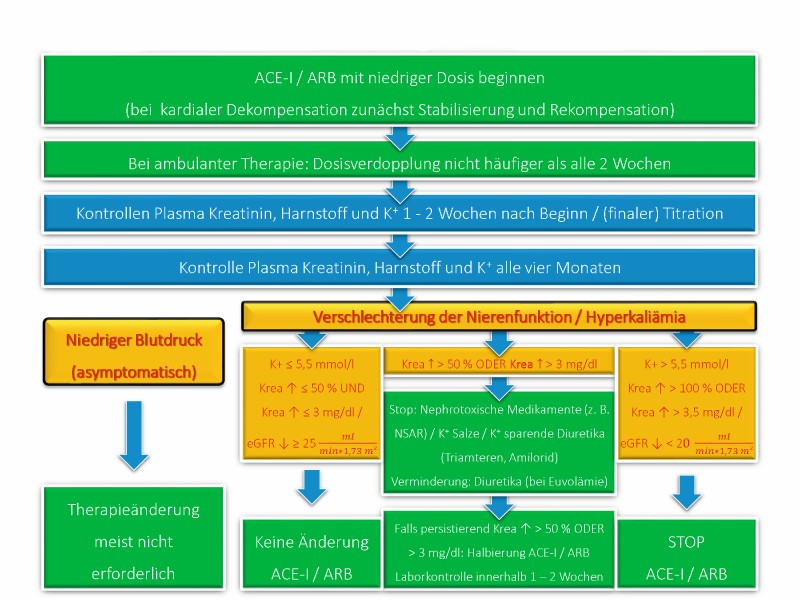
Die European Society of Cardiology (Abb. 2) schlägt vor, einen Kreatininanstieg von ≤ 50 % gegenüber Ausgangswerten und einen Kaliumanstieg bis 5,5 mmol/l unter ACE-Hemmern und ARB zumeist zu tolerieren. Selbst bei weiteren Anstiegen sollten nicht zwingend ACE-Hemmer oder ARB reduziert oder pausiert, sondern eher alternative Ursachen für eine Verschlechterung der Nierenfunktion oder eine Hyperkaliämie identifiziert und behandelt werden.
Abb. 2: Empfehlungen der European Society of Cardiology zur Überwachung von Nierenfunktion und Elektrolyten bei Einsatz von ACE-Hemmern und Angiotensin-Rezeptor-Blockern (ARB).
Betablockertherapie
Ähnlich wie ACE-Hemmer und ARB verminderten kardioselektive Betablocker als zweite Säule der initialen HFrEF-Therapie in großen randomisierten Interventionsstudien stationäre Aufnahmen wegen Herzinsuffizienz und kardiale Todesfälle. Auch hier haben Interventionsstudien Patienten mit moderater (insbesondere CKD G 3a–3b) eingeschlossen, die in der Regel mindestens so sehr von der BetablockerTherapie profitierten wie nierengesunde Patienten. Ähnlich wie für ACE-Hemmer und ARB fehlen allerdings auch für Betablocker größere und solide Interventionsstudien, die Patienten mit weit fortgeschrittener CKD (insbesondere CKD G 4–5) in ausreichender Zahl einschlossen.
Es wird kontrovers diskutiert, inwieweit einzelne Betablocker bei fortgeschrittener CKD akkumulieren. Auch ein substanzspezifisches „Auswaschen“ einzelner Betablocker während der Nierenersatztherapie wird diskutiert. Leider sind die Daten zu der Frage, welche Betablocker besonders betroffen sind, teilweise widersprüchlich, so dass keine eindeutige Präferenz für eine einzelne Wirksubstanz gemacht werden kann.
Mineralocorticoid-Rezeptor-Antagonisten
Wenn Patienten mit HFrEF unter Einsatz von Betablockern und entweder ACE-Hemmern oder ARB persistierend eine Herzinsuffizienzsymptomatik und Ejektionsfraktion ≤ 35 % aufweisen, so sehen die ESC-Leitlinien als nächstes die Hinzunahme von Mineralocorticoid-Rezeptor-Antagonisten (MRA) vor. Dies folgt den RALES (Spironolacton), EPHESUS (Eplerenon; Post-Infarkt-Patienten) und EMPHASIS-HF (Eplerenon; geringgradig symptomatische Patienten)-Studien, in welchen MRA jeweils Endpunkte von stationären Aufnahmen wegen kardialer Dekompensationen und kardiale Todesfälle verminderten. Subgruppenanalysen dieser Studien, die Patienten mit CKD G 3a–3b eingeschlossen hatten, zeigen einen mindestens ebenso großen Benefit für diese wie für nierengesunde Patienten. Auch hier waren Patienten mit CKD G 4–5 von der Studienteilnahme weitgehend ausgeschlossen.
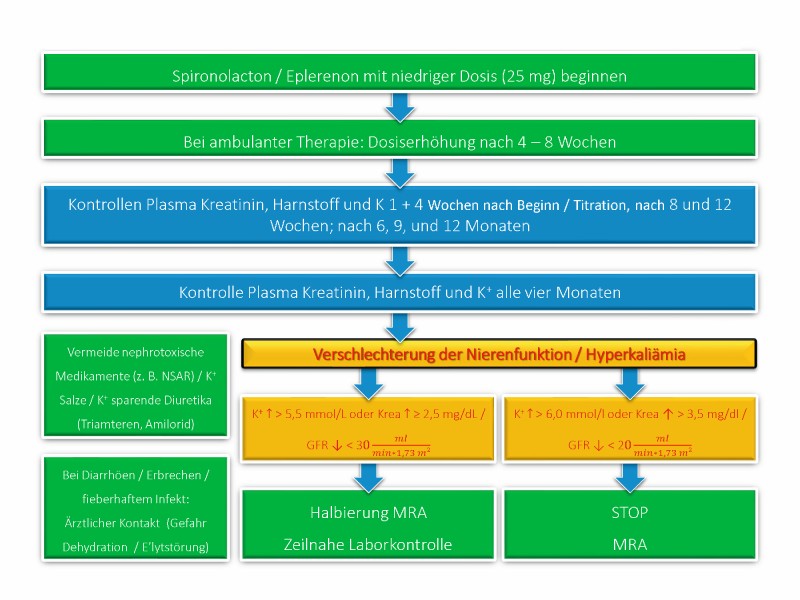
MRA sollten in der Herzinsuffizienztherapie immer in Kombination mit ACE-Hemmern oder ARB eingesetzt werden. Nebenwirkungen von MRA, ACE-Hemmern und ARB auf Nierenfunktion und Kaliumhaushalt überschneiden sich aufgrund der gemeinsamen Hemmung des RAAS. Daher sind insbesondere bei CKD-Patienten regelmäßige Kontrollen von Kreatinin, Harnstoff und Kalium erforderlich (vgl. erneut die ESC-Empfehlungen, Abb. 3).
Abb. 3: Empfehlungen der European Society of Cardiology zur Überwachung von Nierenfunktion und Elektrolyten bei Einsatz von Mineralocorticoid-Rezeptor-Antagonisten (MRA).
Sinnvoll ist weiterhin, Patienten zur MRA-Pausierung bei akuten fieberhaften Infekten und stärkeren Magen-Darm-Erkrankungen mit überproportionalen Flüssigkeitsverlusten zu raten, da diese Erkrankungen aufgrund kutaner respektive gastroenteraler Flüssigkeitsverluste und Hypotonie zur akuten Nierenschädigung und konsekutiver Hyperkaliämie prädisponieren. Die Patienten sollten bei Pausierung der MRA rasch ihren Hausarzt zur Laborkontrolle aufsuchen und nach Ausschluss oder Ausheilung einer akuten Nierenschädigung MRA re-initiieren.
Von regelmäßigem Einsatz von Poly(styrol-codivinylbenzol)sulfonsäure Natriumsalz (in Deutschland zumeist als Resonium® bekannt) zum Schutz vor Hyperkaliämien wird inzwischen abgeraten: Die kaliumsenkende Wirkung von Resonium® ist kaum in längeren prospektiven Studien untersucht worden, und es ist völlig unklar, ob Resonium® Komplikationen aufgrund von Hyperkaliämien verhindert. In jedem Falle interagiert Resonium® mit der Resorption anderer oraler Pharmaka, verursacht eine (insbesondere bei HFrEF und CKD unerwünschte) Natriumlast und kann potentiell lebensbedrohliche gastroenterale Nebenwirkungen verursachen [7]. Weitgehend unbeachtet bleibt zudem, dass der Einsatz von Resonium® laut Fachinformation tägliche Kontrollen des Plasma-Kaliums erfordert.
In der DIAMOND-Studie (NCT03888066) wird aktuell untersucht, ob die regelmäßige Einnahme des neueren Kaliumbinders Patiromer durch Verhinderung von Hyperkaliämien eine sicherere (und/oder intensivere) RAAS-Blockade erlaubt und dadurch kardiale Ereignisse reduzieren wird. Diese Studie ist beachtenswert, da die Rezeptierung von oralen Kaliumbindern die Tablettenlast für die Patienten und Therapiekosten für die Solidargemeinschaft weiter erhöht.
Innerhalb der nächsten Monate wird mit Finerenon ein neuer MRA zugelassen, der in einigen frühen klinischen Studien mit einer geringeren Gefahr von Hyperkaliämien als Spironolacton oder Eplerenon assoziiert war. Die FIGARO- und FIDELIO-Studien untersuchen momentan den renoprotektiven Effekt von Finerenon bei nicht-dialysepflichtiger CKD und erfassen kardiale Ereignisse als sekundäre Endpunkte. Große eigenständige Herzinsuffzienzstudien zum Einsatz von Finerenon sind aktuell nicht geplant.
Ivabradin
Als Inhibitor des If-Kanals erlaubt Ivabradin bei Sinusrhythmus eine selektive Herzfrequenz-Reduktion. Ob Ivabradin kardioprotektiv ist, wird kontrovers beurteilt. In der BEAUTIFUL-Studie erbrachte Ivabradin keine Prognoseverbesserung bei Patienten mit koronarer Herzerkrankung und eingeschränkter systolischer linksventrikulärer Funktion, die nicht alle typischen Symptome einer Herzinsuffizienz zeigten.
Die SHIFT-Studie bei HFrEF-Patienten suggeriert hingegen einen potenziellen prognostischen Benefit. Leider erscheinen jedoch aus methodischen Gründen wie einer Unterdosierung mit Betablockern die Ergebnisse der SHIFT-Studie in ihrer klinischen Relevanz fraglich [8]. Patienten mit einem Kreatinin > 220 μmol/l waren in SHIFT ausgeschlossen; andere größeren Studien zum Einsatz von Ivabradin bei höhergradiger Nierenfunktionseinschränkung fehlen, so dass keinerlei Evidenz für den Einsatz von Ivabradin bei Patienten mit fortgeschrittener CKD und HFrEF besteht.
Sacubitril/Valsartan
In der PARADIGM HF-Studie war Sacubitril/Valsartan gegenüber dem ACE-Hemmer Enalapril (welcher allerdings nicht komplett ausdosiert wurde) bei HFrEF-Patienten prognostisch überlegen [11]. Dies mündet in den aktuellen europäischen Herzinsuffizienzleitlinien in der Empfehlung, Sacubitril/Valsartan anstelle von ACE-Hemmern einzusetzen, wenn HFrEF-Patienten unter Standardtherapie mit ACE-Hemmer (oder ARB), Beta-Blocker und MRA noch symptomatisch sind und eine Ejektionsfraktion ≤ 35 % aufweisen [10]. Patienten mit bei Studienbeginn eingeschränkter Nierenfunktion (eGFR 30 – 60 ml/min/1,73 m²) profitierten in gleichem Maße von Sacubitril/Valsartan wie Patienten mit erhaltener Nierenfunktion. Auch für Sacubitril/Valsartan fehlen Herzinsuffizienzstudien bei Patienten mit einer eGFR < 30 ml/min/1,73 m².
Wie oben bereits aufgeführt, muss aufgrund Akkumulation eines aktiven Metaboliten von Sacubitril bei fortgeschrittener CKD eine deutlich stärkere Wirkung als bei Menschen mit normaler oder leichtgradig eingeschränkter Nierenfunktion erwartet werden [15]. Wie ebenfalls bereits aufgeführt, muss beachtet werden, dass Patienten mit weit fortgeschrittener CKD gegenüber nierengesunden Menschen bereits ohne pharmakologische Interventionen eine deutliche Erhöhung natriuretischer Peptide im Serum aufweisen [14]. Die Hinzunahme von Sacubitril (welches den Abbau natriuretischer Peptide inhibiert) bewirkt eine weitere Akkumulation dieser Peptide, deren physiologische Konsequenz bei fehlenden klinischen Studien unklar bleibt.
SGLT-2-Inhibitoren
Die drei SGLT-2-Inhibitoren Empagliflozin (EMPA-REG Outcome-Studie), Dapagliflozin (DECLARE-TIMI 58-Studie) und Canagliflozin (CANVAS-Studie) haben in großen kardiovaskulären Sicherheitsstudien einerseits das Risiko stationärer Krankenhausaufnahmen aufgrund Herzinsuffizienz und andererseits das Risiko für die Entstehung oder Progression einer chronischen Nierenerkrankung deutlich verringert. Allerdings haben EMPA-REG Outcome, DECLARE-TIMI 58 und CANVAS zwar kardiovaskuläre Risikopatienten, aber nicht spezifisch Patienten mit HFrEF oder CKD rekrutiert. Daher wurde auch – anders als in eigenständigen Herzinsuffizienz-Studien – die linksventrikuläre Funktion bei Studienbeginn nicht systematisch dokumentiert. Alle drei Studien untersuchten die kardiovaskuläre Sicherheit (mit besonderer Beachtung atherosklerotischer kardiovaskulärer Ereignisse) und nicht spezifisch renale oder myokardiale Effekte, so dass der kombinierte primäre kardiovaskuläre Endpunkt von EMPA-REG Outcome, DECLARE-TIMI 58 und CANVAS jeweils auf Myokardinfarkte und Schlaganfälle fokussierte.
Nachfolgend wurden Phase 3-Studien initiiert, die bei chronisch nierenkranken Menschen spezifisch den renalen Benefit und bei Patienten mit Herzinsuffizienz spezifisch den myokardialen Benefit von SGLT-2-Inhibitoren überprüfen. Teilweise rekrutieren diese Studie neben Diabetikern auch Nicht-Diabetiker.
Im Vorjahr wurde CREDENCE als erste große primär renale SGLT-2-Inhibitor-Studie publiziert. In CREDENCE gelang Canagliflozin eine deutliche Verlangsamung der CKD-Progredienz bis zur Dialysepflichtigkeit bei Typ 2-Diabetikern mit CKD G 2–3b A 3 (GFR 30–90 ml/min/1,73 m², Albuminurie > 300 mg/g Kreatinin). Als sekundärer Endpunkt wurden stationäre Aufnahmen wegen Herzinsuffizienz untersucht, die ebenfalls reduziert wurden. Zum Zeitpunkt der Verfassung dieser Arbeit (Frühjahr 2020) erfolgte eine Pressemitteilung, dass in DAPA-CKD als zweiter großer Studie zur Nephroprotektion durch SGLT-2-Inhibitoren Dapagliflozin eine Reduktion der CKD-Progression erreichte; die Studienpublikation ist für Herbst 2020 geplant. Anders als in der CREDENCE-Studie hat DAPA-CKD auch Nicht-Diabetiker eingeschlossen. Schließlich hat in der DAPA-HF-Studie (als erster großer Herzinsuffizienzsstudie für SGLT-2-Inhibitoren) Dapagliflozin die Gefahr einer Verschlechterung der Herzinsuffizienz und kardiovaskulärer Todesfälle bei HFrEF signifikant vermindert; auch die Gesamtmortalität konnte reduziert werden. Dapagliflozin war bei Patienten mit eingeschränkter eGFR (bis minimal 30 ml/min/1,73 m² bei Studienbeginn) und bei Patienten ohne Diabetes mellitus gleichermaßen protektiv wie bei Patienten mit normaler eGFR und mit Diabetes mellitus.
Auch wenn SGLT-2-Inhibitoren in Europa zum aktuellen Zeitpunkt noch allein als antidiabetische Medikamente zugelassen sind, deren Einsatz bei Diabetikern mit renalen, myokardialen oder kardiovaskulären Komorbiditäten allerdings frühzeitig erfolgen sollte [9], ist in den nächsten Monaten eine Zulassungserweiterung zu erwarten, so dass diese Medikamente auch in der spezifischen Herzinsuffizienzmedikation bei HFrEF-Patienten und zur Nephroprotektion bei CKD einen festen Platz finden werden.
Eisen/Erythropoese-stimulierende Agenzien
Chronisch nierenkranke HFrEF-Patienten weisen nahezu häufig eine Anämie auf, die in der Regel vor allem auf Eisenmangel und inadäquate Erythropoetinbildung zurückgeführt werden kann. Auch chronisch nierenkranke HFrEF-Patienten ohne manifeste Anämie haben häufig einen funktionellen oder absoluten Eisenmangel. Bislang gelang es weder in der Nephrologie noch in der Kardiologie, durch Gabe von Erythropoetin oder anderer Erythropo- ese-stimulierender Agenzien (ESA) eine Prognoseverbesserung von CKD und/oder HFrEF-Patienten zu erreichen. Daher sehen die Herzinsuffizienzleitlinien den Einsatz von ESA höchst zurückhaltend [10] – wobei spätestens nach Erreichen der Dialysepflicht eine ESA-Therapie oft erforderlich ist, um Transfusionen zu vermeiden.
Prognostisch vorteilhafter könnte eine hochdosierte intravenöse Eisentherapie sein, welche in der PIVOTAL-Studie bei Hämodialysepatienten gegenüber einer restriktiveren Eisentherapie stationäre Aufnahmen aufgrund Herzinsuffizienz verminderte [16]. Zwar schloss PIVOTAL nicht nur kardial manifest vorerkrankte Patienten ein, weshalb sie nicht als reine Herzinsuffizienzstudie gelten kann. Allerdings suggerieren bei HFrEF-Patienten außerhalb der Nephrologie randomisierte Studien [17] positive Effekte einer intravenösen Eisengabe auf die Belastbarkeit und Lebensqualität von herzinsuffizienten Patienten. Daher wurden größere Interventionsstudien initiiert, die bei HFrEF eine mögliche Reduktion stationärer Aufnahmen wegen kardialer Dekompensation und kardialer Todesfälle durch intravenöse Eisentherapie untersuchen.
Zusammenfassung
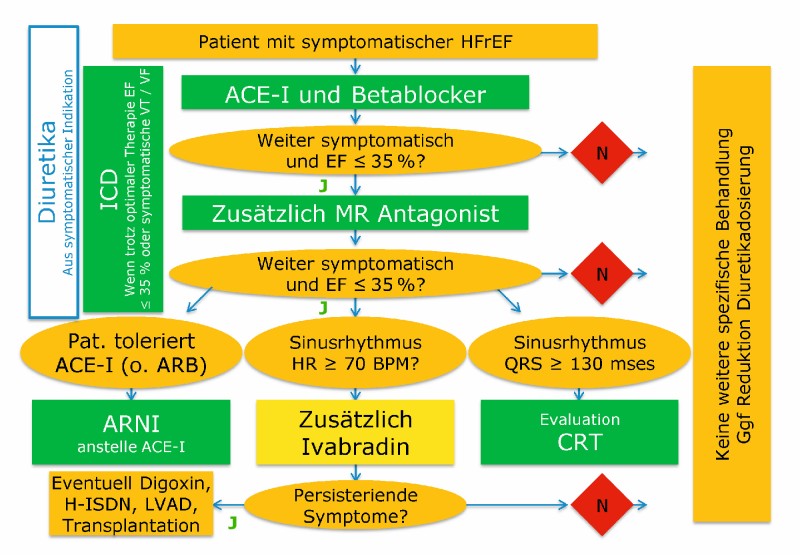
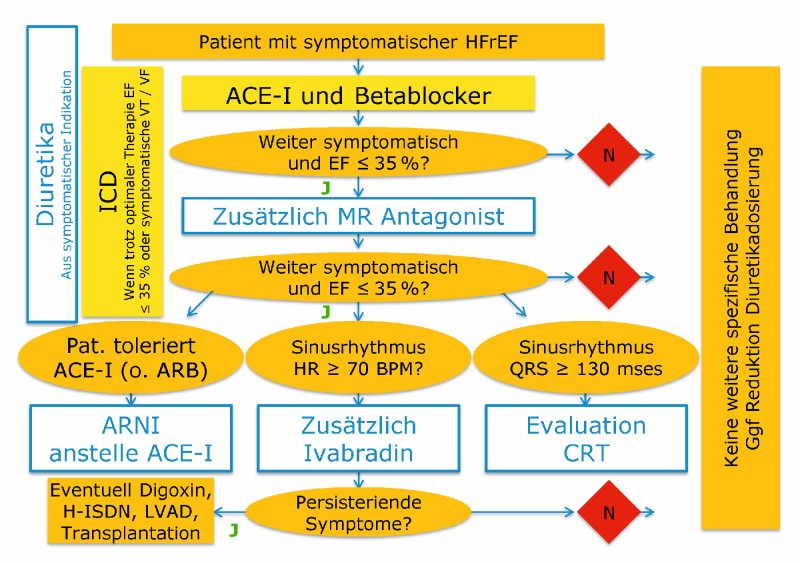
Obgleich Patienten mit chronischer Nierenerkrankung kardiovaskuläre Hochrisikopatienten sind, die häufig an chronischer Herzinsuffizienz leiden, liegen nur sehr wenige spezifische Studien zur kardialen Therapie dieser Patienten vor. Bei Patienten mit gering- und mittelgradiger CKD (CKD G 1–3) können Therapiealgorithmen der kardiologischen Fachgesellschaften zur HFrEF unkritisch übernommen werden (Abb. 4) da bei diesen Patienten Subgruppenanalysen großer Interventionsstudien zumeist einen mindestens ähnlich großen prognostischen Benefit wie bei HFrEF-Patienten mit normaler Nierenfunktion aufzeigen. Bei Patienten mit fortgeschritten CKD (CKD G 4–5) ist die Evidenzbasis deutlich geringer (Abb. 5). Dies sollte nicht Anlass zum Neglect geben, sondern eine enge und kollegiale Zusammenarbeit von Kardiologen und Nephrologen stimulieren.
Abb. 5: Therapie der HFrEF bei Patienten mit schwergradiger CKD (CKD G 4–5) gemäß Scientific Statement der American Heart Association. Grün: hohe Evidenz für prognostischen Benefit; gelb: moderate bis schwache Evidenz für prognostischen Benefit; weiß: keine Evidenz für prognostischen Benefit.
PD Dr. med. Kyrill Rogacev, Innere Medizin II – Kardiologie Sana Hanse-Klinikum, Wismar Störtebekerstraße 6, 23966 Wismar, E-Mail: kyrill.rogacev@sana.de
Die Literaturhinweise finden Sie in der PDF-Version der aktuellen Ausgabe auf unserer Website.
1 Agaplesion Markus Krankenhaus Medizinische Klinik II, Frankfurt am Main | 2 Universität des Saarlandes, Saarbrücken/Homburg | 3 Kuratorium für Heimdialyse, Neu-Isenburg | 4 Sana-Hanse Klinikum, Wismar