VNR: 2760602020170650003
Prof. Dr. med. Elisabeth Märker-Hermann, Dr. med. Christian von Kiel
Einleitung
Die physiologische Alterung des menschlichen Immunsystems wird durch zwei wesentliche Prozesse bestimmt, die sich gegenseitig beeinflussen. Der Prozess der „Immunoseneszenz“ beschreibt die abnehmende funktionelle Kapazität des angeborenen und insbesondere des erworbenen, adaptiven Immunsystems. Folgen sind die gesteigerte Empfänglichkeit für Infektionserkrankungen, eine reduzierte Impfantwort und eine erhöhte Suszeptibilität für Malignome.
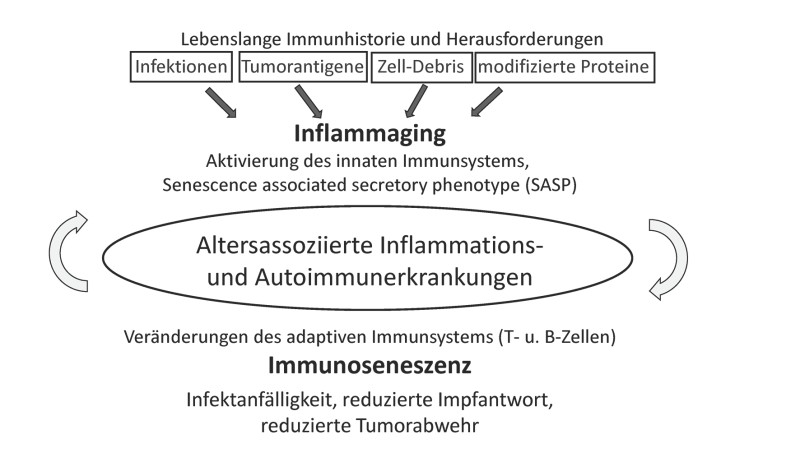
Der zweite, parallel ablaufende Prozess des „Inflammaging“ („Inflamm-Aging“) läuft in Form einer low-grade Inflammation ab, also einer unterschwelligen chronischen Entzündung. Inflammaging führt zu einer gesteigerten Inzidenz altersassoziierter Entzündungs- und Autoimmunerkrankungen (Abb. 1).
Abb. 1: Inflammaging und Immunoseneszenz
In den vergangenen Jahren hat man die zelluläre und molekularer Basis sowie die genetischen und epigenetischen Veränderungen des Immunsystems während des Alterungsprozesses besser verstanden. Die vermehrte Infektneigung im Alter wird verstärkt durch Komorbiditäten wie Diabetes mellitus, COPD und Niereninsuffizienz.
Immunoseneszenz
Änderungen der funktionellen T- und B-Lymphozytenantworten und anderer Immunzellen
Altersabhängig kommt es zu quantitativen Verschiebungen innerhalb der T-Zell-Subpopulationen und der B-Zellen bzw. langlebigen Plasmazellen, zudem zu Veränderungen der funktionellen Kapazität des adaptiven Immunsystems. Bereits seit längerem weiß man, dass naive T-Zellen (CD28intCCR7hiCD95loCD45RA ) mit zunehmendem Alter in ihrer absoluten Zahl sowohl im peripheren Blut als auch in den sekundären lymphatischen Organen abnehmen [2].
Solche naiven T-Zellen, die bisher noch nicht aktiviert wurden, werden für spezifische Immunantworten gegen bislang unbekannte Erreger benötigt. Sie binden über ihren T-Zell-Rezeptor fremde Antigene mit hoher Affinität, was zur Stimulierung und Vermehrung der T-Zellen und der Einleitung einer spezifischen Immunantwort führt. T-Zellen mit einem CD8 Gedächtnis-Phänotyp („Virtual Memory T Cells“) werden trotz fehlendem vorherigen Antigenkontakt hingegen im Alter vermehrt nachgewiesen.
Die Reaktionsfähigkeit der B-Lymphozyten ist im Alter ebenfalls vermindert. Ältere B-Lymphozyten können einen Defekt in der Induktion eines wichtigen Transkriptionsfaktors (E47) aufweisen mit der Folge, dass der Immunglobulin-Klassenwechsel der gebildeten Antikörper von IgM zu IgG gestört ist. Die Antikörper-Avidität, das heißt die Summe aller Affinitäten zwischen Antikörper und Antigen, ist reduziert – vgl. Übersicht bei [3].
Eine Folge dieser Veränderungen ist u. a. eine gestörte oder verzögerte spezifische Immunreaktion gegen bis dato unbekannte Mikroorganismen (Viren, Bakterien, Pilze) oder Tumorantigene. Die wichtigsten Veränderungen des Immunsystems im Alter zeigt zusammengefasst Tabelle 1.
Tab. 1: Quantitative und qualitative Veränderungen verschiedener Immunzellen in der Immunoseneszenz [3, 4] | |
Zelltyp | Altersabhängige Veränderung |
T-Lymphozyten | • Reduzierte Zahl naiver T-Lymphozyten • T-Lymphozyten mit Memory-Phänotyp • Vermindertes Proliferationsvermögen • Verringerte Signaltransduktion (Herunterregulation des CD28-Rezeptors) • Reduzierte Diversität der T-Effektorzellen • Zellzyklus-Arrest |
B-Lymphozyten und langlebige Plasmazellen | • Geringere Bildung von Immunglobulinen (Ig), namentlich Antigen-spezifischem IgG • Reduzierte Antikörper-Avidität • Defekt in der Differenzierung langlebiger Plasmazellen |
Makrophagen | • Geringere phagozytische Aktivität • Gestörte Toll-like-Rezeptor-Expression |
Dendritische Zellen | • Reduzierte Zahl dendritischer Zellen • Verminderte Fähigkeit zur Interleukin (IL)-12-Bildung • Verminderte Antigen-Präsentation |
NK-Zellen | • Niedrigere zytotoxische Aktivität |
Suszeptibilität für Infektionskrankheiten
Im höheren Lebensalter ist das Immunsystem häufig nicht in der Lage, effiziente Immunantworten gegen neue, unbekannte Erreger bzw. Virusstämme (z. B. Influenza A) aufzubauen. Hingegen können latente chronische Virusinfektionen wie durch das Cytomegalievirus (CMV) oder Epstein-Barr-Virus (EBV) ihrerseits tiefgreifende Effekte auf das Immunsystem haben. Persistierende CMV-Infektionen führen zu Veränderungen des adaptiven Immunsystems, namentlich zu einer sogenannten Memory-Inflation mit einer über die Zeit zunehmenden Vermehrung CMV-spezifischer CD8 Memory-T-Lymphozyten [5]. In älteren Individuen kann bis zu 50 % des gesamten CD8 , weniger ausgeprägt auch des CD4 Gedächtnis-Repertoires des peripheren Bluts aus CMV-spezifischen T-Zellen bestehen [6].
Die Vulnerabilität des alternden Immunsystems gegenüber Virusinfektionen zeigt sich derzeit eindrucksvoll in der Covid-19-Pandemie. Es besteht bei Covid-19 eine signifikante Altersabhängigkeit für den Schweregrad der Infektion und bezüglich des Risikos, an der Erkrankung zu sterben. In Italien lag bis Mitte März 2020 das mediane Lebensalter der an SARS-CoV-2 infizierten und verstorbenen Patienten bei 80 Jahren und das mittlere Alter der Patienten, die eine intensivmedizinische Betreuung benötigten, bei 67 Jahren [7]. Zudem ist die Covid-19-Morbidität und -Letalität abhängig von der Präsenz schwerwiegender Komorbiditäten wie chronisch obstruktiver Lungenerkrankung (COPD) und ischämischer Herzerkrankung.
Inflammaging (Inflamm-Aging)
Veränderungen löslicher immunologischer Mediatoren
Der Verlust des „Feintunings“ einer zielgerichteten und zugleich selbstprotektiven, den eigenen Organismus schützenden Immunantwort geht im höheren Alter mit dem Status einer chronisch schwelenden Entzündungsreaktion (Inflammation) einher [8]. Dieses Phänomen wird als Inflammaging bezeichnet, ein Begriff, der von dem italienischen Immunologen Claudio Franceschi von der Universität Bologna geprägt wurde. Im Rahmen des physiologischen Alterungsprozesses kommt es zur gesteigerten Freisetzung entzündungsfördernder Botenstoffe wie Interleukin (IL)-6, Tumor-Nekrose-Faktor (TNF)-α und IL-1ß sowie Prostaglandin E; im Serum lässt sich häufig ein dauerhaft erhöhtes C-reaktives Protein nachweisen. Als Quelle der proinflammatorischen Zytokine werden das im Alter relativ vermehrte oder veränderte Fettgewebe, eine Translokation von Bakterien über die durchlässigere Darmbarriere und eine Akkumulation nicht-lymphoider Zellen diskutiert, die zusammengefasst den sogenannten Seneszenz-assoziierten sekretorischen Phänotyp (SASP) repräsentieren – vgl. Übersicht bei [3].
Eine weitere Folge löslicher immunologischer Faktoren, welche typischerweise den alternden Organismus betrifft, ist die Organfibrose, vermittelt durch TGF-ß und IL-13 [9]. Im Vergleich zu altersabhängigen entzündlichen Vorgängen ist der Aspekt der Fibrogenese (Ablagerung verdickter und vermehrter Kollagenbündel in Geweben, Proliferation und Aktivierung von Myofibroblasten) bisher weniger gut untersucht.
Vermehrtes Auftreten chronischer Autoimmunerkrankungen
In Verbindung mit dem Inflammaging werden typische Alterskrankheiten festgestellt: Alzheimer-Demenz, Osteoporose, Arteriosklerose, Arthritis und Diabetes mellitus [10]. Phänomene des Inflamm- aging sind in der Rheumatologie bei der rheumatoiden Arthritis (RA) und der Arteriitis temporalis/Riesenzellarteriitis genauer untersucht worden. Der proinflammatorische Zytokin- und Chemokinstatus bei RA-Patienten – auch jüngeren RA-Patienten – kann bereits Monate vor den ersten klinischen Symptomen messbar verändert sein und dem alternden Immunsystem (Inflammaging) ähneln [11, 12].
Die Alterung des Immunsystems und das Remodelling der Blutgefäßwand im Alter sind typische Risikofaktoren für die Entwicklung einer Riesenzellarteriitis [13]. Zu den Autoimmunerkrankungen mit gehäufter Erstmanifestation jenseits des 60. Lebensjahrs gehören neben der Riesenzellarteriitis auch die Antineutrophile cytoplasmatische Antikörper (ANCA)-assoziierten Vaskulitiden mit und ohne Nierenbefall, welche wiederum mit zunehmendem Alter eine schlechtere Prognose haben.
So weist die ANCA-assoziierte Granulomatose mit Polyangiitis (ehemals M. Wegener genannt) in Europa einen Erstmanifestationsgipfel zwischen dem 65. und 74. Lebensjahr auf. Patienten mit ANCA-assoziierten Vaskulitiden mit Manifestation im höheren Lebensalter und solche mit Nierenfunktionseinschränkung versterben signifikant häufiger an Infektionen als jüngere Patienten [14, 15].
Zusätzliche immunologische Marker für ein erhöhtes Infektionsrisiko bei Vaskulitispatienten sind ein erniedrigtes Serum-IgG, erniedrigte B-Lymphozyten und CD4 T-Lymphozyten sowie eine abgeschwächte Impfantwort – dies entspricht den typischen Surrogatmarkern der Immunoseneszenz.
Immunsuppressive Therapie im höheren Lebensalter
Immunsuppressive Therapie der systemischen Vaskulitiden
Systemische Vaskulitiden müssen in der Regel bei Patienten aller Altersgruppen immunsuppressiv behandelt werden, wobei die Therapien hochdosierte Kortiko-steroide, Methotrexat, Azathioprin, Cyclophosphamid, Rituximab oder im Falle der Riesenzellarteriitis IL-6-Rezeptor-Antikörper (IL-6R-AK Tocilizumab) beinhalten können. Die Prognose und Letalität der systemischen Vaskulitiden hängt vom Lebensalter bei Erstmanifestation der Vaskulitis und vom Auftreten Infekt-bedingter Komplikationen während der ersten sechs Monate der immunsuppressiven Therapie ab.
Das Risiko schwerwiegender Infektionen ist in der Induktionstherapie der ANCA-assoziierten Vaskulitis beim Einsatz von Rituximab ähnlich hoch wie bei Cyclophosphamid [16], hängt aber in beiden Fällen entscheidend von der Dosis und der Dauer der regelhaft damit kombinierten Steroidtherapie ab. In der Erhaltungstherapie der Vaskulitiden wird häufig Aza-thioprin oder low-dose Methotrexat eingesetzt. Letzteres sollte bei einer glomerulären Filtrationsrate (GFR) < 30 ml/min gar nicht und bei einer GRF zwischen 30 und 60 ml/min, wie sie bei älteren Patienten häufiger festzustellen ist, nur in halbierter Regeldosis unter engmaschiger Kontrolle der Nierenfunktion gegeben werden [17].
Eine Besonderheit der Therapie mit dem IL-6R-AK-Tocilizumab ist eine erhöhte Inzidenz komplizierter Divertikulitiden mit der Gefahr der Darmperforation [18]. Des Weiteren hemmt Tocilizumab die Bildung von CRP, so dass letzteres als Marker einer möglichen Infektion nicht verwertbar ist. Procalcitonin als Sepsismarker wird hingegen durch Tocilizumab nicht beeinflusst.
Leider existieren noch keine durch Studien belegte Empfehlungen zur individualisierten immunsuppressiven Therapie der Vaskulitiden oder anderer rheumatischer Systemerkrankungen im Alter. Aus Registerdaten und Fallsammlungen lassen sich aber folgende Schlussfolgerungen ziehen:
- a) Eine Dosisreduktion von Rituximab kann zu einer Halbierung der Inzidenz schwerer Infektionen führen.
- b) Cyclophosphamid sollte bei über 60-Jährigen um 25 % und um 50 % bei über 70-Jährigen reduziert werden.
- c) Eine konsequente Prophylaxe mit Cotrimoxazol (zum Beispiel Einnahme von 960 mg Cotrimoxazol an drei Tagen pro Woche) unter Therapie mit Cyclophosphamid oder Rituximab, bei Lymphopenie und – als relativ neue Erkenntnis – auch bei einer Prednisolon-therapie mit > 30mg täglich über > vier Wochen [19] kann nicht nur Pneumocystis jirovecii-Pneumonien (PJP) vorbeugen, sondern reduziert auch anderweitige Infektionen wie Harnwegs- und bronchopulmonale Infektionen unter immunsuppressiver Therapie [20].
- d) Während die Cotrim-Behandlung bei gleichzeitigem Vorliegen einer systemischen Vaskulitis und Therapie mit Cyclophosphamid als gesichert gelten kann, besteht bei anderen Konstellationen nach wie vor große Unsicherheit, da es schwierig ist, den Nutzen der Therapie gegenüber den zu erwartenden Nebenwirkungen abzuschätzen. Es gibt zu diesem Punkt keine Leitlinien oder kontrollierte Studien, lediglich Expertenmeinungen. Zunächst erscheint es sinnvoll, weitere individuelle Risikofaktoren wie das Vorliegen einer schweren Lymphophenie oder ein hohes Lebensalter in die Überlegungen mit einzubeziehen [20].
Immunsuppressive Therapie bei älteren Patienten mit Nierentransplantation
Das Alter, in dem Patienten nierentransplantiert werden, ist in den vergangenen 20 bis 25 Jahren gestiegen. 60 % der Transplantierten sind inzwischen ≥ 60 Jahre alt; in den Jahren 1998–2011 kam es zu einer Verdreifachung der Zahl der Transplantationen pro Jahr bei Patienten jenseits des 65. Lebensjahrs [21].
Eine große Zahl von Studien konnte nachweisen, dass eine Nierentransplantation die Langzeitmortalität gegenüber Patienten auf der Warteliste für eine Transplantation reduziert, und dies gilt auch für ältere Patienten. Diese Studien zeigten aber auch, dass insbesondere in den ersten Monaten nach der Nierentransplantation ältere Patienten ein höheres Mortalitätsrisiko haben, mehr Infekt-bedingte Komplikationen erleiden, allerdings tendenziell weniger akute Abstoßungsreaktionen aufweisen als junge Transplantatempfänger [22, 23].
In einer jüngst veröffentlichten nordwest-französischen Studie an 171 Patienten > 70 Jahren, die zwischen Januar 2000 und Dezember 2014 eine Nierentransplantation erhalten hatten, zeigte sich, dass ein Jahr nach erfolgter Transplantation 17 Patienten (9,9 %) verstorben waren, und zwar in erster Linie an Infektionen (58,5 %) oder kardiovaskulären Erkrankungen (29,4 %) [24]. Die Autorinnen und Autoren schließen daraus, dass bei Nierentransplantatempfängern > 70 Jahren eine kardiologische Evaluation und eine Optimierung der immunsuppressiven Therapie entscheidend sei, um das Überleben der Patientin bzw. des Patienten und des Transplantats in der Frühphase nach Transplantation zu verbessern.
Zunehmend werden geriatrische Untersuchungsmethoden auch in der Transplantationsmedizin eingesetzt, da insbesondere Frailty, also Gebrechlichkeit, ein unabhängiger Risikofaktor für das Überleben nach Nierentransplantation ist [25].
Die immunologischen Voraussetzungen und das Faktum, dass ältere Patienten häufig von medikamentösen Transplantationsstudien ausgeschlossen werden, macht die Auswahl des idealen und individuell angepassten immunsuppressiven Regimes zur Herausforderung. Zur immunsuppressiven Therapie nach Nierentransplantation existieren Handlungsempfehlungen, die sich allerdings international und je nach Transplantationszentrum unterscheiden können. Sie orientieren sich an einer individuellen Dosierung und Anpassung der Induktions- und Erhaltungstherapie, an Nebenwirkungen und Komplikationen sowie natürlich der aktuellen Studienlage. Auf Details kann in diesem Beitrag nicht eingegangen werden, vielmehr auf allgemeine Prinzipien der Therapieanpassung bei älteren Patienten.
In den europäischen Leitlinien (EBP, European Best Practice Guidelines) wird zu speziellen Problemen bei älteren Transplantatempfängern ausgeführt, dass die Immunsuppression „mit Augenmaß“ eingesetzt werden sollte, um einerseits Abstoßungen zu verhindern, andererseits aber Nebenwirkungen gering zu halten, die im höheren Lebensalter häufig ausgeprägter sind [25, 26]. Es gibt Zentren, welche bei älteren Patienten bereits die Induktionstherapie mit geringerer Intensität starten, das heißt ohne Kaninchen-Antithymozyten-Globulin (rATG) oder anti-IL2-AK.
Prinzipiell kommen wie bei jüngeren Nierentransplantierten in der immunsuppressiven Kombinationstherapie Kortikosteroide, ein Antimetabolit (Azathioprin oder Mycophenolatmofetil) und ein Calcineurin-Inhibitor (Ciclosporin A oder Tacrolimus) zum Einsatz.
Hinsichtlich der Cortisonreduktion in der Erhaltungstherapie gibt es keine einheitliche Empfehlung. In der Praxis ist es wichtig, beim Einsatz von Ciclosporin A bei älteren Patienten besonders wachsam im Hinblick auf potenzielle Medikamenteninteraktionen zu sein. Ciclosporin A ist ein Substrat sowohl von Cytochrome P450 (CYP)3A als auch von P-Glycoprotein, welche pharmakokinetisch beide an der Elimination häufig verschriebener Medikamente beteiligt sind [27].
Im Falle unerwünschter Wirkungen wie Leukopenie, Thrombopenie, Infektionen oder Malignomen wird häufiger als bei jungen Transplantierten in der Erhaltungstherapie eine Komponente der kombinierten Immunsuppression, meistens der Antimetabolit, herausgenommen [28]. Leitlinien-basierte konkrete Empfehlungen zur Induktions- und Erhaltungstherapie sowie zur Deeskalation der Immunsuppression bei älteren Nierentransplantatempfängern liegen jedoch nicht vor.
Zusammenfassung
Mit der physiologischen Alterung des Immunsystems vermindert sich die Immunkompetenz, das heißt die Fähigkeit, sich mit Erregern und Malignomen auseinanderzusetzen, was sich in typischen Veränderungen der quantitativen Zusammensetzung der Zellen des Immunsystems und der funktionellen Kapazität widerspiegelt (Immunoseneszenz). Diese Prozesse gehen einher mit einem Status der chronischen Entzündung mit vermehrter Sekretion pro-inflammatorischer löslicher Botenstoffe (Inflammaging) und dem Auftreten chronisch-entzündlicher und autoimmuner Erkrankungen.
Bei bereits alteriertem Immunsystem, vermehrter Anfälligkeit für Infektionen und reduzierter Impfantwort sind ältere Patienten mit rheumatischen Erkrankungen, insbesondere systemischen Vaskulitiden, einem erhöhten Risiko unter immunsuppressiver Therapie ausgesetzt.
Gleiches gilt für ältere Nierentransplantatempfänger. Leitlinien-basierte Empfehlungen zur immunsuppressiven Therapie im Alter existieren weder für Autoimmunerkrankungen noch für Nierentransplantatempfänger. Hier gilt es, individuell und unter Berücksichtigung der Risikofaktoren die Immunsuppressiva einschließlich Cortison so niedrig wie möglich zu dosieren und engmaschig zu überwachen, um die Gefahr bedrohlicher Infektionen zu minimieren.
Dr. med. Christian von Kiell, beide: Klinik Innere Medizin IV, (Rheumatologie, Klinische Immunologie und Nephrologie) der Helios Dr. Horst Schmidt Kliniken Wiesbaden
Die CME-Fragen und Literaturhinweise finden Sie in der PDF-Version der aktuellen Ausgabe auf unserer Website.