VNR: 2760602020169570006
Prof. (apl.) Dr. med. Claudia Sommerer
Einleitung
Die IgA-Nephropathie ist die häufigste Glomerulonephritisform in Deutschland und wird häufig als Zufallsbefund diagnostiziert. Die klinischen Verläufe sind sehr variabel und reichen von einer Mikrohämaturie ohne sonstige Einschränkungen bis zum terminalen Nierenversagen. Selten zeigt sich ein rapid-progressiver Verlauf mit raschem Eintritt einer terminalen Niereninsuffizienz und Notwendigkeit einer Nierenersatztherapie. Der Behandlungsschwerpunkt liegt auf supportiver Therapie mit optimaler Blutdruckregulation mittels ACE-Hemmer oder Angiotensin-Rezeptorblocker zur Reduktion des intraglomerulären Drucks und damit der Proteinurie. Bei unzureichendem Ansprechen können Glukokortikoide eingesetzt werden.
Diagnostik
Die IgA-Nephropathie ist weltweit die häufigste Ursache einer Glomerulonephritis mit geographischer Variabilität hinsichtlich der Prävalenz. Typischerweise wird ein junger Mann aus Asien mit einer Makrohämaturie im Rahmen eines Infektes als Beispiel für eine IgA-Nephropathie herangezogen. Tatsächlich umfasst in asiatischen Ländern die IgA-Nephropathie etwa 40 % aller Glomerulonephritiden. Im Vergleich hierzu liegt die Prävalenz in Europa und Nordamerika bei 10 bis 20 % aller Glomerulonephritiden, aus einzelnen afrikanischen Ländern ist eine Prävalenz von 5 % bekannt. Die IgA-Nephropathie tritt zweimal häufiger bei Männern im Vergleich zu Frauen auf. Der Erkrankungsgipfel liegt im jüngeren Erwachsenenalter.
Meist wird ein Verdacht auf eine IgA-Nephropathie bei der Abklärung einer arteriellen Hypertonie oder bei Routineuntersuchungen geäußert. Vor einigen Jahren war die Musterung der Bundeswehr häufig der Ausgangspunkt zur weitergehenden Untersuchung bei Vorliegen einer Mikrohämaturie oder Proteinurie. Somit kommt den hausärztlich tätigen Kollegen eine wichtige Rolle in der Diagnose der IgA-Nephropathie zu. In der klinischen Untersuchung zeigt sich eine Mikrohämaturie im Urinstatus. Bei Auftreten einer Hämaturie sollte immer ein Urinsediment erstellt werden, um den Ursprung der Hämaturie eingrenzen zu können. Einen Hinweis auf eine glomeruläre Hämaturie geben dysmorphe Erythrozyten (Akanthozyten) im Urinsediment. Häufig liegt eine milde bis moderate Proteinurie (0,5 bis 2g/Tag) vor, sodass zunächst orientierend Eiweiß im Spontan-urin bestimmt wird, gefolgt von einer Quantifizierung mittels 24h-Sammelurin. Ein weiteres Symptom ist die arterielle Hypertonie, die vor allem bei fortgeschrittener Erkrankung regelhaft vorliegt. Die Nierenfunktion ist erst im späteren Erkrankungsstadium oder bei rasch progredientem Verlauf beeinträchtigt. Makrohämaturie-Episoden treten bei 40 bis 50 % der Patienten auf und sind fast immer mit einer Infektion der oberen Luftwege assoziiert (gleichzeitig oder wenige Tage später). Die finale Diagnose kann nur histologisch gestellt werden, da der Nachweis von IgA-Ablagerungen im glomerulären Mesangium wegweisend ist.
Klinischer Verlauf
Die klinischen Verläufe einer IgA-Nephropathie sind heterogen und reichen von einem oligosymptomatischen Krankheitsbild bis zur Entwicklung einer rapid-progressiven Glomerulonephritis mit Eintreten einer terminalen Niereninsuffizienz. Patienten, die lediglich eine Mikrohämaturie und/oder eine minimale Proteinurie, jedoch eine normale Nierenfunktion aufweisen (etwa 70 % der Patienten), zeigen meist langfristig – häufig über Jahrzehnte – einen stabilen Verlauf. Eine Spontanremission kann in bis zu 20 bis 30 % der Fälle eintreten, 15 bis 30 % der Patienten erleiden eine chronisch fortschreitende Nierenfunktionseinschränkung. In bis zu 50 % der betroffenen Patienten kann eine langsame Progression bis zur terminalen Niereninsuffizienz im Verlauf über 20 bis 25 Jahre beobachtet werden. Jährliche nephrologische Verlaufsuntersuchungen werden auch bei stabilen Patienten empfohlen, da auch nach Jahren aus einer benigne verlaufenden IgA-Nephropathie sich eine Progression zur chronischen Niereninsuffizienz entwickeln kann [1].
Gelegentlich tritt die IgA-Nephropathie im Rahmen einer Schönlein-Henoch-Purpura auf, die neben mesangialen IgA-Ablagerungen vaskulitische intestinale Läsionen mit folgenden abdominellen Beschwerden sowie Arthralgien und Purpura insbesondere im Bereich der Unterschenkel umfasst. Die Purpura Schönlein-Henoch ist ein typisches Krankheitsbild in der Adoleszenz und im Erwachsenenalter selten.
Bei Vorliegen eines nephrotischen Syndroms (bis 10 %) ist das Risiko einer venösen Thrombose deutlich erhöht. Diese kann sich als Nierenvenenthrombose manifestieren.
Zahlreiche weitere Erkrankungen können mit einer IgA-Nephropathie assoziiert sein (siehe Tabelle 1).
Tab. 1: Erkrankungen, die häufig mit einer IgA-Nephropathie assoziiert sein können. |
· Alkoholische Lebererkrankung, Leberzirrhose, Zöliakie, Colitis ulcerosa, (Morbus Crohn) |
· Monoklonale IgA-Gammopathie, Mycosis fungoides |
· Rheumatoide Arthritis, Morbus Bechterew, Reiter-Syndrom, Takayasu-Arteriitis, Myasthenia gravis |
· Sarkoidose |
· Dermatitis herpetiformis |
· Hepatitis B, HIV |
Pathophysiologie
Pathophysiologisch wurde lange Zeit die autoimmune Genese der Erkrankung diskutiert. Allerdings ist der Anteil der Autoimmunität bis heute noch nicht eindeutig geklärt. Etwa 50 % der Patienten mit IgA-Nephropathie zeigen erhöhte Plasma-IgA-Spiegel, wobei die monomere Form den Hauptanteil des IgAs im Serum bildet [2]. Entscheidend für die Pathogenese ist jedoch das in mesangialen Ablagerungen nachgewiesene polymere IgA [3]. Eine wichtige physiologische Funktion des IgA-Moleküls besteht in der Abwehr inhalativ oder oral aufgenommener Antigene. Eine gestörte mukosale Barriere kann zur Migration von Plasmazellen aus der Mukosa in das Knochenmark führen und die Freisetzung von galaktosedefizienten polymeren IgA (GD-IgA1) induzieren.
Bei der Entstehung der klinisch symptomatischen IgA-Nephropathie wird von einer Multi-Hit-Hypothese ausgegangen, d. h. mehrere Faktoren müssen zusammen kommen, bis die Krankheit apparent wird. Zunächst befinden sich IgA1-Moleküle mit einer Defizienz in der Galaktosylierung (Gd-IgA1) im Blutsystem eines Patienten (Hit 1), die Bildung von Autoantikörpern gegen Gd-IgA1-Moleküle wird induziert (Hit 2). Die zirkulierenden Gd-IgA1-Autoantikörper-Immunkomplexe (Hit 3) lagern sich im glomerulären Mesangium ab (Hit 4), [4]. Die Ablagerung von Autoantikörper-Immunkomplexen aktiviert das Komplementsystem (alternativer Weg und/oder „Mannose-binding-lectin-Pathway“), induziert eine Mesangiumproliferation und Matrixakkumulation [5]. Proinflammatorische Mediatoren werden sezerniert und können sekundär eine Fibrosierung induzieren.
Patienten mit entzündlichen Darmerkrankungen oder Zöliakie sind durch die gestörte Mukosabarriere prädisponiert. Diätetische Maßnahmen können einen positiven Effekt haben [2]. Hinsichtlich der Entstehung der Autoantikörper gegen galaktosedefizientes IgA1 wird ein molekulares Mimikry mit Viren (Virusbestandteilen) diskutiert. Es konnte gezeigt werden, dass Infektionen mit Viren oder gramnegativen Bakterien der Bildung von Autoantikörpern vorausgehen [6].
Interessant ist, dass 40–50 % der direkten Familienmitglieder eines Patienten erhöhte Spiegel an galaktosedefizientem IgA1 aufweisen, jedoch nicht alle das typische klinische Bild einer IgA-Nephropathie ausbilden [4]. Auch die auffallende geografische Variabilität in der Prävalenz weist auf genetische Faktoren hin [7]. Genomweite Assoziationsstudien (GWAS) haben Risikoallele identifiziert und damit Hinweise auf eine genetische Ursache bestärkt [7, 8]. Ein Großteil der Gene kodiert für Proteine, die an der Regulation der mukosalen Immunantwort und Aufrechterhaltung der Mukosabarriere beteiligt sind [9].
Histopathologie
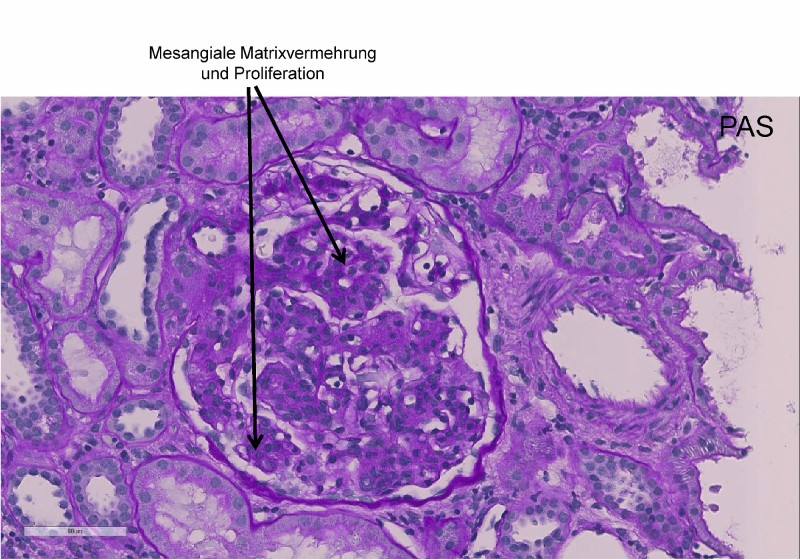
Die Histopathologie kann sehr variabel sein und minimale Veränderungen wie eine leichte mesangiale Expansion bis zur Halbmondbildung umfassen. Häufig wird eine diffuse mesangioprolifative Glomerulonephritis und eine fokal segmentale Glomerulosklerose, in seltenen Fällen eine fokal segmental nekrotisierende und extrakapilär proliferierende Glomerulonephritis detektiert (Abb. 1a).
Histomorphologisch erfolgt die Klassifikation einer IgA-Nephropathie anhand der Oxford-MEST-C-Klassifikation (siehe Tabelle 2). Zur Beurteilung ist die Tripeldiagnostik erforderlich aus licht-, immun- und elektronenmikroskopischer Untersuchung des Biopsiematerials.
Tab. 2: Oxford- MEST-C Klassifikation der IgA-Nephropathie [nach 10] | ||||
Grad 0 | Grad 1 | Grad 2 | ||
M | Mesangiale Hyperzellularität | < 50 % | > 50 % | |
E | Endokapilläre Proliferation | Nein | Ja | |
S | Segmentale Glomerulosklerose | Nein | Ja | |
T | Tubuläre Atrophie/interstitielle Fibrose | 0–25 % | 26–50 % | > 50 % |
C | Glomeruläre Halbmonde („crescent“) | 0 | 1–24 | ≥ 25 |
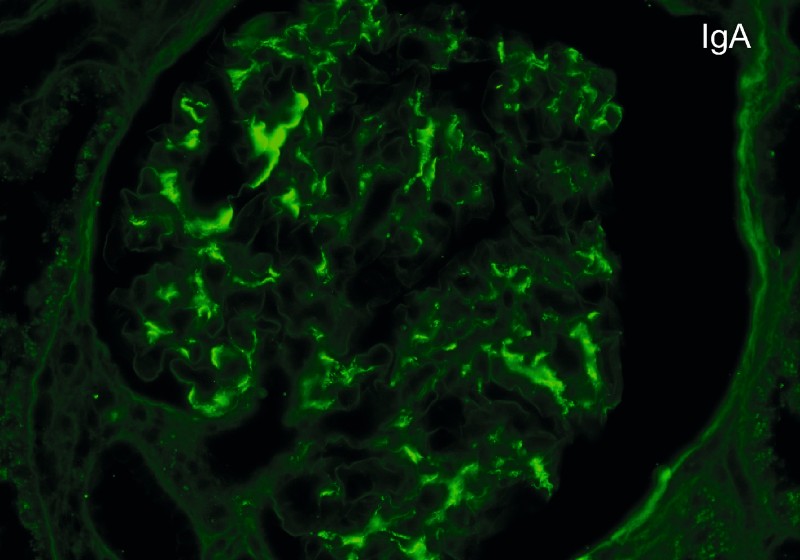
Immunhistologisch finden sich insbesondere mesangiale IgA-Ablagerungen (Abb. 1b), zusätzlich meist eine Komplementfaktor C3-Positivität und weniger richtungsweisend eine Ablagerung von C1q und IgM. In bis zu 70 % der Fälle wird zusätzlich IgG im Glomerulus abgelagert. Nachweis von Fibrin ist ein Hinweis auf segmentale Nekrosen.
Elektronenmikroskopisch lassen sich Immunkomplexe im Bereich der peripheren Basalmembranen nachweisen, die sowohl subepithelial als auch intramembranös oder subendothelial liegen können. Diese scheinen eine eher ungünstige Prognose zu haben.
Progressionsfaktoren
Die Identifikation von Progressionsfaktoren ist für die Abschätzung von Krankheitsverlauf und Therapie unabdingbar. Folgende Risikofaktoren für eine Progredienz der Erkrankung wurden identifiziert (Tabelle 3) männliches Geschlecht, eingeschränkte Nierenfunktion bereits bei Diagnose, arterielle Hypertonie und persistierende Proteinurie > 1,5g/Tag. Weitere modifizierbare Risikofaktoren sind Adipositas, Hyperlipidämie, Hyperurikämie und Nikotinkonsum. Neben klinischen Faktoren werden histopathologische Befunde zur Prognoseabschätzung herangezogen. Histologisch sind entsprechend der Oxford-MEST-C-Klassifikation die fünf Parameter mesangiale Hyperzellularität (M), endokapilläre Proliferation (E), segmentale Glomerulosklerose (S), tubuläre Atrophie/interstitielle Fibrose (T) und glomeruläre Halbmonde (C) mit einer negativen Prognose assoziiert (Tabelle 2) [10]. Serologisch ist die galaktosedefiziente IgA1 O-Glycoform mit einem renalen Risiko assoziiert [11]. Im Weiteren wurden spezifischen Genotypen z. B. des ACE-Gens eine prognostische Bedeutung zugewiesen [12].
Tab. 3: Klinische Progressionsfaktoren für die Entwicklung einer Niereninsuffizienz |
• Proteinurie > 1g/Tag |
• Persistierende Mikrohämaturie |
• Eingeschränkte Nierenfunktion zum Zeitpunkt der Diagnose |
• Männliches Geschlecht |
• Unzureichend regulierte arterielle Hypertonie |
• Adipositas |
• Nikotinkonsum |
• Histopathologische Kriterien, Ausmaß der tubulären Atrophie und interstitiellen Fibrose |
In einer französischen Studie wurde ein 3-Punkte-Score (Proteinurie > 1g/Tag, Hypertonie, fortgeschrittene histologische Veränderungen) zur Prognoseabschätzung entwickelt [13]. Die Vorhersagekraft der histopathologischen Veränderungen wurde in mehreren Studien bestätigt, u.a. auch in der STOP-IgAN-Studie [14], dabei kommt der tubulären Atrophie und interstitiellen Fibrose eine hohe prädiktive Wertigkeit zu.
Derzeit gibt es keinen spezifischen serologischen Marker zur Identifikation einer immunologischen Aktivität, so dass klinische Parameter zum Monitoring der Krankheitsaktivität herangezogen werden. Eine persistierende Mikrohämaturie ist ein Zeichen der immunologischen Aktivität, jedoch nicht unbedingt ein Progressionsmarker. Eine persistierende Proteinurie über 1 g/Tag sowie ein unzureichend regulierter Blutdruck sind wichtige Risikofaktoren hinsichtlich Krankheitsprogression. Allerdings kann eine Zunahme der Proteinausscheidung sowohl mit der Krankheitsaktivität als auch sekundär durch eine schwere glomeruläre Schädigung durch einen nicht-immunologischen Prozess bedingt sein.
Differenzialdiagnose
Bei Vorliegen der klinischen Trias Mikrohämaturie, milde Proteinurie und Hypertonie sind zahlreiche Differentialdiagnosen zu überdenken. Auch bei bioptisch gesicherten IgA-Ablagerungen im Mesangium können differierende Erkrankungsentitäten vorliegen, z. B. Purpura Schönlein-Henoch, Lupusnephritis, monoklonale IgA-Gammopathie. Eine variable Breite der Basalmembran kann an eine hereditäre Nephritis vom Typ Alport-Syndrom erinnern. Eine Mikrohämaturie und milde Proteinurie kann beim Syndrom der dünnen Basalmembran auftreten.
Die Diagnose muss daher immer in der Zusammenschau von klinischen Befunden und der Histologie getroffen werden.
Therapeutische Ansätze
Zielparameter sind eine optimale Blutdruckregulation und eine Reduktion der Proteinurie. Einen hohen Stellenwert haben supportive Maßnahmen mit unspezifischen Therapieansätzen, die dem Verlust der glomerulösen Filtrationsrate entgegenwirken. Durch den konsequenten Einsatz der supportiven Maßnahmen konnte der GFR-Verlust bei Patienten mit IgA-Nephropathie in der STOP-IgAN-Studie auf 1,5 ml/min pro Jahr reduziert werden (zur Verdeutlichung: Der GFR-Verlust von über 40-Jährigen liegt bei etwa 1 ml/min pro Jahr, [15, 16]).
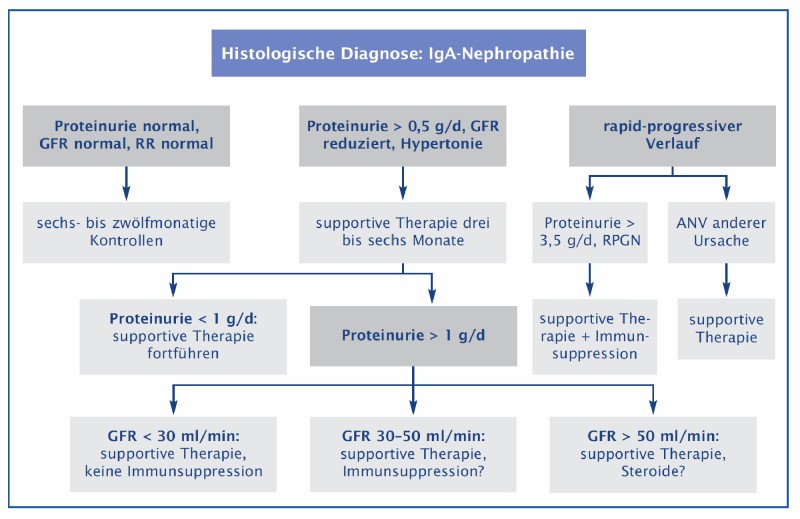
Anhand der klinischen Symptome können die Patienten in Behandlungskategorien eingeteilt werden (Abbildung 2). Patienten mit einer isolierten Mikrohämaturie, minimaler Proteinurie und normaler glomerulärer Filtrationsrate sollten regelmäßig in 6- bis 12-monatigen Abständen hinsichtlich Entwicklung einer Proteinurie/Albuminurie, Nierenfunktion und Blutdruck untersucht werden. Bei Patienten mit einer persistierenden Proteinurie > 500 mg/Tag sollten supportive Therapiemaßnahmen angewendet werden. Patienten mit einem schweren Verlauf (Proteinurie im nephrotischen Bereich, eingeschränkte Nierenfunktion, aktive histologische Veränderungen) können möglicherweise von einer immunsuppressiven Therapie profitieren.
Supportive Therapiemaßnahmen
Lifestyle-Modifikation
Die folgenden supportiven Maßnahmen sollten vor Beginn einer immunsuppressiven Therapie ausgeschöpft werden (Tabelle 4). Lifestyle-Modifikation ist hierbei ein wichtiges Standbein in der supportiven Therapie bei Vorliegen einer Glomerulonephritis im Allgemeinen.
Tab. 4: Supportive Maßnahmen zur Therapie der IgA-Nephropathie |
• Antihypertensive Therapie mit einem Zielblutdruck von < 125/75 mmHg |
• Zielproteinurie <0,5g/Tag |
• Einsatz von ACE-Hemmern und Angiotensin-Rezeptor-Blockern, Vermeiden von Calciumantagonisten vom Dihydropyridin-Typ |
• Statine bei Hyperlipidämie oder metabolischem Syndrom |
• Reduzierte Kochsalzzufuhr (optimal < 6g/Tag) |
• Reduzierte/mäßige Proteinzufuhr (etwa 0,8 g/kg Körpergewicht) |
• Beenden des Nikotinkonsums |
• Vermeiden von Nephrotoxinen inklusive nichtsteroidaler Antiphlogistika |
• Ausdauersport |
• Gegebenenfalls Gewichtsreduktion |
Adipositas ist ein bekannter Risikofaktor für einen progredienten Verlauf einer IgA- Nephropathie, ebenso aggraviert Rauchen die Entwicklung einer Nierenfunktionseinschränkung und erhöht bei IgA-Nephropathie das Risiko für ein terminales Nierenversagen um den Faktor 10 [17]. Pathophysiologisch scheint dies durch einen Anstieg des zentralen Blutdrucks verursacht zu werden. Entsprechend werden neben diätetischen Maßnahmen Beenden eines Nikotinkonsums, Reduktion des Körpergewichts und Ausdauersport empfohlen.
Hinsichtlich der Trinkmenge liegt die Empfehlung bei Vorliegen einer adäquaten Diurese bei etwa 1,5 bis 2 Liter pro Tag. Eine Erhöhung der Trinkmenge hat keinen zusätzlichen positiven Effekt [18], sondern kann bei nephrotischen Patienten negative Auswirkung hinsichtlich Entwicklung einer Überwässerung zur Folge haben.
Eine optimale Blutdruckkontrolle ist unabdingbar, hierzu werden vornehmlich Inhibitoren des Renin-Angiotensin-Systems (RAS) eingesetzt (siehe unten). Die Salzaufnahme sollte unter 10 g pro Tag liegen (optimal < 6 g/Tag). Der Effekt einer RAS-Blockade kann durch eine hohe Salzzufuhr aufgehoben werden, sodass auf eine Salzrestriktion geachtet werden sollte. Es sollten möglichst keine Calcium-Antagonisten vom Dihydropyridintyp (Amlodipin, Nitrendipin etc.), insbesondere wenn kein ACE-Hemmer oder Angiotensin-Rezeptor-Blocker eingenommen wird, eingesetzt werden, da diese über eine präglomeruläre Vasodilatation einen intraglomerulären Druckanstieg verursachen können.
Die Eiweißzufuhr sollte bei etwa 0,8 g/kg/Tag liegen. Eine eiweißreiche Ernährung oder Eiweißshakes im Rahmen von Muskelaufbau-Training erhöhen den extrazellulären Wassergehalt im Körper und den Filtrationsdruck in den Glomeruli und sollten bei IgA-Nephropathie auf keinen Fall eingenommen werden. Vor einer zu starken Proteinrestriktion insbesondere bei fortgeschrittener Niereninsuffizienz wird aufgrund der Gefahr der Malnutrition gewarnt.
Renin-Angiotensin-Aldosteron-Blockade
Eine Inhibition des Angiotensins mittels ACE-Hemmer oder Angiotensin-Rezeptorblockade beeinflusst die Progression proteinurischer Nierenerkrankungen positiv. Dies wird einerseits durch eine Reduktion des systolischen Blutdrucks und andererseits durch eine Reduktion des intraglomerulären Drucks erreicht [19]. Bei Vorliegen einer signifikanten Proteinurie wird eine RAS-Blockade auch bei normotensiven Patienten empfohlen. Ein langsames Eintritieren eines RAS-Blockers kann mögliche orthostatische Probleme reduzieren.
Von einer Kombinationstherapie mit ACE-Hemmer und Angiotensin-Rezeptor-Blocker wird abgeraten. In Studien mit einem kurzen Beobachtungszeitraum konnte zwar ein zusätzlicher antiproteinurischer Effekt beobachtet werden, jedoch zeigte die ONTARGET-Studie, dass eine Kombinationstherapie mit vitalbedrohlichen Nebenwirkungen (z. B. Hyperkaliämie, Verschlechterung der Nierenfunktion) assoziiert sein kann [20].
Omega-3-Fettsäuren
Omega-3-Fettsäuren (Fischöl) werden anti-inflammatorische Eigenschaften zugeschrieben. Eine Cochrane-Meta-Analyse konnte keine eindeutig positiven Effekte auf die Nierenfunktion oder Proteinurie nachweisen [19].
Antikoagulation
Bei Vorliegen eines nephrotischen Syndroms (Proteinurie > 3g/Tag) ist das Risiko einer Thrombose erhöht. Eine Ursache liegt in dem erhöhten Antithrombin III-Verlust. Ab einem Serum-Albumin von unter 20 g/l sollte mit einer Antikoagulation begonnen werden. Meist muss niedermolekulares Heparin (off-label use) oder Phenprocoumon eingesetzt werden, da die neuen oralen Antikoagulanzien ab einer GFR < 50 ml/min deutlich in der Dosis reduziert werden müssen und die meisten Substanzen ab einer Kreatinin-Clearance < 30 ml/min kontraindiziert sind.
Immunsuppressive Therapie
Die Rolle der antiinflammatorischen und immunsuppressiven Therapie bei IgA-Glomerulonephritis ist weiterhin unklar [21]. Die publizierten Studien sind überwiegend klein und mit kurzem Beobachtungsintervall. Bei Patienten mit einem stabilen oder langsam progressiven Verlauf sollten vor Beginn einer immunsuppressiven Therapie zunächst eine optimale Blutdruckregulation und eine ausreichende RAS-Blockade durchgeführt werden. Erst wenn die supportiven Therapiemaßnahmen ausgereizt sind und weiterhin eine höhergradige Proteinurie persistiert (> 1g/Tag) oder eine progrediente Nierenfunktionsverschlechterung zu beobachten ist, sollte mit einer systemischen Immunsuppression begonnen werden. Mögliche Wirkungen und Nebenwirkungen einer immunsuppressiven Therapie müssen abgewogen werden. Falls immunsuppressive therapeutische Maßnahmen ergriffen werden, sollte diese Therapie durch eine Nephrologin/einen Nephrologen gesteuert werden.
Glukokortikoide
Eine systemische Steroidtherapie ist der bisher einzige etablierte Ansatz einer immunsuppressiven Therapie. Eine antiinflammatorische Therapie mit Glukokortikoiden kann bei Patienten mit aktiven Krankheitszeichen (Hämaturie, persistierende Proteinurie > 1g/Tag, proliferative Veränderungen in der Histologie) und progressivem Krankheitsverlauf unter maximalen supportiven Maßnahmen einschließlich RAS-Blockade über drei bis sechs Monate eingesetzt werden. Begonnen wird im Allgemeinen mit 1 mg/kgKG Prednisolonäquilvalent unter Infektions- und Knochenprophylaxe und folgender Reduktion über sechs Monate.
In einer retrospektiven Analyse der großen europäischen VALIAGA-Kohorte konnte gezeigt werden, dass Glukokortikoide das Risiko einer Progression unabhängig von der Nierenfunktion und proportional zur Höhe der Proteinurie reduzierten [22].
In einer Meta-Analyse von neun klinischen Studien mit insgesamt 536 Patienten, die eine Proteinurie von über 1 g/Tag aufwiesen, wurde gezeigt, dass eine Steroidtherapie die Inzidenz von renalen Ereignissen (50 % Reduktion der GFR, Verdopplung des Kreatinins, terminales Nierenversagen) signifikant reduziert [23]. Allerdings traten in der Behandlungsgruppe auch signifikant häufiger unerwünschte Ereignisse auf.
Die deutsche STOP-IgAN-Studie, eine der größten randomisierten klinischen Studien zur Behandlung der IgA-Nephropathie, erbrachte vergleichbare Ergebnisse [15]. Die sechsmonatige Run-In Phase der Studie zeigte, dass bei 30 % der Patienten mit konsequenten supportiven Therapiestrategien (z. B. optimale Blutdruckregulation < 125/75 mmHg mittels RAS-Blockade, Ernährungshinweise wie salzarme Kost, Vermeiden eines exzessiven Proteinkonsums, Nikotinkarenz) eine Reduktion der Proteinurie auf < 0,75 g pro Tag erzielt werden kann. Es konnten 162 der 337 eingeschlossenen Patienten mit einer eGFR ≥ 30 ml/min/1.73 m2 und einer persistierenden Proteinurie von 0,75 bis 3,5 g/Tag randomisiert werden (Kontrollarm: Fortführung der maximal supportiven Therapie, Interventionsarm: Immunsuppression additiv zur maximal supportiven Therapie). Nach drei Jahren Behandlungsdauer zeigte sich eine komplette klinische Remission bei 14 Patienten, die eine immunsuppressive Therapie erhielten (17 versus 5 %). Eine Remission wurde v. a. bei Patienten, die nach dem POZZI-Schema behandelt wurden, erreicht (POZZI-Schema [24]: Steroidboli mit 1 g Methylprednisolon Monat 1, 3 und 5 sowie 0,5 mg/kg orales Prednisolon jeden zweiten Tag). Allerdings zeigte eine immunsuppressive Therapie keinen Vorteil hinsichtlich Nierenfunktion. Zudem hatten Patienten mit Immunsuppression ein deutlich höheres Risiko für typische Steroidnebenwirkungen wie Infektionen, gestörte Glukosetoleranz und Gewichtszunahme.
Neben dem Steroidregime nach POZZI wurde ein Behandlungsschema mit oralem Glukokortikoid (Prednison 0,8 bis 1 mg/kg pro Tag über zwei Monate gefolgt von 0,2 mg/kg pro Tag über vier Monate) untersucht [24, 25]. In dieser Studie konnte eine Steroidtherapie den Verlauf der Nierenfunktion positiv beeinflussen (renaler Endpunkt 4 % im Vergleich zu 27 % in der Kontrollgruppe).
Einen weiteren Hinweis auf ein erhöhtes Risiko für schwere Nebenwirkungen bei Steroidtherapie gibt die prospektive randomisierte TESTING-Studie [23]. Die Patienten erhielten eine orale Steroidtherapie (Methylprednisolon 0,6–0,8 mg/kg/Tag, maximal 48 mg/Tag) oder Placebo. Im Ergebnis zeigte sich zwar ein Vorteil der Steroidtherapie im Hinblick auf die Erreichung des primären Endpunkts, die Behandlung erhöhte aber signifikant das Risiko für schwerwiegende Infektionen. Zwei Patienten verstarben im Behandlungsarm, so dass die Studie aus Sicherheitsbedenken abgebrochen wurde.
Entsprechend der KDIGO-Guidelines sind beide Steroidbehandlungsregime (oral oder i. v. Boli) bei IgA-Nephropathie einsetzbar [26]. Aufgrund der zum Teil gravierenden Nebenwirkung einer hochdosierten Steroidtherapie muss die Indikation streng geprüft werden. Insbesondere bei nachlassender Nierenfunktion steigt die Komplikationsrate an [27].
Immunsuppressive Kombinationstherapie
Immunsuppressive Kombinationstherapien spielen heute in der Therapie der IgA-Nephropathie nahezu keine Rolle mehr, da sie sich als unzureichend wirksam erwiesen und mit teils schweren Nebenwirkungen assoziiert waren [15, 28, 29]. Zu dieser Schlussfolgerung kam auch das kürzlich publizierte Cochrane-Review zur immunsuppressiven Therapie der IgA-Nephropathie, das 58 randomisierte klinische Studien mit 3.933 Teilnehmern analysierte [30].
Bei schweren Erkrankungszeichen mit rapid progressivem Verlauf oder schweren histologischen Inflammationszeichen können Kombinationstherapien in Erwägung gezogen werden. Zu beachten ist jedoch, dass nur eine sehr begrenzte Anzahl an Studien und Patientenverläufen vorliegt.
Das Therapieregime nach Ballardie basierte auf einer monozentrischen Studie an lediglich 38 Patienten mit fortgeschrittener Niereninsuffizienz (Kreatinin 1,5 bis 2,8 mg/dL) und einer Proteinurie von 4 g/Tag [31]. Die Patienten erhielten eine Kombinationstherapie aus Prednisolon (40 mg pro Tag mit Reduktion auf 10 mg/d über zwei Jahre) kombiniert mit niedrig-dosiertem Cyclophosphamid (1,5 mg/kg pro Tag oral) über zwei Jahre. Die immunsuppressive Kombinationstherapie führte zu einer signifikanten Reduktion der Proteinurie innerhalb der ersten 6 Monate und ein über 5 Jahre verbessertes renales Überleben.
Eine Kombination von Azathioprin zu Glukokortikoiden hat keinen zusätzlichen Vorteil zu einer Steroid-Monotherapie (n=207 Patienten, S-Kreatinin < 2 mg/dl, Proteinurie > 1g/Tag) [32]. Allerdings hatten Patienten, die zusätzlich Azathioprin erhielten, ein hohes Risiko für schwerwiegende Nebenwirkungen.
Mycophenolat Mofetil
Mycophenolat Mofetil spielt heute bei der Therapie der IgA Glomerulonephritis keine Rolle mehr, u.a. weil die Ergebnisse zur Effektivität einer Mycophenolat Mofetil (MMF)-Therapie bei IgA-Nephropathie sich widersprüchlich zeigten. Eine doppelblinde placebo-kontrollierte Studie zum Einsatz von MMF bei IgA-Nephropahtie konnte keinen Unterschied in den Behandlungsarmen hinsichtlich Proteinurie zeigen [28].
Calcineurininhibitoren
Ciclosporin A und Tacrolimus wurden in kleinen randomisierten Studien untersucht [33, 34]. Der Einsatz von Calcineurininhibitoren wird aufgrund der potenziellen Nephrotoxizität nicht empfohlen. Zudem wurde ein hohes Rezidivrisiko beobachtet.
Alternative Interventionen
Tonsillektomie
Wenige prospektive Beobachtungen v. a. in asiatischen Populationen gaben einen Hinweis auf einen positiven therapeutischen Effekt einer Tonsillektomie in Kombination mit einer immunsuppressiven Therapie. Allerdings fehlen große randomisierte Studien mit einem ausreichenden Follow-up, ebenso ist die Übertragbarkeit auf Kaukasier kritisch zu betrachten. In der VALIAGA-Kohorte konnte keine Korrelation zwischen Tonsillektomie und Nierenfunktionsverlauf detektiert werden [35]. Aktuell wird die Tonsillektomie bei IgA-Nephropathie bei Kauskasiern nicht mehr empfohlen.
Alternative immunsuppressive Ansätze
Eine Vielzahl neuer Therapieansätze wird in klinischen Studien derzeit untersucht. Eines der am weitesten evaluierten Substanzen mit einem aus pathophysiologischer Sicht erfolgsversprechenden Ansatz ist der Einsatz eines verkapselten Steroids. Budesonid ist ein Glukokortikoid mit spezieller enterischer Formulierung und Freisetzung in der Ileozökalregion (Peyersche Plaques). Die multizentrische NEFIGAN-Studie, eine randomisierte prospektive placebo-kontrollierte multizentrische Studie, mit Einsatz von 16 mg Budesonid pro Tag zusätzlich zu einer optimalen RAS-Blockade reduzierte signifikant die Proteinurie bei IgA-Nephropathie, wodurch eine Progressionshemmung zu erwarten ist [36].
Weitere Studien umfassen Angiotensin- und Endothelinrezeptorblockade, Hemmung der Lymphozytenaktivierung mit Belimumab, Atacecept, Bortezomib, Fostamatinib bis hin zu Komplementinhibitoren. Eine Inhibition des Komplementsystems wiederum erscheint aufgrund von dessen Aktivierung bei der Entstehung der IgA-Glomerulonephritis als vielversprechender Ansatz [5, 37]. Mehrere Phase II- und III-Studien sind derzeit zu den genannten Substanzen in der Durchführung, die Ergebnisse sind ausstehend.
Therapie der rapid-progressiven IgA-Glomerulonephritis
Zur Behandlung der rapid-progressiven IgA-Glomerulonephritis liegen keine randomisierten Studien vor. Ergebnisse von älteren Beobachtungsstudien deuten darauf hin, dass intravenöse Steroidboli oder orales Cyclophosphamid mit/ohne Plasmapherese einen positiven Einfluss auf den Verlauf haben können, solange keine fortgeschrittenen fibrotischen Veränderungen in der Nierenbiopsie zu detektieren sind [38].
Schlussfolgerungen
Die IgA-Glomerulonephritis stellt eine häufige Glomerulonephritisform dar und ist mit einer Mikrohämaturie und/oder Proteinurie unterschiedlichen Ausmaßes assoziiert. Eine Vielzahl an Risikofaktoren sind bekannt, dabei sind etliche modifizierbar (z. B. Adipositas, Nikotinkonsum). Die Grundlage therapeutischer Maßnahmen sind supportive Strategien. Eine Therapie mit ACE-Hemmer oder Angiotensin-Rezeptor-Blocker zur Senkung des intraglomerulären Drucks sowie eine optimale Regulation des Blutdrucks sollten immer einer immunsuppressiven Therapie vorausgehen. Eine Verbesserung eines metabolischen Syndroms sowie eine Nikotinkarenz müssen angestrebt werden.
Die Datenlage zur Therapie einer IgA-Nephropathie mittels Immunsuppression ist immer noch begrenzt. Mit der Stop-IgAN-Studie lagen erstmals Daten aus einer größeren randomisierten kontrollierten klinischen Studie vor. Zunächst wird eine kontrollierte supportive Therapie durchgeführt. Bei Patienten mit einer Proteinurie zwischen 0,75 und 3,5 g pro Tag kann eine Steroidtherapie die Proteinurie signifikant reduzieren. Allerdings ist der Einfluss der Immunsuppression auf den Verlauf der Nierenfunktion fraglich und die Immunsuppression mit einer höheren Rate an unerwünschten Ereignissen kombiniert.
Eine Steroidbolus-Therapie oder eine immunsuppressive Kombinationstherapie kann bei rapid progressivem Verlauf oder schweren histologischen Inflammationszeichen mit glomerulären Halbmondbildungen in Erwägung gezogen werden. Bei fortgeschrittener Erkrankung mit ausgeprägter Fibrose und Glomerulosklerose wird keine Immunsuppression empfohlen. Das therapeutische Vorgehen sollte individuell nach Abwägung der jeweiligen Vorteile und Risiken gewählt werden. Innovative Therapien wie Einsatz eines verkapselten Steroidpräparates mit enterischer Freisetzung sowie Inhibition des Komplementsystems basierend auf neuen Erkenntnissen zur Pathogenese der IgA-Nephropathie werden derzeit in klinischen Studien überprüft und können potenziell vielversprechende Behandlungsoptionen bieten.
Prof. (apl.) Dr. med. Claudia Sommerer, Sektion Nephrologie, Medizinische Klinik Heidelberg, Im Neuenheimer Feld 162, 69120 Heidelberg. E-Mail: claudia.sommerer@med.uni-heidelberg.de
Die CME-Fragen und Literaturhinweise finden Sie in der PDF-Version der aktuellen Ausgabe auf unserer Website unter www.laekh.de/hessisches-aerzteblatt/heftarchiv/ausgabe/2020/juni-2020