VNR: 2760602019345790009
Dr. med. Kai-Henrik Peiffer, Prof. Dr. med. Stefan Zeuzem
Einleitung
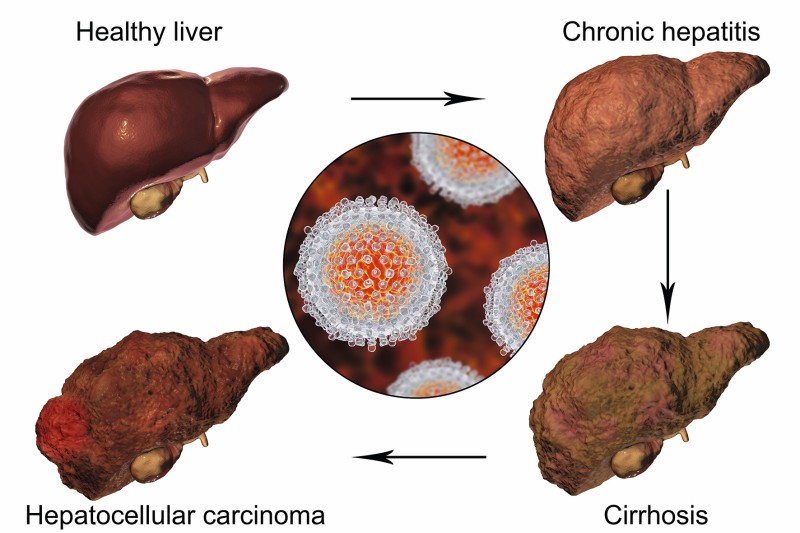
Von den bekannten Virushepatitiden können sich die Infektionen mit dem Hepatitis-B-Virus (HBV), dem Hepatitis-C-Virus (HCV) und dem Hepatitis-D-Virusoid (HDV) als chronische Erkrankungen manifestieren. Chronische Virushepatitiden erhöhen das Risiko der Entwicklung einer Leberfibrose/Leberzirrhose und/oder eines hepatozellulären Karzinoms.
Der klinische Verlauf einer chronischen HBV-Infektion ist individuell hochvariabel und bestimmt die Indikation zur antiviralen Therapie. Während bei der Therapie der HBV-Infektion zumeist eine Suppression der Virusreplikation angestrebt wird, ist das Therapieziel der HDV eine Virus-eradikation. Dies gelingt leider nur in der Minderheit der Patienten. Auch bei der Therapie der HCV wird die vollständige Viruseradikation angestrebt.
Noch vor wenigen Jahren wurde durch die damals empfohlene, nebenwirkungsreiche Interferon-basierte Therapie nur ein Teil der Infizierten geheilt. Durch die Einführung direkt antiviral wirksamer Medikamente (DAA) wurde die HCV-Therapie jedoch grundlegend revolutioniert. Heute werden > 95-prozentige Heilungsraten in allen Patientengruppen durch gut verträgliche interferonfreie Therapien erreicht.
Chronische Hepatitis-B-Virus- Infektion
HBV: Epidemiologie und Übertragungswege
Trotz dem Vorhandensein einer wirksamen Impfung zählen die chronische Infektion mit dem Hepatitis-B-Virus (HBV) und deren Komplikationen zu den global 30 häufigsten Todesursachen [1]. Weltweit lebten 2015 schätzungsweise 257 Millionen Menschen mit einer HBV-Infektion und 887.000 Menschen sind aufgrund einer HBV-Infektion gestorben [2].
Deutschland gehört zu den Gebieten mit einer niedrigen Prävalenz von ca. 0,7 %. Trotz anhaltend hoher Durchimpfungsraten ist in den Jahren 2015 und 2016 ein Anstieg der Infektionsraten beobachtet worden, was durch zunehmende Migration aus Ländern mit höherer Prävalenz erklärt wird [3].
HBV wird perinatal, perkutan durch Blut-zu-Blut-Kontakt oder durch Sexualkontakte übertragen. Anfang der 1970er-Jahre wurde das Virus häufig durch die Transfusion von Blut oder Blutproduktion übertragen, mittlerweile ist durch Testung des Spenderblutes auf HBsAg und auf Anti-HBc die Transfusion sicher geworden. Das Restrisiko wird auf 1:500.000 beziffert. Plasmaderivate wie z. B. Gerinnungsprodukte sind heutzutage laut dem Robert Koch-Institut (RKI) als virussicher zu betrachten. Ein weiterer wichtiger Risikofaktor ist das „needle-sharing“ bei i.v.-Drogengebrauch sowie Piercing, Tätowierung etc. mit unsterilen Instrumenten.
HBV: Virus und Krankheitsverlauf
HBV ist ein kleines, partiell doppelsträngiges DNA-Virus mit einem Durchmesser von ca. 42 nm. Bei Nachweis des HBV-spezifischen Oberflächenantigens (HBsAg) über sechs Monate spricht man von einer chronischen Infektion. Hier sind auch stets Antikörper gegen das Kernprotein (Anti-HBc) nachweisbar. Während die Infektion im Säuglingsalter in der Mehrzahl der Fälle zu einer chronischen Infektion führt, kommt es bei einer horizontalen Infektion im Erwachsenenalter bei 95 % der Fälle zu einer ausreichenden Kontrolle durch das Immunsystem und damit zur primären Ausheilung [4].
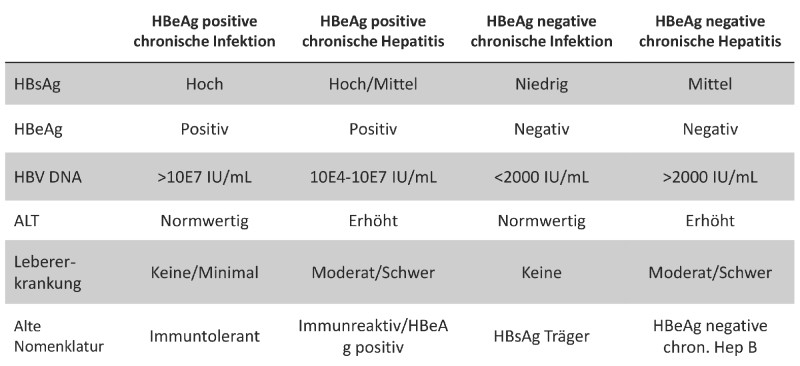
In der 2017 erschienenen neuen europäischen Leitlinie werden aktuell vier Stadien unterschieden, bei denen neben dem Vorhandensein des HBe-Antigens (HBeAg) vor allem zwischen Infektion und durch die Infektion verursachter Hepatitis mit laborchemisch oder histologisch nachweisbarer Leberinflammation unterschieden wird [3]. Man teilt die Stadien ein in:
- HBeAg positive chronische Infektion,
- HBeAg positive chronische Hepatitis B,
- HBeAg negative chronische Infektion und
- HBeAg negative chronische Hepatitis B (siehe Abb. 1).
Patienten mit einer HBV-Infektion müssen nicht zwangsläufig alle Stadien durchlaufen, es besteht eine hohe individuelle Variabilität.
Die Inzidenz für eine Zirrhoseentwicklung wird auf ca. 8–20 % in therapienaiven Patienten beziffert [3]. Das Risiko von Patienten mit Leberzirrhose, ein hepatozelluläres Karzinom (HCC) zu entwickeln, beträgt jährlich zwischen 2–5 % [5]. Zu beachten ist, dass die chronische HBV-Infektion auch ohne das Vorhandensein einer Zirrhose das Risiko für ein HCC deutlich erhöht.
HBV: Indikation zur Therapie und Therapieziele
Ziel der Therapie der chronischen HBV ist es, das Überleben zu verlängern, die Lebensqualität zu verbessern, eine Fibroseprogression zu stoppen sowie die Entwicklung einer Leberzirrhose und/oder eines HCC zu verhindern. Auch kann eine Therapie zur Transmissionsvermeidung (zum Beispiel von Mutter zu Kind) oder bei extrahepatischen Manifestationen indiziert sein. Eine sichere Indikation zur Therapie besteht bei dem Vorhandensein einer fortgeschrittenen Leberfibrose oder Leberzirrhose. Hier sollte bei jeder nachweisbaren Viruslast eine antivirale Therapie durchgeführt werden [4].
Bei nicht-zirrhotischen Patienten ist eine Therapie indiziert unabhängig vom HBeAg-Status, wenn die HBV-DNA bei > 2000 IU/ml liegt und entweder eine signifikante Fibrose (ermittelt histologisch oder durch nicht-invasive Methoden wie der Elastographie) oder eine entzündliche Aktivität (in der Histologie oder wiederholt erhöhte GPT) vorliegt [4]. Bei allen HBV-infizierten Patienten sollte zusätzlich eine HDV-(Anti-HDV und wenn positiv HDV-RNA) und HIV-Koinfektion ausgeschlossen werden.
Das Hepatitis-B-Virus bildet intrazellulär eine sogenannte „covalently closed circular DNA“ (cccDNA), die als besonders stabile DNA-Form in einer Art Minichromosom für die virale Replikation in den Hepatozyten persistiert. Zusätzlich kommt es im Erkrankungsverlauf wiederholt zur Integration von viraler DNA ins Wirtsgenom. Auch wenn aktuell viele neue antivirale Substanzen erforscht und klinisch evaluiert werden, gelingt mit den heutzutage verfügbaren Therapien in der Mehrzahl der Fälle lediglich eine Suppression der viralen Replikation.
Hierbei wird die HBV-DNA supprimiert, das HBsAg ist aber weiterhin im Serum nachweisbar („partial cure“). In wenigen Fällen gelingt zudem die Etablierung einer effizienten Immunkontrolle, die zusätzlich auch einen Verlust des HBsAg bedingt („functional cure“). Zu beachten ist, dass auch bei HBsAg-Verlust cccDNA und Integrate weiter in den Hepatozyten persistieren und es im Falle einer Immunsuppression, wie zum Beispiel unter Rituximab-Therapie oder nach Knochenmarkstransplantation, zu einer unter Umständen schwerwiegenden Reaktivierung der Infektion kommen kann. Daher sollte vor Beginn einer intensiven Immuntherapie obligat eine serologische Diagnostik auf HBV und je nach geplanter Immuntherapie ggf. eine präemptive antivirale Therapie durchgeführt werden.
HBV: Therapie
Grundsätzlich stehen für die Therapie der chronischen Hepatitis-B-Infektion zwei Optionen zur Verfügung:
1) pegyliertes Interferon alfa (PegIFNα) und
2) Nukleos(t)id Analoga (NA):
zu 1) Bei der zumeist 48-wöchigen Therapie mit PegIFNα wird eine langfristige Immunkontrolle angestrebt. Tatsächlich gelingt es je nach HBV-Genotyp, HBeAg-Status und Viruslast in kumulativ ca. 4 % der Fälle einen HBsAg-Verlust zu erreichen [3]. Vorteil der Therapie ist die begrenzte Therapiedauer. Prädiktoren für ein Ansprechen unter Therapie wurden in der europäischen Leitlinie formuliert und ermöglichen einen vorzeitigen Therapieabbruch. Nachteilig sind das Nebenwirkungsprofil sowie eine sehr variable Ansprechrate, sodass heutzutage nur noch wenige HBV-monoinfizierte Patienten mit PegIFNα behandelt werden. Bei der HBV/HDV-Koinfektion ist die Therapie mit PegIFNα jedoch weiterhin das einzige empfohlene Therapieregime
(siehe unten).
zu 2) Für die Therapie der chronischen HBV sind folgende Nukleos(t)id Analoga (NA) zugelassen: Lamivudin (LAM), Adefovir Dipivoxil (ADV), Telbivudin (TBV), Entecavir (ETV), Tenofovir Disoproxil Fumarat (TDF) und seit neuestem Tenofovir Alafenamid (TAF). Hiervon weisen ETV, TDF und TAF eine hohe Resistenzbarriere bei hoher antiviraler Aktivität und günstigem Nebenwirkungsprofil auf und werden heutzutage zur Therapie der chronischen HBV empfohlen. Das vor kurzem für die Therapie der chronischen HBV zugelassene TAF ist ebenfalls wie TDF ein Prodrug des aktiven Metaboliten Tenofovirdiphosphat, welches aber aufgrund erhöhter intrazellulärer Verfügbarkeit in niedrigeren Dosierungen als TDF eingesetzt werden kann und damit die bekannten Nebenwirkungen von TDF (Abnahme der glomerulären Filtrationsrate, Abnahme der Knochendichte) reduziert [6–8]. Laut europäischer Leitlinie kann TAF bei vor allem älteren Patienten (> 60 Jahre) indiziert sein, die entweder eine Knochenerkrankung (zum Beispiel Osteoporose) oder eine Niereninsuffizienz (eGFR < 60ml/min pro 1,73m2) aufweisen. Alternativ kann in diesen Fällen die Therapie mit Entecavir erfolgen, sofern keine LAM-Behandlung in der Vergangenheit durchgeführt wurde, was die Resistenzbarriere von Entecavir verringert.
Die Therapie mit einem NA ist im Regelfall zunächst bis zum HBsAg-Verlust als unbefristete Therapie fortzuführen. Bei Patienten ohne Leberzirrhose kann die NA-Therapie beendet werden, wenn unter Therapie eine stabile HBeAg-Serokonversion zu beobachten ist, die HBV-DNA negativ ist und eine weitere einjährige Konsolidierungstherapie nach Serokonversion durchgeführt wurde.
Ein Absetzen der Therapie kann auch bei Patienten ohne Leberzirrhose erwogen werden, wenn die HBV-DNA unter der Therapie drei Jahre nicht nachweisbar war und engmaschige Kontrolluntersuchungen nach Absetzen der Therapie gewährleistet werden können [3]. In kleineren Studien wurde beobachtet, dass es nach Absetzen zu relevant höheren Raten von HBsAg-Verlusten und dauerhaften virologischen Remissionen ohne erneute Therapiebedürftigkeit kommen kann [9, 10].
Patienten mit fortgeschrittener Leberzirrhose und/oder HCC sollten bei nachweisbarer HBV-DNA mit einem NA behandelt werden und auf die Notwendigkeit bzw. Möglichkeit einer Lebertransplantation überprüft werden. Insbesondere bei diesen Patienten ist die Anbindung an ein erfahrenes Leberzentrum sinnvoll.
Im Falle einer Schwangerschaft und Therapiebedürftigkeit wird eine Therapie aufgrund guter klinischer Sicherheitsdaten mit TDF empfohlen. Auch ein Stillen ist unter TDF-Therapie möglich [3]. Um die Transmissionsrate von Mutter auf Kind zu vermindern, wird eine antivirale Prophylaxe mit TDF bei Schwangeren mit einer hohen Viruslast (> 200.000 IU/ml) oder hohem HBsAg (> 4log10 IU/ml) ab der 24–28 Schwangerschaftswoche bis zwölf Wochen nach Geburt empfohlen.
HBV: Kontrollen und Surveillance
Patienten ohne Therapieindikation sollten im ersten Jahr nach Diagnosestellung mindestens dreimalig und ab dem zweiten Jahr mindestens zweimalig auf zumindest Transaminasen und quantitative HBV-DNA untersucht werden. Eine Ultraschalluntersuchung der Leber sollte in Abhängigkeit des Risikoprofils mindestens alle sechs Monate durchgeführt werden. Bei Patienten unter Therapie sollten zunächst alle drei Monate laborchemische (Transaminasen und Lebersyntheseparameter, Blutbild, INR) und virologische Untersuchungen (mind. HBV-DNA; initial auch HBeAg bzw. wenn negativ Anti-HBe; HBsAg [ggf. quantitativ], bzw. wenn negativ Anti-HBs) durchgeführt werden. Später kann das Kontrollintervall auf sechs Monate verlängert werden. Eine qualifizierte Sonographie sollte bei Patienten mindestens einmal jährlich, bei Patienten mit Leberzirrhose je nach HCC-Risikoprofil mindestens halbjährlich durchgeführt werden.
Chronische Hepatitis B/D-Koinfektion
HBV/HDV: Epidemiologie und Übertragungswege
Die Hepatitis D (Delta)/HBV-Koinfektion kommt in ca. 5 % aller chronischen HBV-Infektionen vor [11]. Es wird geschätzt, dass ca. 15–20 Millionen Menschen weltweit chronisch mit HBV/HDV-koinfiziert sind. Die Übertragung verläuft parenteral entweder als simultane HBV/HDV-Infektion oder als Superinfektion bei bereits bestehender HBV-Infektion.
HBV/HDV: Virus und Krankheitsverlauf
HDV ist ein RNA-Virusoid, welches bei der Virusmorphogenese zusätzlich das Oberflächenantigen (HBsAg) von HBV benötigt und folglich nur bei gleichzeitiger Koinfektion mit HBV vorkommt. Ein Impfschutz gegen HBV schützt daher auch gegen eine HDV-Infektion. Die chronische HBV/HDV-Koinfektion verursacht eine zumeist schwerwiegende Hepatitis. Rasch progrediente Krankheitsverläufe mit Entwicklung einer Zirrhose und/oder eines HCC sind häufiger als bei einer HBV-Monoinfektion [4]. Beispielsweise zeigte eine Studie eine verdoppelte 5-Jahres Mortalität und eine verdreifachte HCC-Rate bei Patienten mit Leberzirrhose aufgrund einer HBV/HDV-Koinfektion im Vergleich zu zirrhotischen Patienten aufgrund einer HBV-Monoinfektion [12].
HBV/HDV: Therapie
Grundsätzlich sollte bei allen Patienten mit einer HBV/HDV-Koinfektion aufgrund der häufig ungünstigen Krankheitsverläufe eine antivirale Therapie evaluiert werden [4]. Auch für die HDV-Therapie werden aktuell neue antivirale Substanzen klinisch evaluiert. Leitliniengerecht wird aktuell eine 48-wöchige Therapie mit pegIFNα empfohlen [4]. Wichtige Kontraindikationen (z. B. dekompensierte Leberzirrhose) und das Nebenwirkungsprofil sind zu beachten, eine enge Therapiebegleitung ist unabdingbar und sollte nur von Ärzten mit Erfahrung in der Interferontherapie durchgeführt werden. Mittels pegIFNα wird eine HDV-RNA-Suppression in 25–50 % erreicht, die Rezidivrate nach Absetzen liegt jedoch bei ca. 50 % [13]. Insbesondere Patienten ohne Abfall des HBsAg unter Therapie erleiden häufiger ein Rezidiv. Auch wenn durch die Interferontherapie keine Eradikation erreicht werden kann, scheint die Therapie das Voranschreiten der Erkrankung zu verlangsamen.
Eine Therapie mit einem NA zusätzlich zum pegIFNα erhöht die HDV-Ansprechraten nicht [14]. Die gleichzeitig bestehende HBV-Infektion kann allerdings bei hoher Viruslast eine NA-Therapie begründen.
Patienten mit fortgeschrittener Leberzirrhose sollten bezüglich der Optionen einer Lebertransplantation evaluiert werden. Aufgrund geringerer Reinfektions- und Abstoßungsraten ist der klinische Verlauf nach Transplantation mit 5-Jahres-Überlebensraten bis zu 90 % besser als bei HBV-monoinfizierten Patienten [4].
Chronische Hepatitis-C-Infektion
HCV: Epidemiologie und Übertragungswege
Laut WHO sind weltweit ca. 70 Millionen Menschen mit dem Hepatitis-C-Virus (HCV) chronisch infiziert [15]. Etwa 400.000 Menschen sterben jährlich an einer HCV-assoziierten Komplikation wie der Leberzirrhose und/oder HCC. Die Prävalenz beträgt in Deutschland 0,3–0,5 % [16], kann regional allerdings variieren. Die Transmission des Hepatitis-C-Virus erfolgt parenteral. Während früher eine Übertragung über Blutprodukte häufig war, erfolgt heute eine Transmission vor allem durch
- „needle-sharing“ beim Drogenabusus,
- homosexuelle Kontakte unter Männern sowie
- durch iatrogene Übertragung im Gesundheitswesen – vor allem aber in Ländern mit mangelnder Einhaltung von Hygienerichtlinien. Das Risiko für eine Übertragung z. B. bei einer Stichverletzung mit HCV-kontaminiertem Material beträgt in Europa ca. 0,4 %.
HCV: Virus und Krankheitsverlauf
Das Hepatitis-C-Virus ist ein einzelsträngiges, umhülltes RNA-Virus mit hoher genetischer Variabilität. Mindestens acht verschiedene Genotypen (HCV-Genotyp 1–8) und zahlreiche Subtypen werden unterschieden. Von einer chronischen Infektion spricht man, wenn eine virale Replikation über sechs Monate persistiert. Etwa 50–70 % der akuten Infektionen chronifizieren. Mit der Entwicklung einer Leberzirrhose muss bei 20–30 % der Patienten innerhalb von 30 Jahren gerechnet werden. Die Inzidenz des HCC liegt bei ca. 3–6 % der Patienten mit HCV-assoziierter Leberzirrhose [17].
HCV: Indikation zur Therapie und Therapieziele
Die chronische Hepatitis-C-Infektion stellt grundsätzlich eine Indikation zur antiviralen Therapie dar [18]. Ein fehlender molekularer Nachweis von HCV-RNA zwölf Wochen nach Ende einer antiviralen Therapie zeigt eine dauerhafte Viruseradikation (SVR =„sustained virologic response“) und damit einen Therapieerfolg an. Zu beachten ist, dass die Eradikation von HCV zu keiner protektiven Immunität führt, sodass Reinfektionen möglich sind. Das Erreichen eines SVR senkt die Letalität, vermindert das Risiko der HCC-Entwicklung und reduziert die Notwendigkeit einer Lebertransplantation [17].
HCV: Direkt antivirale Medikamente
In der Hepatitis-C-Therapie werden heutzutage direkt antiviral wirksame Medikamente (DAA) mit einer hohen antiviralen Wirksamkeit eingesetzt. Um Resistenzen vorzubeugen, werden immer DAA kombiniert, die sich hinsichtlich der Angriffspunkte unterscheiden. RNA-Polymeraseinhibitoren, NS3/4A-Protease-inhibitoren und NS5A-Inhibitoren stehen zur Hemmung der viralen Replikation zur Verfügung.
HCV: Therapie
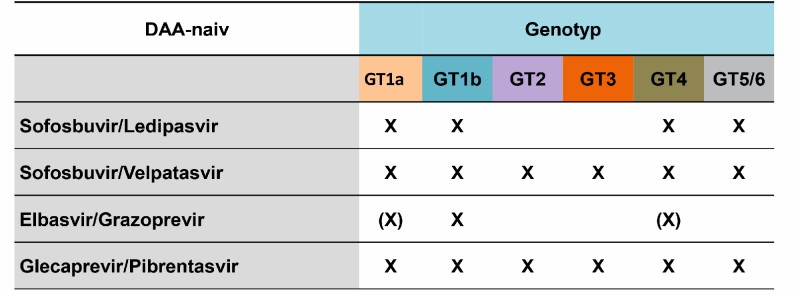
- Sofosbuvir/Ledipasvir
- Sofosbuvr/Velpatasvir
- Grazoprevir/Elbasvir
- Glecaprevir/Pibrentasvir
Die SVR-Rate dieser Regime ist mit > 95 % exzellent. Ein Versagen der Therapie wird nur noch in Ausnahmefällen beobachtet. Die Auswahl eines Regimes sollte gezielt nach medizinischen, aber auch wirtschaftlichen Kriterien optimalerweise in Rücksprache mit der zuständigen Krankenkasse getroffen werden. Für die Therapieauswahl sind der HCV-Genotyp, das Vorhandensein einer Leberzirrhose und eine eventuelle Vortherapie relevant. Das Fibrose-/Leberzirrhosestadium wird heutzutage vor allem durch nicht-invasive Ultraschall-basierte Methoden wie beispielsweise der Elastographie ermittelt. Zudem müssen bei der Therapieauswahl Komorbiditäten und mögliche Medikamenteninteraktionen beachtet werden. Letztere können schnell und übersichtlich im Internet zum Beispiel über http://www.hep-druginteractions.org, einer Datenbank der Pharmakologie der Universität in Liverpool, überprüft werden. Vorhandene Rabattverträge mit Krankenkassen sind zu beachten, und das medizinische und wirtschaftliche Abwägen der Medikamentenwahl sollte dokumentiert werden.
1) Sofosbuvir/Ledipasvir
In diesem Regime wird der nukleotidische Polymeraseinhibitor Sofosbuvir mit dem NS5A-Inhibitor Ledipasvir kombiniert. Klinisch einsetzbar ist die Kombination bei Patienten mit HCV-Genotyp 1, 4 oder 6 mit und ohne Leberzirrhose. Die Standardtherapiedauer beträgt zwölf Wochen. Eine Therapieverkürzung auf acht Wochen ist unter bestimmten Voraussetzungen möglich [19, 20].
2) Sofosbuvir/Velpatasvir
Sowohl der NS5A-Inhibitor Velpatasvir als auch das Sofosbuvir sind pangenotypisch bei allen Genotypen wirksam [21, 22]. Die Therapiedauer beträgt unabhängig vom HCV-Genotyp zwölf Wochen sowohl in therapienaiven als auch in vorbehandelten Patienten mit und ohne kompensierte Leberzirrhose. Bei Patienten mit dekompensierter Leberzirrhose wird eine zusätzliche Gabe von Ribavirin (600mg/Tag) empfohlen [23].
3) Grazoprevir/Elbasvir
Diese Kombination aus einem NS3/4A-Proteaseinhibitor und einem NS5A-Inhibitor ist zur Behandlung der HCV-Genotyp-1 und -4 zugelassen. Die Standardtherapiedauer beträgt bei Patienten unabhängig von dem Vorhandensein einer kompensierten Leberzirrhose zwölf Wochen. Eine Therapieverlängerung auf 16 Wochen soll bei HCV-Genotyp-1a-infizierten Patienten und Genotyp-4-Patienten mit erhöhter Ausgangsviruslast (> 800.000 IE/mL) erfolgen [24]. Eine Therapieverlängerung bei Genotyp-1a-infizierten Patienten kann unterlassen werden, wenn durch eine Resistenztestung vor der Therapie relevante resistente virale Varianten ausgeschlossen wurden.
4) Glecaprevir/Pibrentasvir
In diesem bei allen Genotypen anwendbaren Regime wird der NS3/4A-Proteaseinhibitor Glecaprevir mit dem NS5A-Inhibitor Pibrentasvir kombiniert. Die Therapiedauer beträgt bei allen therapienaiven Patienten (außer HCV-Genotyp-3) mit und ohne kompensierte Leberzirrhose acht Wochen. Bei therapienaiven zirrhotischen Patienten und Genotyp-3-Infektion sowie bei vorbehandelten Patienten mit kompensierter Leberzirrhose beträgt sie zwölf Wochen. Eine Verlängerung der Therapiedauer auf sechzehn Wochen wird bei vorbehandelten HCV-Genotyp-3-infizierten Patienten unabhängig vom Zirrhosestatus empfohlen [25].
HCV: Therapie spezieller Patientenpopulationen
Im Falle eines vorangegangenen Therapieversagens auf eine DAA-basierte Therapie muss von dem Vorliegen resistenter Varianten ausgegangen werden. Hier kann auf der Grundlage einer HCV-Resistenzanalyse eine erneute individualisierte Behandlung in einem spezialisierten Zentrum erfolgen. Alternativ kann ein Regime gewählt werden, bei dem Sofosbuvir/Velpatasvir zusätzlich mit einem dritten Wirkstoff, dem NS3/4A-Proteaseinhibitor Voxilaprevir, kombiniert wird. Bei Patienten mit dekompensierter Leberzirrhose sind NS3/4A-Proteaseinhibitoren aufgrund von Sicherheitsbedenken (Lebertoxizität) kontraindiziert. Daher kann eine Therapie bei diesen Patienten lediglich mit Sofosbuvir und den kombinierbaren NS5A-Inhibitoren erfolgen.
Auch Patienten, die für eine Lebertransplantation vorgesehen oder in der Vergangenheit transplantiert worden sind, können heutzutage sicher und hocheffektiv antiviral behandelt werden. Hier sollte die Indikation zur antiviralen Therapie jedoch in enger Absprache mit dem verantwortlichen Transplantationszentrum erfolgen.
Für Patienten mit einem HCC gibt es bis dato keine eindeutigen Empfehlungen. Nach Meinung der Autoren besteht eine sichere Therapieindikation, wenn das HCC kurativ therapiert werden kann/konnte. Ob ein Benefit auch für Patienten in einer palliativen onkologischen Situation besteht, ist bisher unklar und sollte individualisiert in Abhängigkeit des Tumorstadiums, der Leberfunktion und der Gesamtprognose entschieden werden. Auch für terminal niereninsuffiziente Patienten gibt es zugelassene antivirale Therapieregime [20].
Bei Patienten mit einer zusätzlich vorliegen HIV-Koinfektion sollten mögliche Medikamenteninteraktionen der DAA mit der hochaktiven antiretroviralen Therapie (HAART) vor Therapiebeginn geprüft werden. Bei Patienten mit zusätzlicher HBV-Koinfektion kann es unter Therapie zu einer Reaktivierung der HBV kommen, hier sollte ein entsprechendes Monitoring bzw. ggf. Einleiten einer antiviralen HBV-Therapie erfolgen.
Aufgrund ungenügender Daten bezüglich des teratogenen Risikos sollte bei antiviraler Behandlung eine sichere Empfängnisverhütung empfohlen werden. Eine antivirale Therapie während der Schwangerschaft und Stillzeit kann aktuell nicht empfohlen werden.
HCV: Vorgehen während und nach der Therapie
Eine HCV-RNA-Messung unter Therapie ist nicht zwingend erforderlich, ein Monitoring der Transaminasen zur Bestimmung der virologischen Wirksamkeit ist ausreichend [20]. Eine HCV-RNA-Messung zum Nachweis des virologischen Therapieerfolgs ist zwölf Wochen nach Therapieende erforderlich. Aufgrund des verbleibenden HCC-Risikos auch nach erfolgreicher Viruseradikation wird bei Patienten mit einer Leberzirrhose, unabhängig von einer möglichen Fibroseregression, eine (lebenslange) Surveillance mittels Lebersonographie, gemäß der deutschen Leitlinie zusammen mit der Bestimmung des Alpha-Fetoproteins, alle sechs Monate empfohlen [18].
Zusammenfassung und Ausblick
Bei der Therapie der chronischen Hepatitis-C-Infektion wurde mit Zulassung und Entwicklung der DAA eine neue Ära eingeleitet. Heutzutage stehen für alle Patientengruppen hocheffektive und nebenwirkungsarme Therapiemöglichkeiten zur Verfügung. Mit diesen neuen Möglichkeiten rücken immer mehr Eliminationsstrategien von HCV in den Fokus.
Demnach hat die WHO ambitionierte Ziele formuliert: Bis zum Jahr 2030 soll die Zahl der diagnostizierten HCV-Fälle auf 90 %, die Zahl der Behandlungen auf 80 % gesteigert sowie die Inzidenz von HCV um 90 % und die Mortalität um 65 % reduziert werden.
Bei der chronischen Hepatitis B-Infektion gibt es mit den NA hocheffektive Therapiemöglichkeiten, die eine zumeist vollständige Suppression der HBV-Replikation erreichen. Diese Therapien sind jedoch als Dauertherapie ausgelegt und nur in Einzelfällen gelingt es, eine vollständige Immunkontrolle zu induzieren. Eine Eradikation wie bei HCV ist aufgrund der viralen Eigenschaften von HBV bislang nicht möglich. Bei der HDV-Therapie werden neue Therapiemöglichkeiten dringend benötigt, da mit der aktuell empfohlenen pegIFNα nur unzureichende Therapieergebnisse erzielt werden. Hier wird mit Spannung die Entwicklung neuer antiviraler Strategien und Substanzen erwartet. Auch ein durch das Land Hessen gefördertes Konsortium (DRUID) verschiedener wissenschaftlicher Arbeitsgruppen der Universitäten Gießen, Marburg und Frankfurt sowie dem Paul Ehrlich-Institut, dem auch die Autoren angehören, beschäftigt sich aktuell intensiv mit der Behandlung vernachlässigter Infektionserkrankungen und hierbei unter anderem mit verschiedenen viralen Hepatitiden.
Dr. med. Kai-Henrik Peiffer, E-Mail: kai-henrik.peiffer@kgu.de
Prof. Dr. med. Stefan Zeuzem, Medizinische Klinik 1, Universitätsklinikum Frankfurt am Main, Theodor-Stern-Kai 7, 60590 Frankfurt am Main
Die CME-Fragen und Literaturhinweise finden Sie in der PDF-Version der aktuellen Ausgabe auf unserer Website unter https://www.laekh.de/heftarchiv/ausgabe/2020/januar-2020