Aktueller Stand der Wissenschaft / VNR: 2760602020149390004
Antonia Dierks, Prof. Dr. med. Christian Jackisch, Prof. Dr. med. Henrik Menke
Einleitung
Seit den 1960er-Jahren werden in der Medizin Implantate zum Brustaufbau verwendet, und bisher wurden weltweit zwischen 5 und 10 Millionen implantatgestützte Brustaugmentationen und Brustrekonstruktionen durchgeführt [1, 2]. Der erste Verdacht bezüglich karzinogener Eigenschaften von Brustimplantaten, insbesondere die Entstehung eines Lymphoms, wurde bereits 1995 bis 1997 geäußert [3–5]. Das medizinische und gesellschaftliche Interesse hinsichtlich dieses möglichen Zusammenhangs ist erst in den vergangenen zehn Jahren deutlich gestiegen [6].
Die U.S. Food and Drug Administration (FDA) sowie die Deutsche Gesellschaft der Plastischen, Rekonstruktiven und Ästhetischen Chirurgen (DGPRÄC) nahmen 2011 erstmals Stellung zu einem möglichen Zusammenhang [7, 8]. Im Februar 2017 wiesen die FDA sowie die DGPRÄC offiziell auf eine positive Assoziation zwischen dem Einsatz von Brustimplantaten und dem Auftreten eines Lymphoms hin. Kürzlich teilte das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) mit, dass ein Hersteller den Rückruf texturierter Brustimplante und Expander empfohlen hat (BfArM-Referenznummer 15914/18).
Das anaplastische großzellige Lymphom (ALCL) ist eine seltene Form des Non-Hodgkin-Lymphoms, welches sich als indolente, lymphoproliferative, primär kutane oder als aggressive, systemische Erkrankung ausprägen kann [6, 7]. Es wird weiter anhand der Expression der anaplastischen Lymphomkinase (ALK) oder deren Fehlens in seine Unterformen unterteilt [9]; ALK-negative Formen sind generell mit einer schlechteren Prognose assoziiert [10]. Die unterschiedlichen Formen des ALCL präsentieren sich histologisch durch ihre „Markenzeichen-Zellen“ [5]: große anaplastische Zellen mit pleomorphen oder hufeisenförmigen Zellkernen mit fein verteiltem Chromatin und reichlich eosinophilem oder amphophilem Zytoplasma [2, 9]. Die Lymphozyten des ALCL sind konstant positiv für den Zytokinrezeptor CD30 [9, 11].
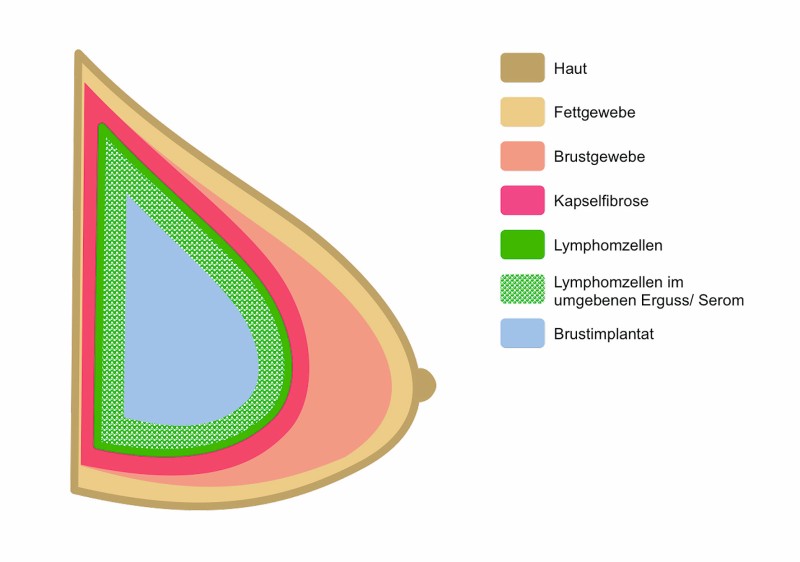
Das Brustimplantat-assoziierte anaplastische großzellige Lymphom (BIA-ALCL) ist ein CD30-positives, ALK-negatives ALCL und damit eine aggressive Form eines T-Zell-Lymphoms [11, 12]; es wird allerdings als klinisch indolente Erkrankung mit guter Prognose gesehen und stellt somit eine neue Entität des ALCL dar [4, 6, 12]. Es präsentiert sich in direkter Beziehung zum Implantat mit Lymphomzellen entweder in der serösen Flüssigkeit um das Implantat, in der angrenzenden Kapsel oder als infiltrierende Form mit einer zusätzlicher Tumormasse in unmittelbarer Nähe zur Kapsel [2, 13, 14].
Das BIA-ALCL tritt im Mittel zehn Jahre nach Einlage der Implantate auf, der Zeitraum des Auftretens kann allerdings erheblich von 1 bis 32 Jahren variieren [5]. Das durchschnittliche Erkrankungsalter wird mit etwa 50 Jahren angegeben [9, 15].
Das BIA-ALCL ist scharf von anderen Non-Hodgkin-Lymphomen der Brust abzugrenzen, die nicht mit Brustimplantaten assoziiert sind. Diese haben in der Regel einen B-Zell-Ursprung, sind im Brustparenchym lokalisiert und sind vor allem diffus großzellige B-Zell-Lymphome, follikuläre Lymphome, extranodale Marginalzonen-Lymphome, lymphoplasmozytoide Lymphome oder Lymphome seröser Körperhöhlen mit Ergussbildung [1, 11, 16, 17].
Die genaue Prävalenz des BIA-ALCL ist schwer zu ermitteln, was sich in sehr unterschiedlichen Zahlen in der Literatur widerspiegelt. Es macht 0,4–0,5 % der Malignome der Brustdrüse, 1–2 % der Lymphome und 2–3 % der NHL aus [4, 18]. Laut FDA tritt es bei 0,6–1,2 von 100.000 Patientinnen auf [2]. Manche Quellen ermitteln Prävalenzen von < 1 von einer Million Patientinnen mit Brustimplantaten pro Jahr [9], während andere Quellen auf < 1 von 100.000 Patientinnen mit Brustimplantaten pro Jahr kommen [15]. Im Mittel entwickeln ein bis zwei Frauen von 10.000 Frauen mit Brustimplantaten in zehn Jahren ein BIA-ALCL [11].
Aktuell sind bereits über 600 Fälle von BIA-ALCL-Erkrankungen bekannt [12, 19]. In Deutschland wurde 2007 erstmals ein Fall behandelt [7].
Symptome
Das klinische Bild des BIA-ALCL ist variabel, wobei als vorherrschendes Symptom das Spätserom über ein Jahr nach Implantation, im Mittel zehn Jahre nach Implantation aufzuführen ist [1, 11]. Andere mögliche Symptome sind eine tumoröse Raumforderung im Sinne einer tastbaren Geschwulst in der Brust [8, 15], Entwicklung einer Kapselfibrose [20], Lymphadenopathie [17], Brustschwellung [2] und damit verbundene Brustasymmetrie [11], Druckschmerz der Brust [17], Rötung [5], Ausschlag und Juckreiz [2]: siehe Tab. 1.
Aufgrund der Vielfältigkeit der möglichen Präsentation der Erkrankung wird die Assoziation der Symptome zum Vorliegen eines BIA-ALCL oftmals erst spät hergestellt, wodurch der Therapiebeginn verzögert wird und sich somit negativ auf den Krankheitsverlauf auswirkt.
Tab. 1: Symptome des BIA-ALCL |
• Brustschwellung/Brustspannung |
• Erguss/Serom |
• Ausschlag, Juckreiz |
• Tastbare Raumforderung |
• Kapselverhärtung |
• Entzündung, Ulzeration |
• Lymphknotenvergrößerung |
Pathogenese
Die genaue Pathogenese des BIA-ALCL ist bis dato noch weitestgehend ungeklärt, wobei es allerdings unterschiedliche Vermutungen und Untersuchungen bezüglich des Ursprungs der Erkrankung gibt.
Patientinnen mit einer malignen Vorgeschichte wie Brustkarzinom oder Lymphom haben laut Expertenkonsens kein höheres Risiko an einem BIA-ALCL zu erkranken [21]. Das Risiko am BIA-ALCL zu erkranken, ist für Patientinnen, die aus ästhetisch-kosmetischen Indikationen ein Implantat erhalten haben, und Patientinnen, denen ein Implantat aus rekonstruktiven Gründen eingesetzt wurde, gleich [10, 16]. Ein direkter Zusammenhang zwischen einem spezifischen Implantattyp, dem Zeitpunkt des Einsatzes oder der Intaktheit des Implantats wird nicht gesehen [11, 16, 21]. Außerdem herrscht kein Konsens im Hinblick auf die Frage, ob der Implantattyp, Silikon- oder Kochsalzimplantate, die Implantatoberfläche, texturierte oder glatte Implantate oder die Implantatgröße ein unterschiedliches Risiko in der Entstehung mit sich bringen [21].
Da in über 90 % der bislang eindeutig identifizierten Patientinnen mit BIA-ALCL ein texturiertes Implantat benutzt wurde, deutet dies auf einen möglichen Zusammenhang zwischen der Implantatoberfläche und der Entwicklung eines ALCL hin [8]. Das Risiko von Patientinnen mit einem texturierten Brustimplantat an einem ALCL zu erkranken, wird in den USA rechnerisch mit 1:30.000 angegeben; eindeutige Ergebnisse hierzu fehlen bislang allerdings [22]. Von den bis dato von der FDA 359 registrierten Fällen eines BIA-ALCL erhielten lediglich 28 Patientinnen (7 %) zuvor ein glattes Implantat; zu diesen Fällen liegt jedoch keine detaillierte klinische Vorgeschichte vor, sodass bis zum jetzigen Zeitpunkt kein eindeutiger Fall von glatten Implantaten mit BIA-ALCL bekannt ist [6, 8].
Die meisten mit BIA-ALCL assoziierten Implantate enthielten Silikon entweder als Füllmaterial oder als Teil der Implantatoberfläche [1]. Einige Studien vermuten, dass Silikon eine direkte toxische Wirkung auf Gewebe hat sowie die Produktion und Sekretion von Interferonen und Tumornekrosefaktor alpha (TNF-α) fördert, wodurch es karzinogenes Potenzial hat [1]. Außerdem können Silikonabriebpartikel der Implantate zu einem proliferativen Reiz mit nachfolgender chronischer Inflammation führen [7], was wiederum zu einer antigenabhängigen Aktivierung von Th1/Th17-Zellen und damit zur T-Zell-Proliferation mit nachfolgender Transformation von einer T-Zell-Subpopulation zu ALCL-Lymphomzellen führt [5, 17, 22].
Eine chronische bakterielle Besiedelung der Brustimplantate mit gramnegativen Stäbchen, Ralstonia pickettii, wird mit der Entstehung des BIA-ALCL assoziiert, da vermutet wird, dass eine chronische Entzündung zur Lymphozytenaktivierung führt [5, 7, 12, 22]. Deshalb sollte bei dem Einsatz von Brustimplantaten auf eine Reduktion der Kontamination durch Waschen der Implantathöhle mit Antiseptika, Handschuhwechsel vor Implantation und dem Gebrauch steriler Einführhilfen geachtet werden.
Die Vermutung des Ursprungs der BIA-ALCL-Entstehung in der Inflammation wird durch die Expression des Aktivitätsmarkers CD30 von den BIA-ALCL-Zellen und durch die Lokalisation des Lymphoms in der fibrotischen Kapsel oder der Seromflüssigkeit untermauert, da beide eine Reaktion des Gewebes auf Entzündung darstellen [1, 2, 23].
Stadium | Beschreibung |
IA | T1 N0 M0 |
IB | T2 N0 M0 |
IC | T2 N0 M0 |
IIA | T4 N0 M0 |
IIB | T1-3 N1 M0 |
III | T4 N1-2 M0 |
IV | T1-4 N0-2 M1 |
Diagnostik
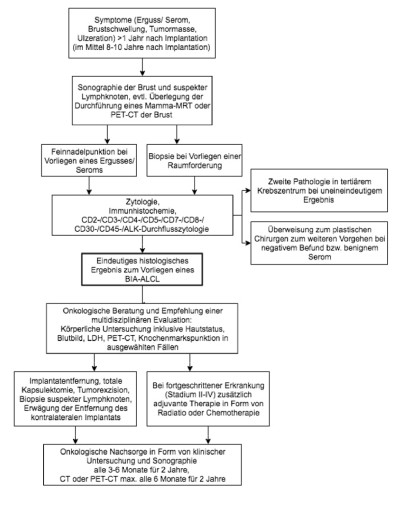
Aufgrund der Seltenheit der Krankheit und dem damit einhergehenden fehlenden Bewusstsein vieler Ärzte wird die Diagnose des BIA-ALCL oft erst spät gestellt. Da die Anzahl der Patientinnen, die sich Brustimplantate im Rahmen einer Brustvergrößerung oder Brustrekonstruktion einsetzen lassen, steigt, ist ein ausreichendes Verständnis für das BIA-ALCL essentiell, um eine schnelle Diagnose und Behandlung zu gewährleisten [24]: siehe Abb. 2.
Abb. 2: Diagnostik und Therapie des BIA-ALCL, modifiziert nach den National Comprehensive Cancer Network (NCCN) Guidelines [25] und Empfehlungen der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) Kommision Mamma [15].
Leitsymptom Spätserom: Jedes Serom, welches über ein Jahr nach Implantation auftritt, sollte als suspektes BIA-ALCL gewertet werden [8]. Außerdem sollte bei dem Vorliegen einer Brustschwellung, Entzündung oder Ulzeration an das mögliche Vorliegen eines BIA-ALCL gedacht werden [11]: vgl. Tab. 1. Eine adäquate Anamnese und körperliche Untersuchung sind zwingend erforderlich, um andere wesentlich häufigere Ursachen für die Symptomatik, wie beispielsweise eine Verletzung oder Infektion, auszuschließen [16].
Die Mammasonographie eignet sich ausgezeichnet als initiales bildgebendes Verfahren zur Verifizierung eines Seroms oder einer Raumforderung sowie zur Darstellung vergrößerter Lymphknoten. Zusätzlich oder ergänzend kann eine MRT- oder CT-Untersuchung erwogen werden. Die Anwendung der Mammographie ist in der Diagnostik des BIA-ALCL jedoch nicht geeignet. Bei Bestätigung eines Seroms sollte dieses anschließend punktiert werden; im Falle des Vorliegens einer tumorösen Raumforderung ist eine Biopsie indiziert. [8 ,11] Das Serompunktat sollte mittels Kultur, Zytologie, Durchflusszytologie und Immunhistochemie vor allem auf CD30 und ALK getestet werden: siehe Abb. 2, [7 ,21]. Außerdem kann es zentrifugiert und das paraffinfixierte Sediment im Zellblock Hämatoxylin-Eosin gefärbt werden [9]. Differentialdiagnostisch wird das Punktat auf Infektion, Entzündung, idiopathische Implantatruptur, Serom, Hämatom und anderen malignen Ursprung sowie histopathologisch untersucht.
Ein Biopsat sollte formalinfixiert und wie beschrieben untersucht werden [9 ,11].
Im Falle der Diagnosebestätigung wird zur weiterführenden Ausdehnungsdiagnostik die Anwendung eines PET-CT empfohlen [8 ,11].
Therapie
Die Therapie der Erkrankung richtet sich wie bei jeder Tumorerkrankung nach dem Stadium und sollte multidisziplinär nach Abschluss des Stagings in einem Tumorboard diskutiert werden [11, 21].
Generell gilt bei Operabilität als First-Line-Therapie mit dem besten Outcome die Implantatentfernung inklusive Kapsulektomie sowie die Exzision von tumorösen Raumforderungen und Entfernung von suspekten Lymphknoten [1, 2, 8, 11, 24]. Bei einer R0-Resektion ist von einer ausreichenden Therapie auszugehen [21].
Zudem ist die kontralaterale Implantatentfernung inklusive histopathologischer Aufarbeitung der Kapsel empfohlen, da in 4,6 % der Fällen ebenfalls die Gegenseite vom BIA-ALCL betroffen ist [11, 12, 19].
Die aktuelle TNM-Klassifikation ist in Tab. 2 zusammengefasst. Im Falle einer fortgeschrittenen Erkrankung mit Vorliegen von Lymphknotenmetastasen oder Fernmetastasen, Stadium IIB bis IV, oder wenn keine komplette Resektion bzw. Kapsulektomie möglich ist, sollte eine adjuvante Therapie in Form von Chemotherapie und/oder Radiatio diskutiert werden [11]. Beim Vorliegen von regionalen Lymphknotenmetastasen ist eine Chemo- und/oder Radiotherapie, bei systemischer Ausbreitung eine Chemotherapie indiziert [2].
Tab. 2: TNM-Staging des BIA-ALCL, modifiziert nach Clemens et al. [24] | |
TNM | Beschreibung |
T: Primärtumor | |
T1 | Auf einen Erguss oder eine Schicht an der luminalen Seite der Kapsel beschränkt |
T2 | Frühe Kapselinfiltration |
T3 | Zellaggregat oder Kapselinfiltration |
T4 | Infiltration über die Kapsel hinaus |
N: regionäre Lymphknoten | |
N0 | Keine Lymphknotenbeteiligung |
N1 | Ein regionärer Lymphknoten betroffen |
N2 | Mehrere regionäre Lymphknoten betroffen |
M: Fernmetastasen | |
M0 | Keine Fernmetastasen |
M1 | Fernmetastasen vorhanden |
Als Chemotherapie-Regime wird bis dato vor allem das in der Lymphom-Therapie bewährte CHOP-Schema (Cyclophosphamid, Hydroxydaunorubicin, Vincristin in Kombination mit Prednison) angewandt [1, 5, 8, 20]. In fortgeschrittenen Stadien kann zudem die Anwendung einer Stammzelltransplantation erwogen werden [20].
Desweiteren bietet das Antikörper-Wirkstoff-Konjugat Brentixumab-Vedotin (SGN 35) eine alternative gezielte Therapiemethode [8]. Es besteht aus einer Kombination eines chimären CD30-Antikörpers cAC10 und dem Tubilin Toxin Monomethyl Auristatin E (MMAE) [1] und führt so zur Internalisierung der Tumorzellen mit anschließendem Wachstumsstop und Apoptose [2]. Brentuximab- Vedotin ist eine gute neue Therapieoption und auch in der First-Line-Therapie in Erwägung zu ziehen [4].
Zur Durchführung der Nachsorge nach erfolgter Therapie gibt es bis dato keinen eindeutigen Konsens. Es sollten eine klinische Untersuchung alle vier bis sechs Monate über einen Zeitraum von zwei bis fünf Jahren, eine sonographische Kontrolle einmal im Jahr für drei Jahre sowie eventuell PET-CT-Untersuchungen durchgeführt werden, um ein eventuelles Wiederauftreten der Erkrankung frühstmöglich diagnostizieren und therapieren zu können [8, 11, 21].
Da bis dato keine definitive Assoziation zwischen glatten Implantaten und dem Auftreten von BIA-ALCL bekannt ist, ist der Einsatz von glatten Implantaten eine mögliche Option zur Rekonstruktion nach Implantatentfernung und Kapsulektomie bei BIA-ALCL [3, 8], kann jedoch nicht sicher empfohlen werden und sollte am spezifischen Fall multidisziplinär diskutiert werden [11]. Des Weiteren ist zu empfehlen, die Rekonstruktion erst nach einem Jahr der Remission durchzuführen [15].
Eine präventive bzw. prophylaktische Implantatentfernung ist aufgrund des geringen Risikos der Entwicklung eines BIA-ALCL nicht indiziert [11, 16].
Prognose
Aufgrund der geringen Fallzahlen des BIA-ALCL ist bis jetzt keine definitive Aussage zur Prognose möglich [16]. Es scheint jedoch eine gute Prognose bei früher Diagnose und adäquater Therapie zu haben [6, 19]. Die meisten Fälle zeigen einen indolenten Verlauf, nichtsdestotrotz ist es eine maligne Erkrankung und sollte dementsprechend in jedem Fall therapiert werden [26]. Generell ist eine schlechtere Prognose und eine niedrigere Remissionsrate im Falle des Vorliegens einer großen Tumormasse bzw. einer tumorösen Raumforderung zu erkennen [1– 5, 19].
Das mediane Überleben liegt bei 12–13 Jahren nach Erreichen einer kompletten Remission [5, 20]. Das fünf-Jahres- Gesamtüberleben wird mit 89 % angegeben [15].
Die Zwei-Jahres-Überlebensrate liegt bei der limitierten Form des BIA-ALCL wahrscheinlich bei > 95 %, wobei diese bei der ausgedehnten systemischen Form lediglich bei 52,5 % liegt [2, 12].
Zusammenfassung
Brustimplantate sind mit einem möglichen, wenn auch seltenen Risiko für das Auftreten eines BIA-ALCL verbunden. Häufigstes Symptom ist das Auftreten eines sogenannten Spätseroms. Der entscheidende Nachweis erfolgt durch den Nachweis CD30-positiver Tumorzellen im Punktat oder Biopsat. Therapie der Wahl ist die Implantatentfernung und komplette Kapsulektomie.
Die Prognose der Erkrankung ist bei frühzeitiger Diagnose und adäquater Therapie sehr günstig einzuschätzen. Allerdings sind bis dato nur geringe Fallzahlen bekannt und keine genaue Aussage hinsichtlich der Inzidenz und Prognose zu tätigen.
Die bis dato geringe Anzahl an bekannten Fällen des BIA-ALCL ist eventuell auf ein nicht vorhandenes Bewusstsein der Erkrankung und der damit verbundenen Unterdiagnostizierung zurückzuführen.
Aufgetretene Fälle eines BIA-ALCL sollten unbedingt an das BfArM gemeldet werden: www.bfarm.de – der folgende Kurzlink führt direkt zum Dokument: https://tinyurl.com/scl8l9b/.
Zusätzlich wird an der Etablierung eines verpflichtenden nationalen und internationalen Implantatregisters gearbeitet, wodurch seltene Nebenwirkungen von Brustimplantaten besser erkannt werden können und eine größere Transparenz entsteht [27–29].
Aufgrund des nunmehr bestätigten Nachweises der unmittelbaren Assoziation zwischen dem Einsatz von Brustimplantaten und dem Auftreten des BIA-ALCL sollte dieses Risiko Bestandteil der OP-Aufklärung sein. Im Rahmen der Aufklärung sollten Patientinnen über die Existenz des BIA-ALCL informiert, mit den potenziellen Symptomen vertraut gemacht werden und die Empfehlung zur ärztlichen Vorstellung bei Auftreten potenzielle r Symptome erhalten [30]. Jedoch ist die Schwierigkeit der Risikodarstellung aufgrund der geringen Fallzahlen nicht zu unterschätzen.
Antonia Dierks1, Prof. Dr. med. Christian Jackisch2, Prof. Dr. med. Henrik Menke1, Sana Klinikum Offenbach
1 Klinik für Plastische, Ästhetische und Handchirurgie – Zentrum für Schwerbrandverletzte –
2 Klinik für Frauenheilkunde und Geburtshilfe
Anschrift für die Verfasser: Prof. Dr. med. Henrik Menke, Sanaklinikum Offenbach, Starkenburgring 66, 63069 Offenbach
Die CME-Fragen und Literaturhinweise finden Sie in der PDF-Version der aktuellen Ausgabe auf unserer Website unter https://www.laekh.de/heftarchiv/ausgabe/2020/april-2020