VNR: 2760602020189220004
Dr. med. Sebastian Reineke, Dr. med. Andreas Strack, Dr. med. Christian Gernoth, Dr. med. Peter Illing
Einleitung
Die Trichterbrust (Pectus excavatum) stellt die häufigste angeborene Brustwanddeformität dar. Die Häufigkeit liegt bei ca. 1–8 von 1.000 Lebendgeburten mit einem Geschlechtsverhältnis von 4–5:1 (männlich:weiblich). Es finden sich familiäre Häufungen. Der genaue Pathomechanismus der Fusionsstörung zwischen Rippen und Sternum ist nicht bekannt. Es besteht eine Assoziation mit Bindegewebserkrankungen wie beispielsweise dem Marfan-Syndrom [1–3]. Zudem konnte eine Häufung von muskuloskelettalen Deformitäten, wozu auch die Trichterbrust zählt, bei Patientin mit angeborenen Zwerchfellhernien gezeigt werden [4].
Klinik
Die Klinik der Trichterbrust ist stark von der Ausprägung und dem Patientenalter abhängig. Bei Kleinkindern können paradoxe Atembewegungen und Einziehungen als Zeichen einer Thoraxinstabilität beobachtet werden. Mit zunehmendem Alter und Eintritt in die Pubertät entwickelt sich bei ausgeprägter Form ein Circulus vitiosus aus:
- a) reduzierter Belastbarkeit und Thoraxschmerzen bei sportlicher Betätigung, teilweise mit Atemnot,
- b) der persönlichen Wahrnehmung eines körperlichen Makels,
- c) daraus resultierendem Vermeiden sportlicher Betätigung mit einhergehender sozialer Isolation,
- d) einer Schwächung der Muskulatur von Brust und Rücken und damit wiederum
- e) einer Verstärkung der Trichterausprägung.
Ferner können kardiale Arrhythmien auftreten [1, 5].
Diagnostik
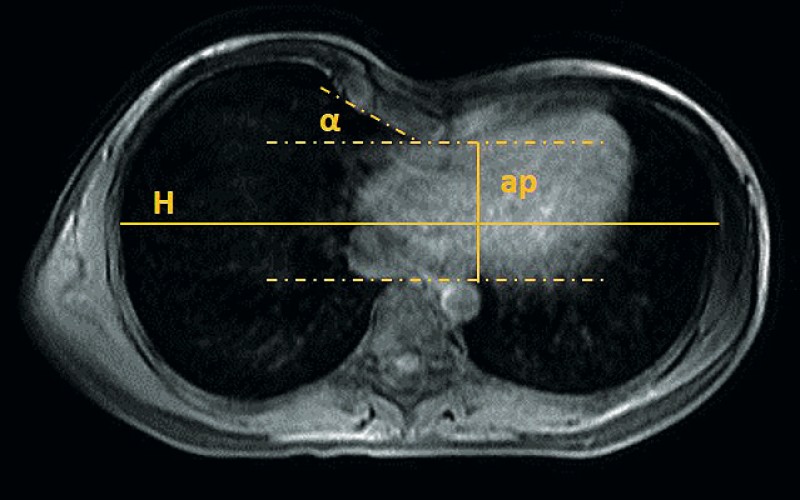
Neben der detaillierten Anamnese mit Evaluation der psychosozialen Belastung der Patienten sind die kardiale und pneumologische Basisdiagnostik bestehend aus Elektrokardiographie, Echokardiographie und Lungenfunktionstest zusammen mit einer Schnittbildgebung des Thorax die wesentlichen Säulen der Diagnostik [1]. In der Bildgebung wird der Haller-Index als quantifizierendes Maß herangezogen. Dieser ist definiert als Quotient aus dem inneren horizontalen und anterior-posterioren Thoraxdurchmesser im Bereich der tiefsten sternalen Impression in der Transversalebene (siehe Abb. 1).
Abb 1: MRT-Bild bei Trichterbrust: Hilfslinien zur Berechnung des Haller-Index und des Sternumwinkels a sind eingezeichnet. Der Haller-Index berechnet sich als HI=H/ap und liegt in diesem Beispiel bei 4,3.
Ein positiver Haller-Index liegt, je nach Autor, bei einem Wert ≥ 3,25–3,5 vor. Als zusätzliches Maß wird der Winkel des Sternums zur Horizontalen bestimmt [6, 7].
Aktuelle Arbeiten favorisieren als Schnittbildgebung die Magnetresonanztomographie (MRT) gegenüber der Computertomographie (CT). Dabei geht es einerseits um die Vermeidung der Strahlenbelastung und andererseits um die Möglichkeit dynamischer Untersuchungen der Thoraxform während eines Atemzyklus in Kombination mit funktionellen Untersuchungen des Herzens (c-MRT) [8].
Therapie
Die Therapie der Trichterbrust war mit der von Ravitch 1949 vorgestellten Methode lange Zeit eine Domäne der offenen, invasiven Chirurgie. Dieses Verfahren, klassischerweise im Vorschulalter durchgeführt, beinhaltet eine partielle Resektion der knorpeligen Rippenanteile sowie eine Osteotomie des Sternums und wird heutzutage nur noch in Einzelfällen angewendet [2]. Seit den 1990er-Jahren stehen, dank der Entwicklung und kontinuierlichen Verbesserung minimalinvasiver Techniken, schonendere operative, aber auch konservative Verfahren zur Verfügung. Der Entwickler des MIRPE (Minimally invasive repair of pectus excavatum)-Verfahren Donald Nuss stellte zudem einen Entscheidungspfad für die Indikationsstellung konservativer und operativer Therapieformen auf, der breite Anwendung findet. Darin wird für milde bis moderate Trichterausprägungen ohne Progression, ohne Einschränkung der kardialen oder pulmonalen Funktion und ohne bzw. mit geringer psychosozialer Belastung eine konservative Therapie empfohlen [9].
Konservative Therapie
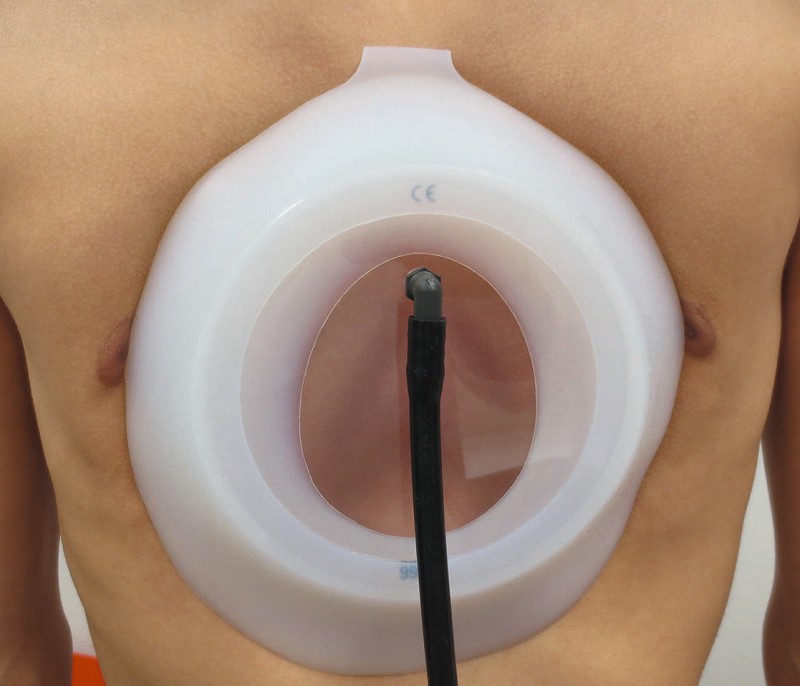
Diese besteht maßgeblich aus Stärkung der Brust- und Rückenmuskulatur durch intensive sportliche Betätigung. Ein weiteres, in jüngerer Vergangenheit an Bedeutung gewinnendes konservatives Verfahren stellt die Saugglockentherapie dar. Die Glocke wird intermittierend für einige Minuten bis Stunden auf den Thorax aufgesetzt. Dabei wird durch eine Handpumpe von den Patienten selbst ein moderater Unterdruck erzeugt (siehe Abb. 2).
MIRPE (Minimally invasive repair of pectus excavatum)-Verfahren
Die Indikationen für die minimalinvasive operative Therapie sind klar definiert. Liegen zwei oder mehr der folgenden sechs Kriterien vor, so ist eine Operation sinnvoll:
- a) Symptomatischer Patient und/oder Progression der Trichterausprägung.
- b) Moderate bis ausgeprägte symmetrische oder asymmetrische Deformität.
- c) Positiver Haller-Index in der Bildgebung und/oder Kompression oder Verlagerung von Herz oder Lunge.
- d) Obstruktives oder restriktives Flussmuster in der Lungenfunktionsdiagnostik.
- e) Herzrhythmusstörungen und/oder Mitralklappenprolaps.
- f) Psychosoziale Beeinträchtigung des Patienten [9].
Patienten, die für eine operative Korrektur vorgesehen sind, werden nach umfänglicher Aufklärung zunächst mit physiotherapeutischen Maßnahmen vorbereitet, um durch Kräftigung der Muskulatur und Atemgymnastik das postoperativ erforderliche, hohe Maß an Adhärenz seitens der Patienten sicherzustellen.
Das MIRPE-Verfahren beruht auf dem Einbringen eines oder mehrerer Stahlbügel unter dem Sternum unter thorakoskopischer Kontrolle. Maßgeblich für Anzahl und Lokalisation der Bügel sind Trichterform und -größe sowie die Lokalisation des tiefsten Punkts.
Durch den/die Bügel wird das Sternum aufgerichtet und stabilisiert. Zunächst wird der Bügel extern mit Hilfe einer Schablone entsprechend der individuellen Thoraxform gebogen. Mit Hilfe eines Führungsstabes wird dann unter der Haut und unter dem Musculus pectoralis ein Tunnel bis an den Trichterrand präpariert.
Unter thorakoskopischer Kontrolle erfolgt das Eindringen in die Thoraxhöhle und das vorsichtige Tunneln unterhalb des Sternums unter Vermeidung einer Verletzung des anliegenden Perikards. Am gegenüberliegenden Trichterrand tritt der Führungsstab aus dem Thorax wieder aus und der Tunnel wird bis an den zuvor markierten gegenüberliegenden lateralen Rand fortgeführt.
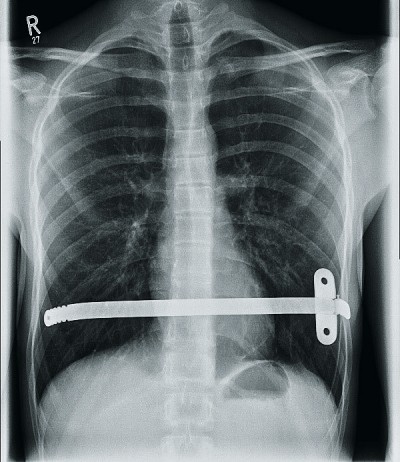
Mit Hilfe des Führungsinstrumentes oder eines am Xiphoid eingebrachten Hakens erfolgt das Anheben des Sternums. Anschließend wird der Metallbügel mit Hilfe eines Mersilene-Bandes mit dem Führungsinstrument konnektiert. Unter Rückzug des Führungsstabes wird der gebogene Bügel unter dem Sternum durchgezogen. Da der Bügel zunächst mit seiner Konkavität zum Sternum zu liegen kommt, wird er in situ gewendet, sodass die konvexe Seite nun das Sternum anhebt [9] und die Thoraxform plan ist. Sollte ein zweiter Bügel aufgrund der Ausprägung des Trichters notwendig sein, wird dieser in der Regel kaudal des ersten, teilweise auch gekreuzt, auf gleiche Weise eingebracht [11]. Abschließend erfolgt das Anbringen einer Stabilisatorplatte am linken Ende des Bügels, um ein späteres Drehen oder Dislozieren des Bügels zu verhindern (siehe Abb. 3).
Abb. 3: Röntgen-Thorax-Aufnahme vor Entfernung eines Nussbügels. Links thorakal sind die Stabilisatorplatte und eine Drahtcerklage erkennbar.
Die Länge der Bügel und die Fixierungstechniken variieren geringfügig zwischen den Anwendern. Die Vertreter der kurzen Bügel, allen voran Hans K. Pilegaard, sehen deren Vorteile in einem einfacheren Einbringen durch kürzere Tunnelstrecken, einer gleich niedrigen Rate an späteren Bügeldrehungen in situ bei geringerem Fixierungsaufwand der Bügel sowie einem einfacheren Entfernen durch lediglich einseitige Fixierung des Bügels an den Rippen [11]. Klassischerweise verbleiben die Bügel für ca. zwei Jahre in situ und werden dann operativ wieder entfernt [11].
Postoperatives Management
In der direkten postoperativen Phase ist eine konsequente Schmerzbehandlung elementar, um die Patienten zeitnah mobilisieren und entlassen zu können. Ein nach wie vor wichtiger Baustein dieser postoperativen Schmerztherapie ist trotz des zunehmenden Einsatzes von anderweitigen regionalen Nervenblockaden ein thorakal eingelegter Epiduralkatheter. Dieser hat bei optimaler Lage und Nutzung, vor allem in den ersten 24 Stunden postoperativ, die beste analgetische Potenz. Dies gilt insbesondere auch im Hinblick auf die rein intravenöse Schmerztherapie [12].
Durch eine frühzeitig parallel begonnene, multimodale Schmerztherapie mit nichtsteroidalen Antirheumatika sowie Koanalgetika wie Clonidin und Gabapentin kann der Epiduralkatheter dann zumeist innerhalb der ersten 96 Stunden entfernt werden. Dieses Vorgehen bietet den Vorteil, die negativen Effekte des Epiduralkatheters wie die eingeschränkte Mobilisation und die sympathikolysebedingte Kreislaufdepression, aber auch die bei rein intravenöser Opiatgabe häufigen Nebenwirkungen wie Übelkeit und Erbrechen, Harnretention und Pruritus, ohne nachweisliche Nachteile für eine adäquate Schmerztherapie minimieren zu können.
Der Erfolg ist dabei abhängig von der institutionell vorhandenen Erfahrung im Umgang mit rückenmarksnah eingelegten Schmerzkathetern [13, 14].
Für die ersten Wochen postoperativ gilt ein Sport- und Hebeverbot und den Patienten wird darüber hinaus nahegelegt, Kontaktsportarten in den ersten drei Monaten zu vermeiden [11]. Wichtig ist eine Aufklärung darüber, dass eine Herz-Druckmassage bei Patienten mit einliegendem Bügel im Falle einer Reanimationssituation nur sehr eingeschränkt bis gar nicht möglich ist.
Komplikationen
Als häufigste postoperative Komplikationen sind Pneumothorax (3,5–27 %), Pleuraergüsse (2–11 %), Fieber (1,9–4,6 %), Wundinfektionen (2,2 %) und die Rotation oder Dislokation des Bügels (0,6–5,7 %) bekannt [7, 15]. Das Trichterbrustrezidiv wird mit Häufigkeiten zwischen 1,2 % und 10 % angegeben [1, 7]. Schwere, lebensbedrohliche Komplikationen sind sehr selten und Todesfälle die absolute Ausnahme. Bei diesen seltenen Fällen handelt es sich primär um Verletzungen des Herzens oder herznaher mediastinaler Strukturen [7, 15, 16].
Outcome
Betrachtet man das subjektive Operationsergebnis, so liegen die Zufriedenheitsangaben patientenseitig laut Literatur bei 95–96 % [1, 7]. Verschiedene objektive Outcomeparameter für den Operationserfolg wurden in den vergangenen Jahren untersucht. Der Fokus lag hierbei vor allem auf kardiopulmonalen Belastungsuntersuchungen. Nicht immer zeigten sich bei heterogenen und teilweise in der Größe limitierten Kollektiven sowie variierenden Beobachtungszeiträumen vergleichbare Ergebnisse [17].
Eine vergleichsweise große Studie aus Dänemark mit 44 minimalinvasiv operierten Patienten und 26 Personen im altersgematchten Kontrollkollektiv untersuchte die kardiopulmonale Belastbarkeit über eine Beobachtungszeit von drei Jahren. Es wurde gezeigt, dass sich drei Jahre nach Korrekturoperation und Entfernung der Bügel sowohl der maximale Herzindex als auch die forcierte Einsekundenkapazität (FEV1) als Maße für die kardiopulmonale Belastbarkeit bei den operierten Patienten normalisiert hatten. Präoperativ waren beide Werte gegenüber der Kontrollgruppe signifikant niedriger [18].
Die Arbeitsgruppe von Donald Nuss berichtet aus ihrem großen Patientenkollektiv von über 1.500 Patienten über eine Verbesserung der durch die Trichterform beeinträchtigten Thoraxbewegung nach der Operation und erklärt damit die Verbesserung der Lungenfunktionsparameter [19].
Fazit
Die Trichterbrust stellt eine ernst zu nehmende und zugleich gut behandelbare Erkrankung dar. Allerdings ist die Kostenübernahme der Behandlung mit konservativen oder operativen Maßnahmen stets eine zu begründende Einzelfallentscheidung. Heutzutage stellt das MIRPE-Verfahren die am häufigsten angewendete operative Therapieform mit sehr guten Ergebnissen dar. Die konservative Therapie mit der Saugglocke bildet für milde Ausprägungen im jüngeren Alter eine gute und zunehmend angewandte Option, da sich das Skelett noch leichter formen und somit eine spätere invasive Intervention verhindern lässt.
Entscheidend für die große Patientenzufriedenheit und die sehr guten Ergebnisse ist ein hohes Maß an Erfahrung auf Seiten der Behandler. Dabei kommt es auf ein gut abgestimmtes und eng zusammenarbeitendes interdisziplinäres Team aus Kinderanästhesisten, Kinderchirurgen, Pflegenden und Physiotherapeuten an.
Dr. med. Sebastian Reineke, Dr. med. Andreas Strack, Dr. med. Peter Illing, Klinik für Kinderchirurgie und Zentrum fürschwerbrandverletzte Kinder, Klinikum Kassel
Dr. med. Christian Gernoth, Anästhesie, operative Intensivmedizin und Schmerztherapie, Helios Klinikum Duisburg
Kontakt zu den Autoren:
E-Mail: sebastian.reineke@klinikum-kassel.de
Die CME-Fragen und Literaturhinweise finden Sie in der PDF-Version der aktuellen Ausgabe auf unserer Website unter https://www.laekh.de/heftarchiv/ausgabe/2020/juli-august-2020
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Die Trichterbrust bei Kindern und Jugendlichen – ein Überblick über die Therapieoptionen“ von Dr. med. Sebastian Reineke, Dr. med. Andreas Strack, Dr. med. Christian Gernoth und Dr. med. Peter Illing finden Sie im Mitglieder-Portal der Landesärztekammer Hessen (https://portal.laekh.de) sowie auf den Online-Seiten des Hessischen Ärzteblattes (www.laekh.de). Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Mitglieder-Portal vom 25. Juni 2020 bis 24. Juni 2021 möglich. Die Fortbildung ist mit zwei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Dieser Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte.